鱼腥草饮片标准汤剂的制备及质量控制方法研究
2020-07-09邱连建朱卫星陈会朋
邱连建, 朱卫星, 陈会朋
[1.北京中医药大学深圳医院(龙岗),广东深圳 518000;2.清远市中医院,广东清远 511500]
鱼腥草为三白草科植物蕺菜Houttuynia cordata Thunb.的新鲜全草或干燥地上部分。味辛,性微寒,具有清热解毒、消痈排脓、利尿通淋的功效[1]。临床上常与其他中药配伍用于治疗肺炎、支气管炎、流行性腮腺炎、咽炎、风热型急性卡他性结膜炎、病毒性肠炎等疾病[2-4],具有较高的临床应用价值。其化学成分有生物碱、黄酮类、有机酸、挥发油类等[5]。2015年版《中华人民共和国药典》[1](以下简称《中国药典》)以甲基正壬酮为对照,利用薄层色谱对鱼腥草进行定性鉴别,并规定了鱼腥草浸出物限度,但缺乏相应的有效成分含量控制指标,因此,鱼腥草的质量标准有待于进一步的提高与完善。
标准汤剂是以中医理论为指导,按照传统煎药方式进行煎煮得到的单味中药饮片水煎剂,用于制定中药配方颗粒质量标准,以保证中药配方颗粒与标准汤剂的一致性[6]。因此,本研究从标准汤剂角度,以市场上收集的24批鱼腥草饮片为原料,按照全草类中药饮片标准汤剂制备工艺,进行鱼腥草饮片标准汤剂研究,建立了鱼腥草标准汤剂的特征图谱,以及有效成分槲皮苷的含量测定,以期为鱼腥草配方颗粒质量评价提供参考,现将研究结果报道如下。
1 材料
1.1仪器与试剂Waters高效液相色谱仪,Agilent 1260 infinity高效液相色谱仪,CHEMSTATION C.01.04化学工作站,Kromasil-C18(4.6 mm×250 mm,5 μm)色谱柱,Agilent Eclipse XDB-C18(4.6 mm ×250 mm,5μm)色谱柱,Phenonmenex Luna-C18色谱柱;ME204E万分之一天平、XP26百万分之一天平(梅特勒—托利多公司);KQ-500DE数控超声清洗器(昆山市超声仪器有限公司);HWS28电热恒温水浴锅(上海一恒科技有限公司)。甲醇、乙醇(天津富宇精细化工有限公司),为分析纯;液相用甲醇、乙腈(德国默克股份有限公司),为色谱纯;磷酸(天津市科密欧化学试剂有限公司),为色谱纯;超纯水(取自实验室Milli-Q超纯水系统,德国默克股份有限公司)。
1.2试药绿原酸(含量96.2%,批号:110753-201415)、金丝桃苷(含量93.3%,批号:111521-201205)、槲皮苷(含量90.6%,批号:111538-201606)均由中国食品药品检定研究院提供。隐绿原酸(含量≥98%,批号:15121701)、新绿原酸(含量≥98%,批号:151217)均来自成都普菲德生物技术有限公司。
1.3样品分别收集了3个产地共24批鱼腥草样品,样品经广东一方制药有限公司质检中心鉴定为鱼腥草。按照2015年版《中国药典》进行含量测定。样品信息及含量测定结果见表1。
2 方法与结果
2.1鱼腥草饮片标准汤剂的制备取鱼腥草饮片100 g,加水煎煮2次,第1煎加水14倍量,浸泡30 min,保沸20 min,350目筛网滤过。第2煎加水12倍量,保沸15 min,350目筛网滤过。合并2次滤液,减压浓缩至250 mL流浸膏,真空冷冻,即得。
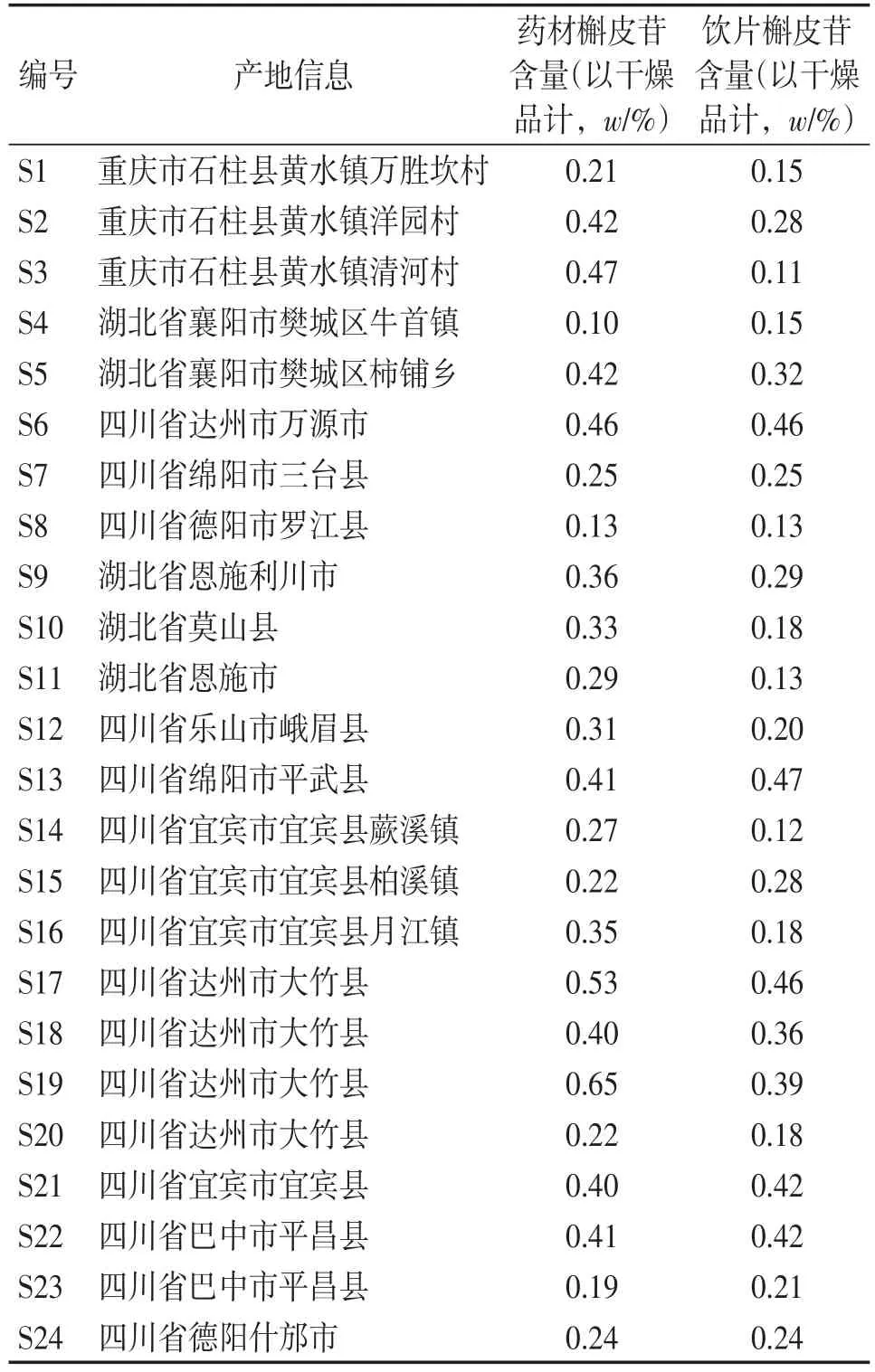
表1 鱼腥草药材与饮片信息表Table 1 Data of Herba Houttuyniae materials and crude slices
2.2出膏率测定量取煎煮液总体积V(室温),搅拌均匀后精密吸取25 mL提取液至干燥恒质量的蒸发皿中。水浴蒸干后,于105℃干燥3 h,干燥器中冷却后,迅速精密称定质量m1。药材质量为m2。测出膏率=(m1×V)/(0.025×m2)×100%。计算平均出膏率,结果见表2。结果表明,24批鱼腥草标准汤剂平均出膏率为17.40%,标准偏差(SD)为1.41%。《中药配方颗粒质量控制与标准制定技术要求》允许出膏率为均值的70%~130%或均值加减3倍的SD,因此,鱼腥草标准汤剂出膏率范围为12.18%~22.62%或13.17%~21.63%。
2.3鱼腥草饮片标准汤剂含量测定
2.3.1 色谱条件色谱柱:Kromasil-C18(4.6 mm×25 cm,5μm);流动相:乙腈—0.1%磷酸水(23∶77);流速:1.0 mL/min;检测波长:254 nm;柱温:30℃;进样量:10μL。
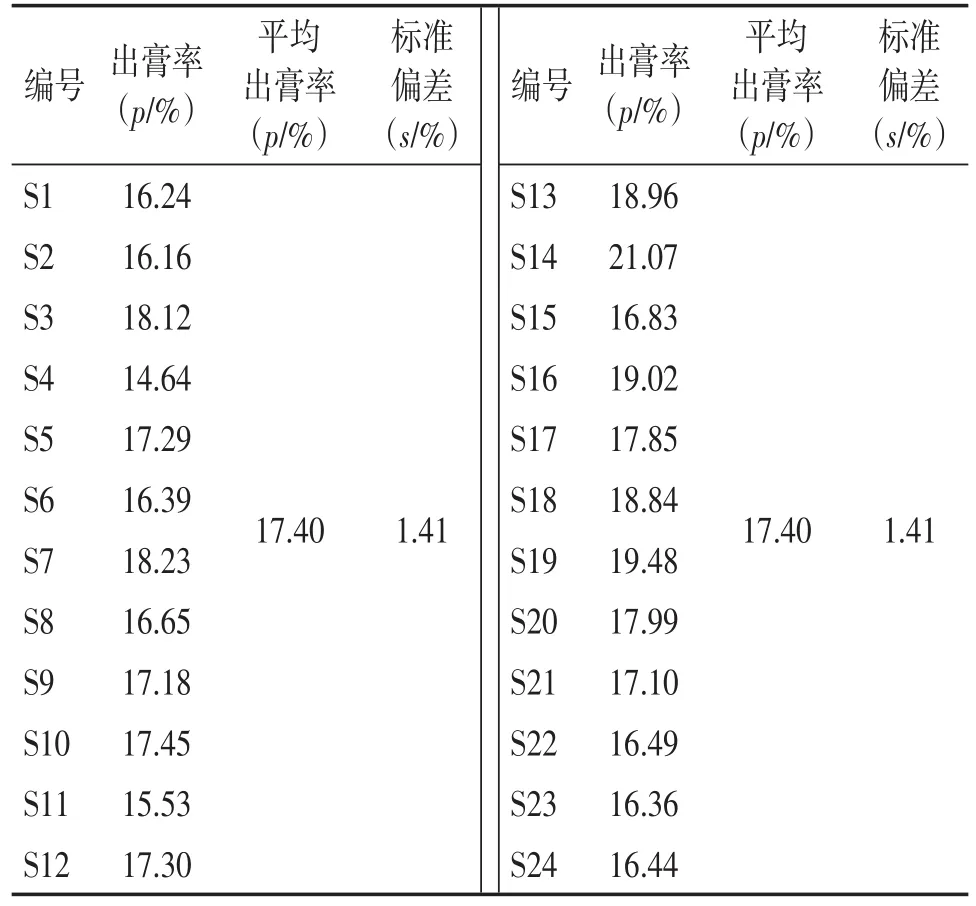
表2 24批鱼腥草饮片标准汤剂出膏率的测定Table 2 The extraction rate of twenty-four batches of Herba Houttuyniae crude slices standard decoction(p/%)
2.3.2 对照品溶液制备 取槲皮苷对照品适量,精密称定,用体积分数50%甲醇制成质量浓度为30μg/mL的对照品储备液。
2.3.3 供试品溶液的制备 取鱼腥草饮片标准汤剂冻干粉约0.1 g,精密称定,精密加入50 mL体积分数50%甲醇溶液溶解并超声处理(功率250 W,频率40 kHz)30 min,放冷,补足失质量,摇匀,滤过,即得。
2.3.4 线性关系考察 以“2.3.2”项下的槲皮苷对照品储备液为基础,依次配制浓度为15.0、7.5、3.7、1.8、0.9μg/mL的溶液。分别精密吸取10μL,按“2.3.1”项下方法进样记录峰面积。以槲皮苷对照品浓度(μg/mL)为横坐标,峰面积积分值为纵坐标,绘制标准曲线,求得回归方程:y=27.88x-3.520,R2=1。结果表明在0.973~31.137 μg/mL范围内对照品浓度与峰面积线性关系良好。
2.3.5 精密度试验 精密吸取槲皮苷对照品(31.137μg/mL),按照“2.3.1”项下色谱条件重复进样6次,记录色谱峰保留时间和峰面积值,计算槲皮苷的峰面积的相对标准偏差(RSD)为0.09%。结果表明仪器精密度良好。
2.3.6 重复性试验 取同一批鱼腥草饮片标准汤剂(S1),精密称定,按“2.3.3”项下平行制备供试品溶液6份。精密吸取10μL,按“2.3.1”项下色谱条件测定。结果显示鱼腥草饮片标准汤剂中槲皮苷平均含量为6.16 mg/g,RSD为1.86%,表明该分析方法的重复性良好。
2.3.7 稳定性试验 取鱼腥草饮片标准汤剂供试品溶液(S1),按照“2.3.1”项下色谱条件,分别在0、2、4、6、8、12、30 h进样,测定供试品溶液中槲皮苷的峰面积,计算峰面积RSD为0.41%。结果表明,供试品溶液在30 h内稳定。
2.3.8 加样回收试验 取已知含量的鱼腥草饮片标准汤剂冻干粉(S1)约0.05 g,精密称定,根据标准汤剂中槲皮苷的含量按1∶1的比例添加槲皮苷对照品,按“2.3.3”项下供试品溶液制备方法制成加样回收供试品溶液6份,按“2.3.1”项下色谱条件进行试验。计算供试品溶液中槲皮苷的平均加样回收率为101.48%,RSD为0.87%,结果表明该方法的准确度良好。
2.3.9 鱼腥草饮片标准汤剂含量测定及转移率 取所制备的24批鱼腥草饮片标准汤剂,每批平行2份。按“2.3.3”项下制备供试品溶液,每份精密吸取10μL按“2.3.1”项下色谱条件测定,计算槲皮苷含量,根据公式计算:转移率(%)=结果表明,24批鱼腥草标准汤剂槲皮苷平均含量为6.94 mg/g,槲皮苷含量范围为4.86~9.02 mg/g,槲皮苷转移率均值为46.28%,槲皮苷转移率范围为32.40%~60.16%。
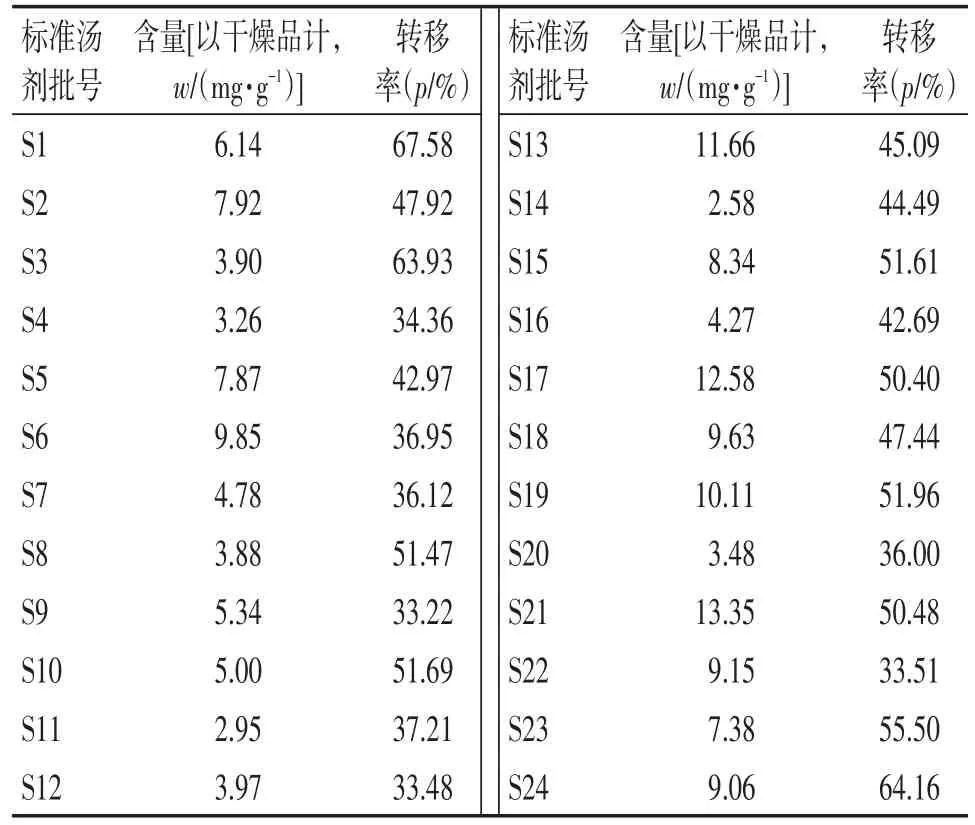
表3 24批鱼腥草饮片标准汤剂槲皮苷含量及转移率Table 3 The content and transfer rate of quercetin in twenty-four batches of Herba Houttuyniae crude slices standard decoction
2.4指纹图谱的建立
2.4.1 色谱条件YMC-Triart C18(250mm×4.6mm,5μm);柱温:30℃;进样量:10μL;检测波长:0~30 min为326 nm,30~80 min为254 nm;以乙腈为流动相A,以0.1%磷酸水为流动相B,按表4规定的梯度进行洗脱,流速为1.0 mL/min。

表4 鱼腥草饮片标准汤剂特征图谱梯度洗脱程序Table 4 The gradient elution procedure for characteristic spectrum of Herba Houttuyniae crude slices standard decoction
2.4.2 供试品溶液制备 取鱼腥草饮片标准汤剂约0.1 g,精密称定,精密加入25 mL的体积分数50%甲醇溶解,称定质量,超声处理(功率250 W,频率40 kHz)30 min,放冷,用体积分数50%甲醇补足减失的质量,摇匀,滤过,取续滤液,即得。
2.4.3 精密度试验 取同一批鱼腥草饮片标准汤剂供试品溶液(S18),按照“2.4.1”项下色谱条件重复进样6次,进样体积10μL。以2号峰绿原酸为参照峰,计算相对保留时间。结果显示各峰的相对保留时间RSD<0.29%,表明该特征图谱的精密度较好。
2.4.4 重复性试验 取同一批鱼腥草饮片标准汤剂(S18)约0.1 g,精密称定,平行6份,按“2.4.2”项下制备供试品溶液。按“2.4.1”项下色谱条件,进样10μL,以2号峰绿原酸为参照,计算相对保留时间。结果显示各峰的相对保留时间RSD<0.15%,表明该特征图谱的重复性良好。
2.4.5 稳定性试验 取鱼腥草饮片标准汤剂(S18)项下供试品溶液,按照“2.4.1”项下色谱条件,分别在0、2、4、8、12、24 h进样,进样10μL,以2号峰绿原酸为参照,计算各峰相对保留时间。结果显示24 h内各色谱峰相对保留时间RSD<2.0%,表明该供试品溶液在24 h内稳定。
2.4.6 样品检测与分析 分别取24批鱼腥草饮片标准汤剂,按“2.4.2”项下方法制备供试品溶液,按“2.4.1”项下色谱条件分别测定及记录高效液相色谱(HPLC)指纹图,见图1。使用中药色谱指纹图谱相似度评价软件对24批鱼腥草标准汤剂特征图谱进行共有峰标识,经分析找到了6个共有峰,其中经对照品指认,指认了其中5个峰,分别是峰1:新绿原酸;峰2:绿原酸;峰3:隐绿原酸;峰5:金丝桃苷;峰6:槲皮苷。见图2。

图1 24批鱼腥草饮片标准汤剂的HPLC指纹图谱Figure 1 HPLC fingerprints of twenty-four batches of Herba Houttuyniae crude slices standard decoction
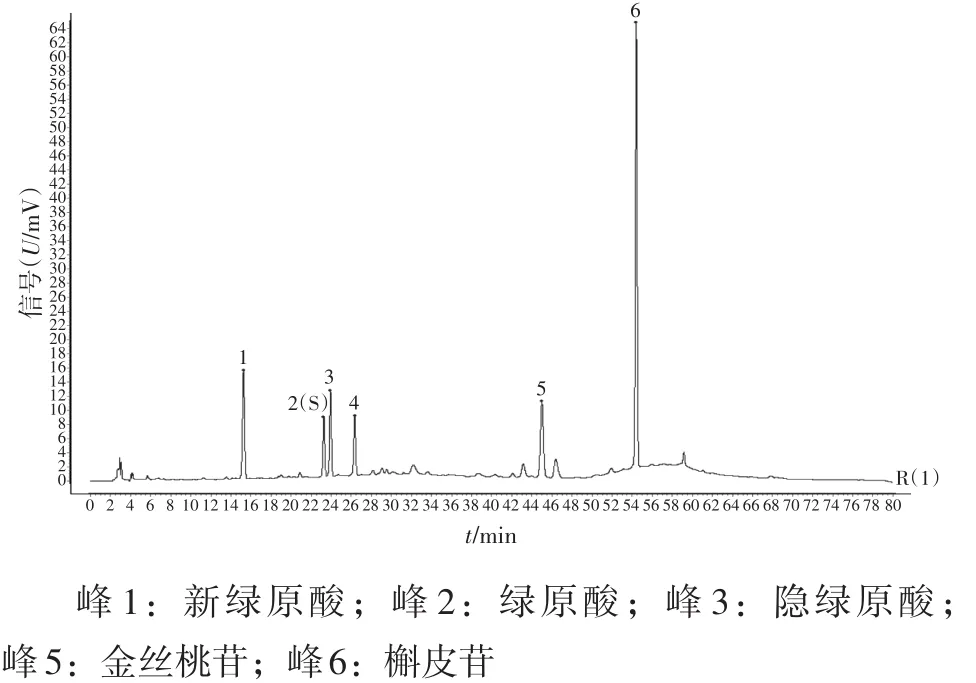
图2 鱼腥草饮片标准汤剂特征图谱Figure 2 The characteristic spectrum of Herba Houttuyniae crude slices standard decoction
3 讨论
本研究考察并建立了鱼腥草饮片标准汤剂的质量控制方法。
3.1供试品处理考察对鱼腥草饮片标准汤剂前处理重点考察了提取溶剂及提取时间。溶剂种类中考察了水、甲醇、70%甲醇、50%甲醇、70%乙醇、乙醇,结果发现特征图谱样品中6个共有特征峰“总峰面积/称样量”比值以50%甲醇作为溶剂时最大,且各峰的分离效果最优;含量测定样品中以50%甲醇作为溶剂时提取效率最高。因此均选择50%的甲醇作为提取溶剂。超声提取不同时间(15、30、45、60 min)的特征图谱色谱峰数目、分离度及特征图谱6个特征峰“总峰面积/称样量”无明显差异,超声30 min已经基本提取完全,且超声提取30 min槲皮苷含量最高,最终均确定超声提取时间为30 min。
3.2鱼腥草饮片标准汤剂质量控制本研究主要从3个方面对鱼腥草标准汤剂的质量控制进行把关:①药材的选择涵盖了鱼腥草的道地产区和主产区,经检测均符合2015年版《中国药典(一部)》的相关项下要求,所选样品从产地、质量水平等方面均具有代表性。②标准汤剂参照国家药典委员会制定的《中药配方颗粒质量控制与标准制定技术要求(征求意见稿)》和国家中医药管理局制定的《医疗机构中药煎药室管理规范》进行制备,与传统汤药在药效和成分上保持一致。③中药是由多成分、多靶点协同发挥作用的,采用指标成分结合指纹图谱方法控制鱼腥草标准汤剂的质量,克服了传统采用1~2种成分含量控制中药质量的不合理性。
2015年版《中国药典》以甲基正壬酮为对照,利用薄层色谱对鱼腥草进行了定性鉴别,但缺乏相应的有效成分含量控制指标,挥发油的量也未进行控制,因此,鱼腥草的质量标准有待于进一步的提高与完善。考虑到鱼腥草中挥发油的含量极低,以及以干鱼腥草作为原料,在制备标准汤剂过程中造成挥发油的损失,采用挥发油中的有效成分作为含量控制指标存在一定的困难。鱼腥草中含有多种黄酮类成分,包括槲皮素、槲皮苷、芦丁、金丝桃苷等,具有杀菌、祛痰、止咳、抗炎、抗过敏等作用,通过对鱼腥草特征图谱研究,发现槲皮苷峰型最高,且分离效果良好。已有文献报道,槲皮苷具有抗病毒、抗炎、利尿等作用[7-8],是鱼腥草的主要有效成分之一,采用槲皮苷作为鱼腥草的含量控制指标也有一定的文献基础[9-14]。因此,本研究采用HPLC测定鱼腥草中槲皮苷的含量,作为鱼腥草的含量控制指标。
中药饮片标准汤剂失去了原有饮片的形态学特征,单纯的指标成分的定性和定量分析难以反映其质量的优劣,故中药饮片标准汤剂质量控制要重视以指纹图谱为主的整体质量控制。本实验选用不同产地的24批鱼腥草制备鱼腥草饮片标准汤剂,考察槲皮苷含量,并建立其HPLC指纹图谱,从指标成分定量和整体定性的角度对鱼腥草进行全面质量控制。本方法准确、可行、重复性良好,可为所有源于鱼腥草汤剂制剂质量标准的制定提供参考。
