新型骨缺损斑马鱼模型构建及修复过程的OCT活体评价
2020-07-09陈婷如林燕萍谢青轩蓝银涛王俐梅
陈婷如, 林燕萍, 谢青轩, 蓝银涛, 邱 婷, 向 湘, 王俐梅, 张 建*
(1.广州医科大学基础医学院生物医学工程系, 广州 511436;2.广东省生物资源应用研究所药物非临床评价研究中心, 广州 510260)
现代医学的核心目标是解决由于疾病、创伤、衰老或遗传等因素造成的组织器官缺损及功能障碍。再生医学的出现给组织器官的修复再生和功能重建带来了希望,是人类医学发展的又一次巨大飞跃[1-3]。设想如果人类有能力将再生医学与临床医学无缝衔接,绝大多数疾病就能治愈,社会老龄化将不再是人类的噩梦,人们就可实现长寿之梦。因此,对再生医学的研究与探讨已经成为一个重大且热门的世界医学科学问题。在再生医学相关研究中,动物模型发挥着至关重要的作用[4-6]。以骨缺损和骨质疏松为代表的骨疾病造成的活动失能极大地影响人的生活质量,更为严重的是,随着老龄化的到来,这些骨病的发病率日益增高,延缓和治疗骨疾病目前已经成为医药领域科研工作全力解决的问题[7-9]。近年来,斑马鱼已成为一种热门的脊椎动物模型,被大量地应用于再生医学、临床医学、发育学、细胞生物学、神经科学、药物学、遗传学、环境毒理学及心理学等学科方面的研究[10-12],特别是在再生医学研究方面。与哺乳动物相比,斑马鱼具有繁殖能力强、体外受精、体外发育、生长发育快、体型小、胚胎及幼体透明且易于饲养等独特优势。更重要的是,斑马鱼基因与人类基因有高达87%的相似度,且在组织器官发育起源及发育过程等方面都具有较高的同源性,因此斑马鱼模型逐渐成为公认的一种人类疾病动物模型[13-15]。早在1980年人们就开始用斑马鱼进行骨骼特征的研究,且斑马鱼作为骨骼研究模式生物已被得到广泛的认可[16]。目前,国内外研究团队纷纷开展以斑马鱼为动物模型的骨疾病研究,并深入对多基因的复杂性骨疾病的病理机制和高通量药物筛选进行更细致的探究。
就目前而言,对斑马鱼骨骼的研究多使用阿辛蓝与茜素红复合染色等有创的表征方法,然而这些方法不但繁琐、耗时、耗材、耗力,更致命的是限制了许多科学研究进程,尤其在再生医学研究方面[17,18]。相关研究亟需一种可以实现活体动态观察骨骼发育与骨骼疾病发生发展的技术方法。光学相干层析成像(optical coherence tomography,OCT)是一种可进行非接触式、非侵入性断层成像的新型光学成像技术[19-21],由于其利用了独特的近红外光散射成像原理,OCT成像深度远高于共聚焦显微镜和光片显微镜为代表的荧光成像技术。我们前期的研究表明,在透明度较高的琼脂样品中,1 325 nm波长的OCT系统具有高达约7 mm的三维成像能力,且不需要进行荧光标记[22]。基于以上优点,我们构建了斑马鱼颅骨损伤再生模型,并利用OCT技术对该模型的颅骨损伤及颅骨再生过程进行活体、无损、动态成像,同时采用病理染色技术验证OCT成像结果的准确性。
1 材料和方法
1.1 试验动物
本研究选取了13条野生型斑马鱼,其中3条斑马鱼作为正常组,10条斑马鱼作为颅骨缺损自然恢复组,分别编号并置于不同容器中培养。斑马鱼饲养环境为(28±0.5)℃的水体,给予的光照周期为14 h光照和10 h黑暗。
1.2 仪器
本研究采用的是频域光学相干层析系统。频域OCT系统结构如图1所示。本OCT系统的光源是一个中心波长为840 nm、光谱带宽为40 nm以上的超辐射发光二极管(InPhenix, 美国)。试验采用一个焦长为 40 mm的扫描物镜(大恒光电,中国),每毫米1 200条刻线的全息光栅(wasatch photonics,美国)和2 048像素的线阵相机(凌云光电,中国),用光纤耦合器将宽带光纤耦合成为50/50的干涉仪。经过测量,本系统轴向分辨率约为8 μm,横向分辨率约为12 μm,该系统对透明物体的成像深度可以达到4 mm左右,对肌肉等组织的成像深度可达2 mm左右[23,24]。本系统采用的扫描阵镜(大族激光,中国)能以18 kHz/s的高成像速度快速采集信息,控制程序是基于C#编写的,运行在台式计算机(戴尔,中国)上,该台计算机还负责数据的存储和后期处理。
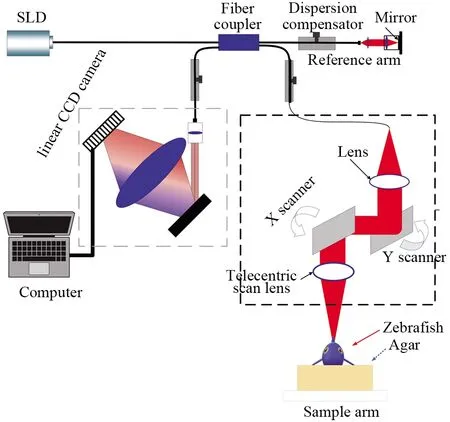
图1 光学相干层析成像系统示意图Fig.1 Schematic diagram of optical coherence tomography system
1.3 试剂配制
配制质量浓度为0.01 g/mL的琼脂溶液:称取1 g的琼脂粉(广州环凯微生物科技公司)加入到100 mL的蒸馏水中,充分搅拌混匀,加热至琼脂粉完全溶解,倒入玻璃培养皿中,冷却后形成琼脂块,用于固定被麻醉的斑马鱼。
配制质量浓度为0.01%的Tricaine溶液(麻醉剂):Tricaine(西格玛,A5040,美国)粉末以0.4%质量体积比溶于Holtfreter缓冲液中,即为25×储备液,麻醉过程使用1×(0.01%)的稀释溶液。
1.4 斑马鱼颅骨损伤再生模型的构建
在颅骨缺损造模方面,本研究采用的是一套自行研制的斑马鱼脑部立体定位仪。如图2a、2b所示,定位仪使用光学精密滑台作为运动框架,斑马鱼的夹持和电动钻机的固定部分均使用3D打印方法进行制造。电动钻机端可在YZ轴运动,夹鱼台端可在XR轴作旋转运动,构成4轴的斑马鱼脑部定位仪。直流电机和精密钻夹装配使钻头的运动具有很高的同心度。钻头如图2c、2d所示,直径为200 μm,材质为钨钢,保证了其锋利程度和硬度,且不会随着使用时间增加而降低。
颅骨损伤斑马鱼操作如下:首先,将斑马鱼用质量浓度为0.01%的Tricaine溶液麻醉,再把斑马鱼脑部固定在定位仪上,然后,用同一钻头、相同转速(2 000 r/min)对斑马鱼颅骨进行开孔操作。基于精确的立体定位装置,颅骨创伤位置能保持较好的一致性。
1.5 颅骨缺损斑马鱼模型的自然恢复
开孔造模成功后,自然恢复组斑马鱼置于常规饲养水环境中,水更换周期约为2 d。试验期间,给予斑马鱼适宜的进食量,保持自然恢复组所有鱼的进食量一致,以排除进食量差异影响颅骨损伤再生速度。
1.6 OCT活体成像斑马鱼颅骨
首先,将已麻醉的斑马鱼用琼脂块固定,然后,把斑马鱼放置于OCT系统下,对斑马鱼颅骨损伤前后进行OCT活体成像。按试验设计方案对骨缺损的斑马鱼颅骨再生情况进行活体监测,从而获得颅骨修复情况的实时数据。

图2 斑马鱼脑部立体定位仪Fig.2 Zebrafish stereotactic apparatus(a)装置俯视图;(b)装置侧视图;(c)钻头照片;(d)钻头直径(a)Vertical view of the equipment;(b)Lateral view of the equipment;(c)Photograph of drill;(d)Diameter of the drill
1.7 病理切片试验
用冰浴法处死斑马鱼后将其放入Bouin氏液中固定,样品固定24 h后再置于流水中冲洗24 h。随后,将经过流水冲洗处理的斑马鱼样品按照标准操作包埋成蜡块,将包埋好的蜡块固定于旋转切片机(Leica,RM 2245,德国)上,切成薄片,厚度为4 μm。染色前将切片放入60 ℃恒温箱中烤2 h,再用H&E染色标准操作处理切片。最后,利用数字病理玻片扫描仪(Leica,CS2,德国)对染色后的病理切片进行图像采集。
1.8 测量和统计方法
本研究中颅骨缺损的直径是使用专业软件MATLAB 6.0在OCT图像上测量获取,进一步使用专业软件Originpro-8对数据进行统计分析,每一个成像时间点处骨缺损直径的数据都被用于分析斑马鱼颅骨恢复再生趋势。
2 结果与分析
2.1 颅骨缺损模型建立过程中斑马鱼行为学表现
钻孔试验完成后,立即将钻孔导致的颅骨缺损斑马鱼转移到水中,所有斑马鱼模型都在造模后30 s内自行苏醒,然后转移到各自的饲养器中。基于正常斑马鱼的OCT结果和精密的斑马鱼脑定位仪,本研究可以保证钻孔操作不伤及脑组织。因此,颅骨缺损造模后的斑马鱼都没有死亡,与正常组相比,颅骨损伤的斑马鱼游动无异常、活力无下降。
2.2 斑马鱼颅骨缺损前后的OCT活体成像结果及病理试验结果
正常斑马鱼颅骨的OCT图像如图3a所示,该图为头部的冠状面截图。图上可以清晰地看到绿色的虚线箭头标记的连续带状结构,即为斑马鱼颅骨位置。由于骨质的高光散射特性,因此表现为较高的信号强度。覆盖颅骨的是一层较软的皮质,与哺乳动物相似,斑马鱼的皮质随着年龄的增大会显著增厚。基于OCT图像结果可知,3月龄斑马鱼皮质厚度约为300 μm,颅骨厚度约为100 μm,这两个数据为颅骨损伤试验提供了指导。图3b为对应区域的病理切片结果,可见颅骨的厚度与OCT图像结果吻合得较好。由于制作病理切片过程中的脱水不可避免地会导致部分软组织萎缩,导致病理结果中皮质的厚度小于OCT图像中的厚度。图3c为斑马鱼颅骨损伤后的OCT活体成像,这个结果清晰地显示了损伤的位置,见绿色椭圆形虚线标记。进一步观察可发现,由于钻头的贯穿动作,皮质和颅骨产生了分离间隙,有低密度的液体状物质填充。图3d为对应位置的病理切片,损伤的位置、大小都与OCT结果吻合,同时还显示损伤区域有外溢血液填充,见蓝色矩形虚线标记的区域。
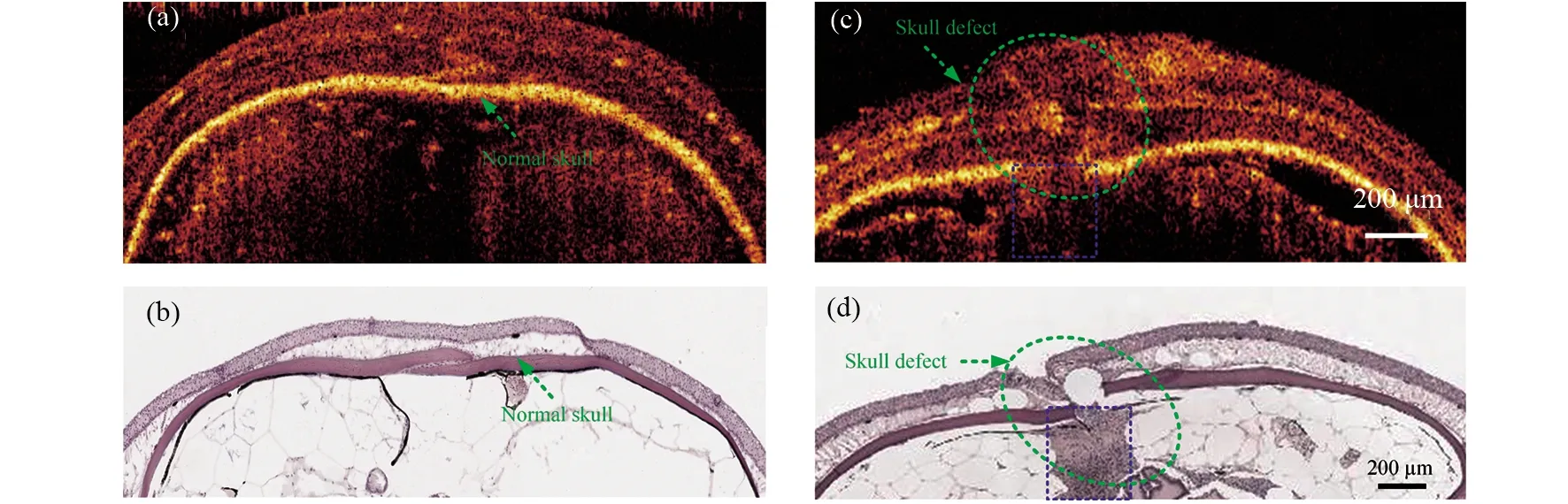
图3 斑马鱼颅骨损伤前后的OCT图像与对应的病理切片Fig.3 OCT images of zebrafish skulls before and after injury as well as corresponding histological results(a)颅骨损伤前OCT图;(b)颅骨损伤前病理结果;(c)颅骨损伤后OCT图;(d)颅骨损伤后病理结果。绿色虚线箭头表示颅骨,绿色虚线圆圈表示颅骨缺损位置,蓝色的虚线矩形标记了开孔之后导致的血液渗漏(a)OCT image of normal skull;(b)Histological result of normal skull;(c)OCT image of injured skull;(d)Histological result of injured skull. The green dotted arrow indicates the skull, the green dotted circle shows that the location of the skull defect, and the blue dotted rectangle marks the blood leakage caused by the opening
2.3 OCT活体连续监测斑马鱼颅骨损伤后自然恢复过程
基于OCT技术无损伤、分辨率高和成像深度大的优点,我们进一步开展了斑马鱼颅骨损伤后再生过程的活体监控和评估性研究。OCT系统可以实时动态地观察到,模型组斑马鱼颅骨从两端相距甚远逐渐恢复到几近愈合状态,斑马鱼颅骨损伤后自然恢复过程的代表性OCT结果如图4所示。图4a显示的是颅骨缺损的初始阶段,绿色虚线标注的是颅骨缺损的位置,经测量缺损直径均约为218 μm,蓝色箭头标注的是开孔之后导致的血液渗漏。从图4b中发现,经过2 d的恢复,颅骨的皮质层已经有明显的恢复,然而颅骨处的外溢血仍然存在,颅骨缺损的直径约为233 μm,有变大的趋势。接下来的第5、9和11 天的OCT结果显示,皮质已经完全恢复,颅骨的缺损也显著减小,外溢血的图像强度在图4c所示的第5天达到了最大值,但随后面积逐渐减小。到损伤后的14 d时,如图4f所示,颅骨缺损基本恢复,剩余缺口直径约为103 μm,外溢血完全消失,皮质完全恢复。

图4 OCT活体监控斑马鱼颅骨损伤后的自然恢复过程Fig.4 OCT in vivo monitoring the natural recovery process of zebrafish skull after injury(a)颅骨损伤时;(b)损伤后2 d;(c)损伤后5 d;(d)损伤后9 d;(e)损伤后11 d;(f)损伤后14 d。绿色虚线标注的是颅骨缺损的位置,蓝色箭头标注的是开孔之后导致的血液渗漏(a)0 day;(b)2 days after injury;(c)5 days after injury;(d)9 days after injury;(e)11 days after injury;(f)14 days after injury. The green dotted line indicates the location of the skull defect, and the blue arrow shows the blood leakage caused by the opening
2.4 颅骨缺损自然修复21 d后的活体OCT和病理切片染色评估
颅骨损伤后修复是成骨细胞扩增和新骨架形成的过程,然而,现有成像技术由于存在分辨率低或成像深度不足等问题,难以实现这一过程的活体可视化。我们进一步对21 d自然恢复的颅骨缺损斑马鱼进行了活体OCT,成像结果如图5所示。图5a展示了大尺度的斑马鱼头部OCT结果,可以发现骨缺损的直径进一步减小,约为63 μm。图5b对应的是病理切片结果,与OCT结果吻合较好。我们进一步把OCT图像和病理图像中的损失修复区域放大,如图5c、5d所示。可以清晰地发现,在骨损伤修复区域的边界上有显著的桥连状结构,图中用蓝色箭头标注,病理切片的结果显而易见也存在这种结构。这一结果较好地反映了斑马鱼作为骨缺损模型的可行性以及OCT评估斑马鱼颅骨缺损模型的准确性。
2.5 定量分析斑马鱼颅骨缺损自然恢复效果
定量的数据更加有助于评价疾病模型和药物疗效,因此,我们从自然恢复组的每一个时间点的OCT图像中将颅骨缺损直径进行了测量,然后作图分析,结果如图6所示。自然恢复的颅骨缺损会在开始2 d的时候有变大的趋势,随后就逐渐变小。可以观察到,斑马鱼在21 d内就已经能够修复再生长度约为115 μm的骨组织。因此,我们根据数据分析,可以推测出斑马鱼的修复速率呈抛物线改变,颅骨损伤修复速率由慢到快后变慢,且机械性损伤后2周左右为修复期的巅峰。
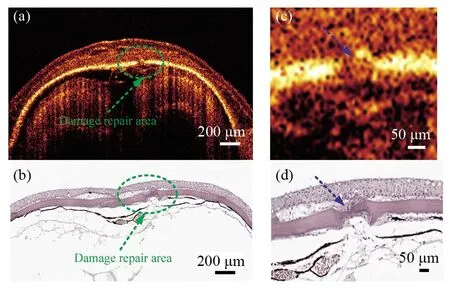
图5 颅骨损伤斑马鱼修复21 d后的OCT图与其病理切片图Fig.5 OCT and pathological results of the injured skull of zebrafish after 21 days(a)斑马鱼头部OCT图像;(b)斑马鱼头部病理切片图;(c)放大的损伤区域OCT图像;(d)放大的损伤区域病理切片图。绿色虚线圆圈表示损伤修复区域的位置,蓝色箭头表示放大后损伤修复的位置(a)OCT image of zebrafish head;(b)Histological image of zebrafish head;(c)Enlarged OCT image of the defect lesion;(d)Enlarged histological image of the defect lesion. The green dotted circle indicates the location of the damage repair area, and the blue arrow shows the location of damage repair after magnification
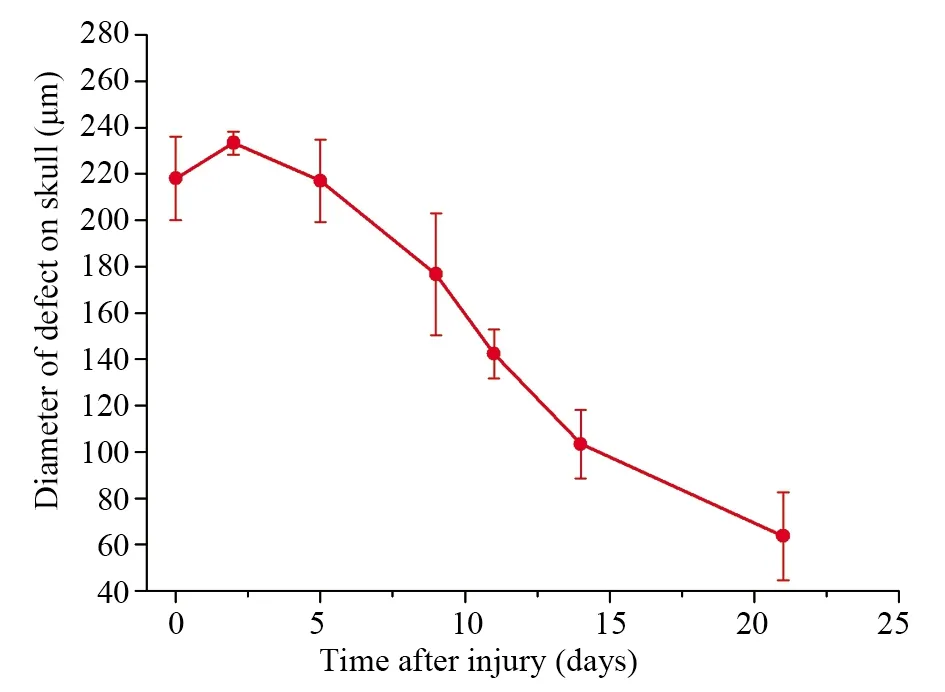
图6 定量分析斑马鱼颅骨损伤修复过程Fig.6 Quantitative analysis of the repair process of skull injury in zebrafish
3 讨论
斑马鱼与多数高等脊椎动物一样,也存在软骨内骨化和膜内骨化2种骨化方式[25]。其中,斑马鱼大部分的头部骨骼是由软骨内骨化发育产生的,且骨缺损愈合也是通过此方式[26]。斑马鱼骨骼发育过程和调控机制与哺乳动物一样高度保守,所以基于斑马鱼骨骼模型的研究对于人类疾病的探讨和研究具有重大价值与意义。目前,各个学科已成功构建了各自需要的斑马鱼骨骼疾病模型,特别是在骨骼再生能力方面的研究上。再生医学是当今科学研究的前沿和热点,在世界范围内的发展日新月异,已成为最具转化前景的研究领域之一,并极大地促进了其它相关领域共同迈进。为了应对我国骨骼疾病诊治的巨大需求,我们利用斑马鱼作为骨骼再生模型积极地开展骨骼再生的研究。目前,研究斑马鱼骨骼模型的方法有经典的骨骼染色和医学上的影像学检测等手段。但现存的方法都存在自身的局限性,染色法极其繁琐,耗时耗力。其他影像技术有些存在辐射损伤,有些只能对幼鱼进行成像,存在成鱼成像受限等问题。
本研究利用OCT相干成像技术对斑马鱼颅骨损伤模型的再生过程进行活体监测。由于光学特征是生物组织的重要物理参数,而OCT以无创的高分辨率揭示生物组织的光散射特征,具有无损和无标记的优点。本课题组的前期研究证实了OCT相干成像技术能够有效地穿透成年斑马鱼的颅骨,对完整的大脑进行三维成像[27]。为了获得斑马鱼颅骨的高分辨率图像,本研究采用了基于840 nm的近红外光的OCT系统进行试验,并结合病理切片H&E染色结果,最后获得的OCT结果与病理结果完全吻合。由此可证实,OCT技术在骨骼方面的监测完全具有可靠性。然而在成年斑马鱼的颅骨损伤再生过程的监测中,我们发现斑马鱼颅骨修复在早期不明显,甚至存在损伤区增大的现象,大概于2周左右出现明显修复,后期再次出现修复缓慢的现象。这种现象的发生是否与骨细胞的死亡及巨噬细胞的吞噬有关尚未清楚,在细胞生物学上具有一定的研究价值。而OCT技术的实时性、安全性和可靠性也决定了其在骨骼研究方面具有广阔的应用前景,特别是在重大恶性疾病的演化过程研究方面具有明显的研究优势。
本论文介绍了一种基于自行研制的斑马鱼脑立体定位系统构建成年斑马鱼颅骨损伤模型的方法以及一种基于OCT技术从活体水平动态观测斑马鱼骨损伤再生的策略。结果表明,斑马鱼的颅骨损伤后可以在较短的时间内再生,建模方式简单,模型成功率高。且OCT技术能够精准地活体评估骨骼再生过程,获得的OCT图像质量可以与病理结果相媲美。综上所述,本论文开发的模型和OCT评估策略有较好的参考价值,有潜力推进骨疾病相关研究取得更大进展。
