人巨细胞病毒gH蛋白表达及其单克隆抗体的制备
2020-07-09廖旻晶刘如石钟志宏王庆林
刘 乐,廖旻晶,徐 叶,刘如石,钟志宏*,王庆林*
(1.湖南省免疫诊断试剂工程研究中心, 长沙410006; 2.湖南师范大学医学院, 长沙410006)
人巨细胞病毒(human cytomegalovirus,HCMV)是人群中普遍存在的疱疹病毒家族5型的成员,属于β疱疹病毒亚科。HCMV成熟病毒颗粒的大小为150~200 nm,核心为双链线形DNA,外包呈二十面体对称的衣壳,核衣壳外有一层被膜,病毒的最外层是含有病毒编码的多种糖蛋白的脂质包膜。HCMV具有种属特异性,主要在人与人之间传播,可通过唾液、尿液、母乳喂养、胎盘、性交、血液和器官移植等多种方式进行传播。临床上,免疫系统功能正常的人群感染HCMV后通常是无症状的,然而在免疫缺陷个体中则表现为严重的系统性疾病[1]。此外,HCMV是引起胎儿先天性畸形最常见的感染原因[2,3],也是造血干细胞和实体器官移植受者感染和死亡的主要原因[4]。
目前没有较好的治疗HCMV感染的方法,其主要治疗药物为更昔洛韦和缬更昔洛韦,但这些药物有严重的副作用。基于社会和经济负担以及缺乏有效治疗方案,HCMV已被指定为最优先的疫苗目标之一[5]。早期开发的减毒活疫苗如AD169和Towne,虽然可以诱导短暂的中和抗体应答,但不能彻底清除体内病毒,阻断病毒对上皮细胞的感染。近几十年来,HCMV亚单位疫苗研究主要集中在刺激机体产生中和抗体(neutralizing antibody,NAb)所必需的包膜糖蛋白gB(glycoprotein B)上。与佐剂MF59混合的重组gB疫苗预防育龄妇女HCMV原发感染的有效率为38%~50%,但无法预防青少年的HCMV原发性感染[6,7]。HCMV gH(glycoprotein H)也是HCMV必需的包膜糖蛋白[8],并能诱导针对病毒的中和抗体,是HCMV亚单位疫苗的候选抗原[9],但目前针对gH中和抗体的研究甚少。
gH由HCMVUL75基因编码,基因全长为2 232 bp,编码742个氨基酸。gH与gB、gL(glycoprotein L)构成了HCMV的核心融合机制,在HCMV融合、进入和感染宿主细胞过程中发挥关键作用[10,11],是诱导机体产生免疫应答的主要靶点[12]。有研究表明,gH是人巨细胞病毒主要的中和抗原[13,14],机体产生的抗gH抗体可中和进入上皮细胞和成纤维细胞的特异性毒株[15],有效干扰HCMV对上述细胞的感染[8,16,17]。因此,本研究拟通过重组表达及杂交瘤技术,获得重组gH蛋白及抗gH蛋白的单克隆抗体,以期为HCMV疫苗开发奠定基础。
1 材料与方法
1.1 质粒和菌株、试验动物和主要试剂
本试验所用原核表达质粒为pET32a′,经pET32a改造而来,即去除后者Trx标签及部分酶切位点,具体去除部位为碱基的203~689位;原核表达质粒pET32a、TransB菌株、TOP10F′菌株及HCMV Toledo由本实验室保存;BALB/c雄鼠购自湖南斯莱克景达实验动物有限公司;GAM-IgG-HRP由厦门大学夏宁邵教授惠赠;限制性内切酶EcoR I、XhoI以及DNA相对分子质量标准购自TaKaRat公司;抗6×His-tag单克隆抗体、质粒小提试剂盒、琼脂糖凝胶DNA回收试剂盒、BCA(bicinchoninic acid)蛋白定量试剂盒购自上海生工公司;HCMV阳性血清由湖南省人民医院检验科惠赠;HT、HAT以及弗氏完全佐剂与弗氏不完全佐剂购自Sigma公司;1640培养基、DMEM/F-12培养基购自GIBCO公司;胎牛血清(fetal bovine serum,FBS)购自上海依科赛生物科技有限公司;ECL(eletrochemiluminescence)显色液购自莫纳生物科技有限公司。
1.2 HCMV gH基因扩增
以含HCMV Toledo全基因组的BAC(bacterial artificial chromosome)为模板,扩增去除信号肽和跨膜区序列的gH基因片段,设计的上游引物: 5′-CCGGAATTCTCCGAAGCGCTGGACCCTC-3′;下游引物:5′-GGGCTCGAGACGACTGTCGGTGGCGTCC-3′(波浪线标注的分别为EcoR I和XhoI的酶切位点,下划线标注的分别为酶切位点的保护碱基)。引物由长沙擎科生物科技有限公司合成。PCR反应程序为:95 ℃ 3 min;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 3 min,共28个循环。目的片段经1%的琼脂糖凝胶电泳分析并回收。
1.3 重组质粒的构建与鉴定
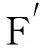
1.4 HCMV gH蛋白的表达与纯化
将鉴定后的质粒转化至大肠杆菌TransB表达菌株,挑单菌落于3 mL液体培养基中培养,待菌液OD600 nm值至0.6~0.8时,加入质量浓度为200 mg/L的异丙基-β-D-硫代半苷 (isopropyl-β-D-thiogalactopryanoside,IPTG)诱导重组蛋白的表达,离心收集诱导前后的菌体并用超声波破碎,制备诱导前后菌株的蛋白样进行10%的十二烷基磺酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfonate polyacrylamide gel electrophoresis,SDS-PAGE)和免疫印迹(western blot,WB)鉴定。用同种方法大量诱导表达重组蛋白,离心收菌并用超声波破碎,将诱导后的菌液、超声后悬液以及悬液离心后上清、沉淀分别制样,经10%的SDS-PAGE及WB鉴定重组蛋白的表达方式,WB所用一抗为抗6×His-tag单抗。
用含2%TritonX-100的Buffer I溶液和Buffer I溶液分别洗涤沉淀,然后用4 mol/L尿素溶液变性蛋白,12 000 r/min离心10 min,弃上清,沉淀用磷酸盐缓冲液(phosphate buffered saline,PBS)重悬、制样。蛋白样经10%SDS-PAGE后,切取gH蛋白对应的目的条带于透析袋内,并在加有Tris-甘氨酸缓冲液的水平电泳槽进行电泳,条件为电压100 V、2 h。电洗脱后,去掉透析袋中的凝胶,并加入二硫苏糖醇(dithiothreitol,DTT)至终浓度50.00 mmol/L,将透析袋放在含DTT的PBS中,透析液中DDT浓度依次为50.00、25.00、12.50和6.25 mmol/L,最后将透析液全部换成PBS,4 ℃各搅拌透析2 h。透析结束后,回收透析袋中蛋白溶液并制样,经SDS-PAGE和WB鉴定重组蛋白。WB所用一抗分别为抗6×His-tag单抗、HCMV阳性血清。
1.5 小鼠免疫
将纯化后的蛋白与弗氏完全佐剂等体积混合并充分乳化后,皮下多点免疫8周龄的BALB/c雄鼠,剂量为150 μg/只。2周后,纯化蛋白与弗氏不完全佐剂充分乳化,然后以同样的剂量和方法对小鼠进行3次加强免疫,每次间隔2周。在细胞融合前3 d,对小鼠进行腹腔加强免疫,剂量为150 μg/只。每次免疫前1 d对小鼠进行眼眶静脉丛取血,通过间接酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测血清效价。
1.6 细胞融合
终免3 d后取免疫小鼠的脾脏,收集脾细胞,按1∶10的比例与生长状态良好的骨髓瘤细胞sp2/0进行混合,在37 ℃预热的聚乙二醇(polyethylene glycol,PEG)1500作用下进行细胞融合,并用无血清1640培养基终止融合。用含HAT的20%FBS-1640培养基悬浮细胞,然后均匀铺于96孔板中,放于37 ℃、5%CO2的培养箱中培养。
1.7 杂交瘤细胞的筛选
融合后的细胞在培养第7天用含10%FBS的HT-1640培养基换液,待细胞集落长至孔底面积的1/3~1/2时,取培养液上清作为一抗,用间接ELISA方法进行检测。选取OD450 nm值较高且细胞集落数目少的孔,通过有限稀释法进行克隆化。通过4次亚克隆,以保证重筛选的细胞为可稳定分泌gH抗体的杂交瘤细胞。
1.8 单克隆抗体的制备、纯化和鉴定
取9周龄的雄性BALB/c小鼠,按每只500 μL的剂量腹腔注射石蜡油。9 d后用PBS将杂交瘤细胞数调整为2×106个/mL,按每只500 μL的剂量腹腔注射小鼠。10 d后,收集腹水,通过辛酸-饱和硫酸铵沉淀和Protein A柱对腹水进行纯化,将纯化前后的腹水进行12%SDS-PAGE鉴定。
1.9 单克隆抗体的性质鉴定
1.9.1 亚型检测
使用间接ELISA法对单克隆抗体进行亚型鉴定。取筛选的每株杂交瘤细胞培养液作为一抗,分别以抗 IgG1、IgG2a、IgG2b、IgG3、IgM、IgGAM的抗体作为二抗,其中IgGAM作为阳性对照。另设阴性对照,以配制的细胞培养基作为一抗,IgGAM作为二抗。
1.9.2 抗体效价
将纯化的单克隆抗体作为一抗,使用间接ELISA法测定。检测效价时,将5种抗体的质量浓度均稀释为0.59 g/L,然后从1∶800进行2倍比稀释,直至最终稀释比为 1∶204 800。
1.9.3 反应性检测
将纯化后的重组gH蛋白作为抗原,分别以筛选并纯化后的单克隆抗体作为一抗,同时以抗6×His-tag单抗作为阳性对照,通过WB检测5种单抗对重组gH蛋白的反应性。
1.9.4 人巨细胞病毒的培养及单克隆抗体的免疫捕获PCR
用含10%FBS的DMEM/F-12培养液培养 ARPE-19(adult retinal pigment epithelial cell line-19)细胞,待细胞密度达到60%~80%时,向培养液中加入HCMV Toledo病毒液,感染量为1 000 PFU/皿,置于5%CO2、37 ℃的细胞培养箱中孵育,期间每隔15 min轻轻摇动培养皿。2 h后,将培养液换为含2%FBS的 DMEM/F-12 培养液,置于细胞培养箱中继续培养5~7 d。待细胞大部分发生病变后,用2 mL左右上清液将ARPE-19细胞充分悬浮,并收集于冻存管中。将冻存管反复冻融3次后,在4 ℃环境中10 416 r/min离心30 min,上清即为具有感染性的病毒液,留取上清备用。
单克隆抗体的免疫捕获试验分为抗体捕获病毒阴性对照(不包被抗体仅加病毒液),抗体试验组(包被抗体加病毒液)和抗体阴性对照(仅包被抗体不加病毒液)。具体操作如下:纯化单克隆抗体用PBS(pH 7.4)稀释至8 μg/mL,包被到0.5 mL离心管中,每个抗体包被两管,每管100 μL。同时以仅包被等量包被液的离心管作为抗体捕获病毒阴性对照,4 ℃过夜。1×PBS洗涤3次后,用200 μL ED封闭液于37 ℃封闭2 h,1×PBS 洗涤3次;每个抗体包被管中分别加入100 μL病毒液与正常细胞裂解液,作为抗体实验组与抗体阴性对照,仅包被包被液的离心管中加入等量病毒液,37 ℃ 孵育2 h;1×PBS洗涤6次。加入30 μL ddH2O,于PCR仪器上95 ℃热处理 15 min。之后,以水溶液为模板进行gH基因片段的PCR扩增试验,并用琼脂糖凝胶电泳分析结果。其中模板阴、阳性对照分别以ddH2O、重组质粒pET32a′-gH为模板,其余操作一样。PCR反应程序同步骤1.2。
2 结果与分析
2.1 重组质粒pET32a′-gH的构建
以含HCMV Toledo毒株全基因组的BAC为模板,PCR扩增不含信号肽和跨膜区序列的gH基因,理论上PCR产物为2 064 bp。将PCR产物进行琼脂糖凝胶电泳,发现阴性对照无条带,阳性样品在2 000 bp附近有一条较亮的条带,初步确定为gH基因片段(图1a)。纯化扩增的PCR产物,与pET32a′构建重组表达载体。构建成功的重组质粒经EcoR I和XhoI双酶切后,理论上会有2条片段,分别为2 064 bp的gH基因和5 414 bp的线性质粒pET32a′。将酶切前后的样进行琼脂糖凝胶电泳,结果发现,双酶切后有2条条带,分别位于5 000 bp和2 000 bp左右,与理论相符(图1b)。同时,提取重组质粒进行测序,插入片段的核苷酸序列与预期相符,提示该重组质粒可用于后续的蛋白表达。
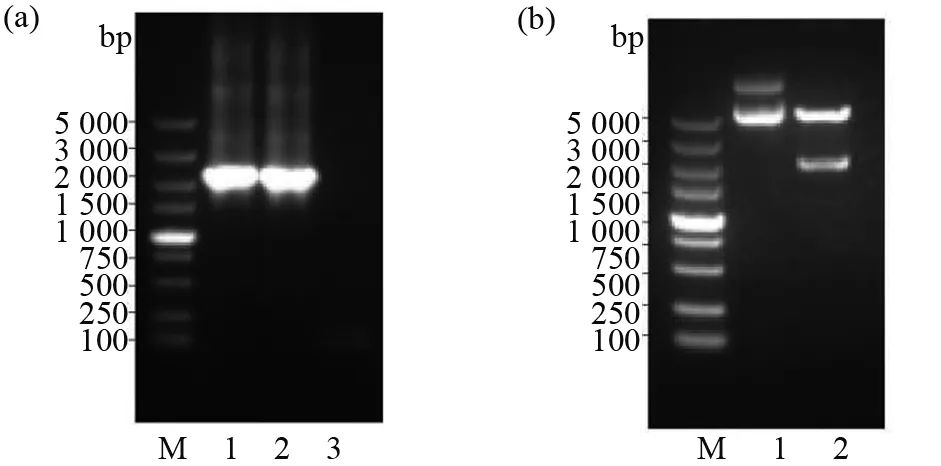
图1 重组表达质粒pET32a′-gH的构建Fig.1 Construction of recombinant expression plasmid pET32a′- gH(a)gH基因扩增产物的琼脂糖凝胶电泳结果。Lane M:DNA的相对分子质量标准;Lane 1、2:gH基因特异性扩增产物;Lane 3:以ddH2O为模板的阴性对照;(b)重组质粒pET32a′-gH的双酶切鉴定结果。Lane M:DNA的相对分子质量标准;Lane 1:构建成功的重组质粒;Lane 2:重组质粒经EcoR I/Xho I双酶切后产物(a)The results of agarose gel electrophoresis of amplified products of gH gene.Lane M:Relative molecular mass standard of DNA;Lane 1 and Lane 2:Specific amplification products of gH gene;Lane 3:Negative control with ddH2O as template;(b)Results of double enzyme digestion of recombinant plasmid pET32a′-gH. Lane M:The relative molecular mass standard of DNA;Lane 1:The successful construction of a recombinant plasmid;Lane 2:The pro-duct of the recombinant plasmid after digestion by EcoR I/Xho I
2.2 重组gH蛋白的表达及纯化
将构建成功的重组质粒转化TransB菌株,并用IPTG诱导蛋白表达。分别留取IPTG诱导前后的蛋白样,并通过SDS-PAGE、WB鉴定蛋白表达情况。SDS-PAGE结果显示,与诱导前相比,诱导后的重组菌株表达了一个约70 kD的蛋白(图2a)。为验证诱导表达蛋白是否为gH蛋白,我们以抗6×His-tag抗体作为一抗,使用WB对重组蛋白的表达情况进行鉴定,结果显示,经IPTG诱导的表达菌株在70 kD处出现了特异性条带,而对照菌株中没有出现(图2b),提示菌株所表达的70 kD蛋白处为含有6×His-tag的重组蛋白。超声波破碎后经IPTG诱导的重组表达菌株,SDS-PAGE结果显示,重组蛋白主要存在于沉淀中,说明该蛋白主要以包涵体的形式表达(图2a)。使用WB对重组蛋白的表达情况进行鉴定,与SDS-PAGE结果一致(图2b)。大量表达gH,收集沉淀,后者经洗涤、尿素变性后,用电洗脱方法进行纯化,收集纯化前后的蛋白样,并通过SDS-PAGE和WB鉴定gH纯化情况(图3)。结果显示:与纯化前相比,纯化后gH仅有1条较亮的条带,gH重组蛋白纯化率达90%以上,达到免疫小鼠制备单克隆抗体的要求。
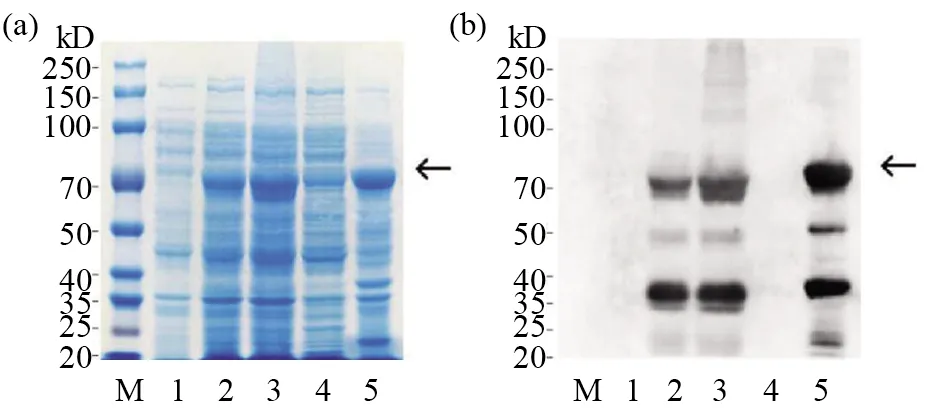
图2 重组gH蛋白的原核表达Fig.2 Eukaryotic expression of recombinant gH protein 通过SDS-PAGE(a)及WB(b)鉴定重组gH蛋白的表达情况。Lane M:预染蛋白质相对分子质量标准;Lane 1:未经IPTG诱导菌株;Lane 2:IPTG诱导后菌株;Lane 3:超声悬液;Lane 4:超声悬液离心后上清;Lane 5:超声悬液离心后沉淀Identification of the expression of recombinant gH protein by SDS-PAGE (a) and WB (b).Lane M:Relative molecular mass standard of predyed protein;Lane 1:Strains not induced by IPTG;Lane 2:Strains induced by IPTG;Lane 3:Ultrasonic suspension;Lane 4:Ultrasonic suspension supernatant after centrifugation;Lane 5:Ultrasonic suspension precipitation after centrifugation
图3 重组gH蛋白的纯化鉴定Fig.3 Identification of purified recombinant gH (a)SDS-PAGE 鉴定纯化后重组gH蛋白;(b)WB 鉴定纯化后重组gH蛋白(所用一抗为抗6×His-tag);(c)WB 鉴定重组gH蛋白表达方式 (所用一抗为HCMV阳性血清);Lane M:预染蛋白质相对分子质量标准;Lane 1:未经纯化的蛋白;Lane 2:经电洗脱纯化后的蛋白(a)The purified recombinant gH were identified by SDA-PAGE;(b)The purified recombinant gH were identified by WB,and the first antibody used was anti 6×His-tag;(c)The purified recombinant gH were identified by WB,and the first antibody used was HCMV positive serum.Lane M:Relative molecular mass standard of predyed protein;Lane 1:The unpurified protein;Lane 2:The protein purified by electroelution
2.3 抗gH单克隆抗体的制备及纯化
用纯化后的gH蛋白免疫小鼠,将小鼠免疫前的血清1∶4 000稀释后作为阴性对照,以大于2.1倍阴性值作为阳性。结果显示,经5次免疫后,小鼠血清抗体含量明显升高,效价可达1∶100 000(图4),达到制备单克隆抗体的要求。免疫后取小鼠脾细胞,经细胞融合、亚克隆化培养,筛选出5株能稳定分泌抗HCMV gH 单克隆抗体的杂交瘤细胞,分别命名为8A9、8B4、8C4、8D9、8D12。
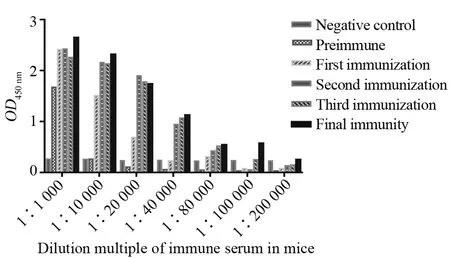
图4 免疫小鼠的血清效价检测Fig.4 The examination of serum titer in mice after immunization
将适量杂交瘤细胞注射入小鼠腹腔,7~15 d后收集小鼠腹水。使用辛酸-饱和硫酸铵沉淀和Protein A柱进行纯化,将纯化前后的抗体进行SDS-PAGE,结果显示,纯化后的抗体样品未经煮沸时出现3条带,分别为50 kD的重链、25 kD的轻链和大小约100 kD的条带。100 kD的条带为重链与重链的聚合体,由于两条重链间的二硫键没有完全破坏所形成(图5)。煮沸后的抗体样品主要有2条带,分别为50 kD的重链和25 kD的轻链,且与煮沸前相比,50 kD处条带变粗。凝胶电泳结果显示,样品中杂带很少,提示单克隆抗体达到很高纯度,可用于后续试验。

图5 纯化单克隆抗体的SDS-PAGE鉴定Fig.5 Identification of purified monoclonal antibodies by SDS-PAGELane M:预染蛋白质相对分子质量标准;Lane 1:经10倍稀释处理的未煮沸腹水样品;Lane2:经10倍稀释处理的煮沸腹水样品;Lane 3:未煮沸的辛酸硫酸铵沉淀处理后的腹水样品;Lane 4:煮沸的辛酸硫酸铵沉淀处理后的腹水样品;Lane 5:未煮沸的经protein A柱纯化处理的腹水样品;Lane 6:煮沸的经protein A柱纯化处理的腹水样品Lane M:Relative molecular mass standard of predyed protein;Lane 1:Unboiled ascites treated by 10 times dilution;Lane 2:Boiled ascites treated by 10 times dilution;Lane 3:Unboiled ascites treated by purification after precipitation of ammonium caproate sulfate;Lane 4:Boiled ascites treated by purification after precipitation of ammonium caproate sulfate;Lane 5:Unboiled ascites treated by purification after proteinA-column;Lane 6:Boiled ascites treated by purifi-cation after proteinA-column
2.4 单克隆抗体性质鉴定
2.4.1 亚型鉴定
将OD450 nm>1.0作为阳性结果,结果显示,除IgGAM外,5株抗体仅与IgG2a呈阳性反应,故8A9、8B4、8C4、8D9、8D12亚型均为IgG2a型(图6)。
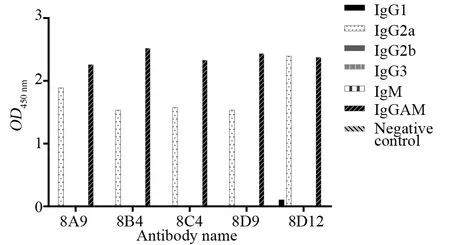
图6 五株单克隆抗体的亚型检测Fig.6 Examination of the subtype of 5 monoclonal antibodies
2.4.2 单克隆抗体的效价测定
以PBS作为阴性对照,以大于2.1倍阴性值作为阳性,结果显示,8A9的效价达1∶51 200,8B4的效价达1∶6 400,8C4的效价达1∶102 400,8D9的效价达1∶102 400,8D12的效价达1∶6 400。试验结果提示,这5株单克隆抗体的活性为8C4=8D9>8A9>8B4=8D12(图7)。
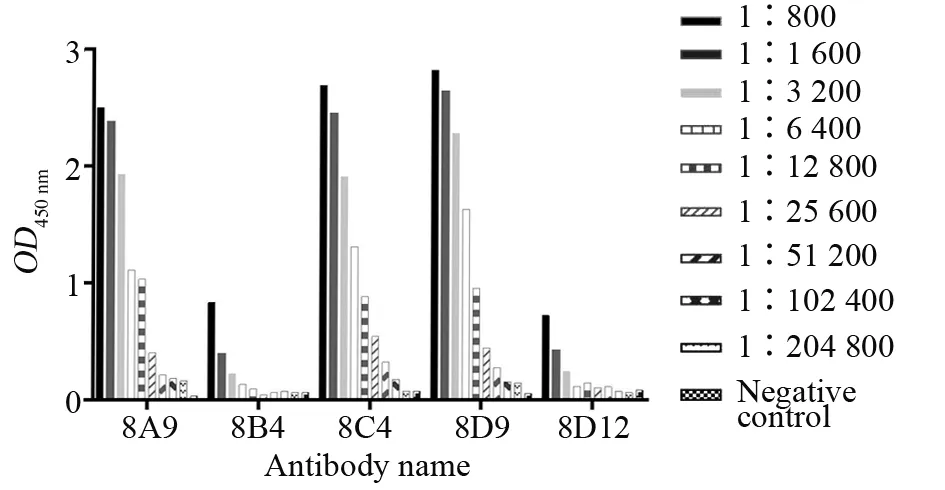
图7 五株单克隆抗体的效价检测Fig.7 Titer test of 5 monoclonal antibodies
2.4.3 单克隆抗体的免疫反应性检测
分别以单抗8A9、8B4、8C4、8D9、8D12和抗6×His-tag为一抗,利用WB鉴定单克隆抗体对重组gH蛋白的免疫反应性(图8),结果显示,5种单克隆抗体与纯化的重组gH蛋白反应后均在目标位置出现一条明显的条带,提示这5种单克隆抗体能特异性识别重组gH蛋白。

图8 五株单克隆抗体对gH蛋白的免疫反应性检测Fig.8 The immunoreactivity of monoclonal antibodies with gH protein(a)重组gH蛋白的SDS-PAGE结果;(b)单克隆抗体对重组gH蛋白的WB结果;Lane M:预染蛋白质相对分子质量标准;Lane 1:纯化的gH蛋白;(1)~(6)对应一抗分别为8A9、8B4、8C4、8D9、8D12和抗6×His-tag(a)Result of recombinant gH protein by SDA-PAGE;(b) Immunoreactivity of monoclonal antibodies with gH protein by WB detection;Lane M:Relative molecular mass standard of predyed protein;Lane 1:Purified gH protein;(1)~(6) Corresponding antibodies are 8A9,8B4,8C4,8D9,8D12,and 6×His-tag,respectively
2.4.4 单克隆抗体的免疫捕获PCR
用免疫捕获PCR 检测抗gH单克隆抗体捕获HCMV的能力。当抗体可以捕获病毒时,二者可特异性结合,不能结合的病毒则被PBS洗掉。抗体-病毒结合物在95 ℃可释放病毒于水溶液中,以水溶液作为模板,利用gH特异性引物进行PCR反应。其中模板阴性对照、抗体捕获病毒试验阴性对照与8C4试验组、阴性对照均无条带;模板阳性对照,8A9、8B4、8D9、8D12抗体试验组在2 000 bp附近有一条特异的条带,条带大小与理论一致。说明抗体8A9、8B4、8D9、8D12均可以捕获HCMV,且8D9和8D12的捕获能力较强,8C4不可以捕获病毒(图9)。

图9 五株单克隆抗体的病毒捕获能力检测Fig.9 Detection of virus capture ability of monoclonal antibodiesLane M:DNA的相对分子质量标准;Lane 1:模板阴性对照;lane 2:抗体捕获病毒试验阴性对照;Lane 3:模板阳性对照;Lane 4:8A9试验组;Lane 5:8A9阴性对照;Lane 6:8B4试验组;Lane 7:8B4阴性对照;Lane 8:8C4试验组;Lane 9:8C4阴性对照;Lane 10:8D9试验组;Lane 11:8D9阴性对照;Lane 12:8D12试验组;Lane 13:8D12阴性对照Lane M:Relative molecular mass standard of DNA;Lane 1:Template negative control;Lane 2:Negative control of antibody capture virus test;Lane 3:Template positive control;Lane 4:Test group sample of 8A9;Lane 5:Negative control of 8A9;Lane 6:Test group sample of 8B4;Lane 7:Negative control of 8B4;Lane 8:Test group sample of 8C4;Lane 9:Negative control of 8C4;Lane 10:Test group sample of 8D9;Lane 11:Negative control of 8D9 ;Lane 12:Test group sample of 8D12;Lane 13:Negative control of 8D12
3 讨论
本试验利用HCMV临床株Toledo作为gH基因扩增模板及后续的免疫捕获试验。Toledo是从一名先天性感染HCMV的儿童中分离出来的低传代毒株,用于人类巨细胞病毒感染研究[18]。与HCMV实验室标准病毒株AD169相比,Toledo毒株基因组DNA具有一段长达15 kb左右的基因区域(UL133-UL151),可能与HCMV介导的免疫致病机制有关[19]。有研究表明,试验株如AD169、Towne在试验过程中已经失去了感染上皮细胞和内皮细胞的能力[20],而临床株可以弥补这个缺陷[21]。故Toledo在HCMV培养及与抗体研究方面具有一定的优越性。
本研究中gH全基因在大肠杆菌表达系统中无法表达,而去除了信号肽和跨膜区序列的gH基因片段可成功表达。说明信号肽和跨膜区基因序列对蛋白在大肠杆菌中的表达有一定的影响,这与金映红等研究者的观点一致[22-25]。此外,诱导温度和诱导时间可影响蛋白的表达量及表达方式[26]。本试验在16、25、30、37 ℃分别诱导表达15、9、10、4 h,发现该gH蛋白在25 ℃、诱导表达9 h后,蛋白的表达量最高,故在该条件下进行gH蛋白的表达。表达的gH蛋白均以包涵体的形式存在,且不溶于尿素,故本试验利用电洗脱方式进行纯化[27]。电洗脱纯化蛋白方法简单、纯化效率高,蛋白纯度可达90%以上,可用于BALB/c小鼠免疫。本试验每次免疫小鼠的蛋白量为150 μg/只,该免疫量可刺激BALB/c小鼠持续产生免疫应答,且不会产生免疫耐受。在进行5次免疫后,小鼠血清效价达1∶100 000以上,说明gH蛋白具有较好的免疫原性。免疫后的小鼠可用于后期的细胞融合。细胞融合后,为筛选得到可稳定分泌的、专一的抗gH抗体的杂交瘤细胞,进行了4次亚克隆试验,最终筛选出5株杂交瘤细胞,将其分别命名为8A9、8B4、8C4、8D9和8D12。
利用WB及间接ELISA等试验鉴定发现,5株抗体均具有良好的免疫反应性,其中8A9、8C4和8D9具有较高的效价和亲和力。通过捕获试验发现,8A9、8B4、8D9、8D12可捕获HCMV Toledo,说明这4种抗体与HCMV Toledo有较好的亲和力,为后续检测抗体的中和能力奠定了基础,同时也说明这4种抗体具有应用于HCMV诊断的潜力。鉴于8D9、8D12捕获能力较强,后续将利用病毒中和试验和阻断试验,检测这2种抗体能否中和病毒、阻断HCMV在细胞间传播,从而进一步完善抗体的性质,以便为中和抗体的筛选提供原材料。
