复合微生物菌剂在长毛对虾标苗养殖过程中的应用研究
2020-07-09谢芝玲徐佳莹杨焕胜印遇龙夏立秋张友明
谢芝玲,徐佳莹,潘 登,刘 峰,陈 燕,杨焕胜,印遇龙,4,夏立秋,张友明,,涂 强*
(1.湖南师范大学生命科学学院, 微生物分子生物学湖南省重点实验室, 淡水鱼类发育生物学国家重点实验室, 长沙 410081; 2.亥姆霍兹抗感染国际实验室, 山东大学亥姆霍兹生物技术研究所, 微生物技术国家重点实验室, 青岛 266237; 3.山东亿安生物工程有限公司, 济南 250100; 4.中国科学院亚热带农业生态研究所, 畜禽养殖污染控制与资源化技术国家工程实验室, 亚热带地区农业生态过程重点实验室, 湖南省健康畜禽工程研究中心, 农业部中南部动物营养与饲料科学科学观测站, 长沙 410125)
水产养殖是农副业生产的重要组成部分[1,2],其大多采用高密度养殖的方式实施。在水产养殖的过程中,饲料残渣、水生动物的排泄物以及动植物尸体会不断地在养殖水体中堆积,在缺氧的条件下,经淤泥中的微生物发酵分解产生氨氮、硫化物、有机酸和亚硝酸盐等多种有害物质,引起水体严重污染[3,4]。同时,污染的水体环境使得原有的生态系统平衡被打破[5],水体中的浮游植物以及水生植物无法正常生长,给各种有害病源微生物的繁殖和传播创造了有利条件,导致水生产品的患病率增高,严重影响水产养殖业的经济效益和健康发展。
以往经常使用各类化学药物以及抗生素来抑制病原微生物的生长繁殖[6]。然而,抗生素的大量使用容易引起内源性感染、耐药性菌株的产生、水产品免疫力低下和水产品以及水体环境中抗生素残留[7]等问题,危及食品卫生安全甚至人类健康。目前,许多国家和地区都已经明令禁止在饲喂端使用促生长类的抗生素,所以急需要一种绿色健康的技术来推动水产养殖业的可持续发展。
针对近年来对虾养殖低产、病多的难题,有效的微生物菌剂在这样的市场需求下应运而生[8]。大量试验证明,微生物菌剂是抗生素的最佳替代品之一,其具有安全可靠、无毒害作用和不污染环境[9-11]等优点。为此,本研究以长毛对虾(Penaeuspenicillatus)为研究对象,监测并比较了添加复合微生物菌剂后,对虾的生长情况和养殖环境中相关指标的变化情况,以探讨微生物制剂对于对虾养殖及养殖水体改良的影响情况及使用方法。
1 材料与方法
1.1 试验材料
长毛对虾购自厦门水产学院海水育苗场,复合微生物菌剂由山东亿安生物工程有限公司提供,原料为复合微生物菌粉25%、低聚异麦芽糖4.85%、菜籽饼粉70%、食用香精0.15%,活菌数为1010CFU/g。其中复合微生物菌粉为酵母菌[产朊假丝酵母(Candidautilis)、酿酒酵母 (Saccharomycescerevisiae)],乳酸菌[嗜酸乳杆菌(Lactobacillusacidophilus)、德氏乳酸杆菌(Lactobacillusdelbrueckii)],芽孢杆菌(Bacillussubtilis)和光合菌(photosynthetic bacteria)的组合,其质量比为1∶1∶1∶0.5。基础饲料原料为低聚异麦芽糖6.22%,菜籽粉饼93.33%,食用香精0.2%。
试验设备主要有电子磅秤AWH(上海英展公司)、分析天平型号FA1004N(上海精密仪器仪表有限公司)、分光光度计型号721G(上海仪电分析仪器有限公司)、pH计PHS-3C(上海仪电分析仪器有限公司)和水质检测仪XZ-0178(青岛明博环保科技有限公司)。
1.2 试验设计与方法
试验为单因子试验,试验场地位于山东省淡水水产研究所。将平均体长为0.5 cm的396尾对虾随机分成4个组,分别为对照组组1,试验组组2、组3和组4,每个组设定3个平行,每个平行33尾,分别养殖于1.2 m×1.0 m×0.6 m的室内水泥池,进行为期33 d的饲养(2018年5月23日至2018年6月24日)。对照组组1投喂无复合微生物菌剂的基础饲料;组2、组3和组4为试验组,投喂有微生物菌剂添加的饲料,微生物菌剂分别占饲料质量的1.0%、1.5%和2.0%。每天投饵2次,分别在上午7∶00和下午18∶00。
在投放虾苗前15 d,每亩虾池用25 kg经过0.5%的亿安奇乐发酵的复合菌液水均匀喷洒虾池,净化养殖环境,为不同组的对虾提供相同的初始养殖环境。
1.3 样品采集
在测量日的当天7∶30至8∶00,在距离虾池岸0.6 m、水深0~10 cm处的4个采样点用采泥器取样,样品装进高温高压灭菌后的塑料管内密封冷冻保存。在测量日的当天7∶30至8∶00,用采水器在距离虾池岸0.6 m、水深20~30 cm处的4个采样点采取水样,通过微孔滤膜抽真空过滤,滤液密封保存。
1.4 检测指标与方法
生产性能测定:在测量日当天,从4个组中分别随机抽取30尾(各平行组10尾)对虾进行测量、称重,分别计算4个组对虾的健康及死亡情况。
水质指标测定:pH值用pH计现场测定,溶解氧(dissolved oxygen,DO)用水质检测仪现场测定,水质分析按照GB17378.4-2007方案进行[12],氨氮(NH4-N)含量测定采用次溴酸盐氧化法,亚硝酸氮(NO2-N)含量采用盐酸萘乙二胺分光光度法测定,硝酸氮(NO3-N)含量测定采用锌-镉还原法。
1.5 数据处理
所获数据经EXCEL表格初步处理作图,采用SPSS 21.0软件对数据进行方差分析,检验结果平均数的显著性,P<0.050表示差异显著。
2 结果与分析
2.1 微生物菌剂对长毛对虾的生产性能的影响
从表1可以看出,随着试验的进行,幼虾的体长和体重与养殖时间呈现良好的线性关系。使用了微生物菌剂组(组2、组3和组4)的生长速度和成活率均明显高于对照组(组1)(P<0.050),其中体重增长率比对照组(组1)分别提升了106.3%、131.2%和175.0%,成活率比对照组(组1)分别提升了40.9%、43.4%和43.8%。上述结果表明,喷洒在饲料上的微生物菌剂对对虾有明显的促生长作用,而且能明显地提升其存活率。
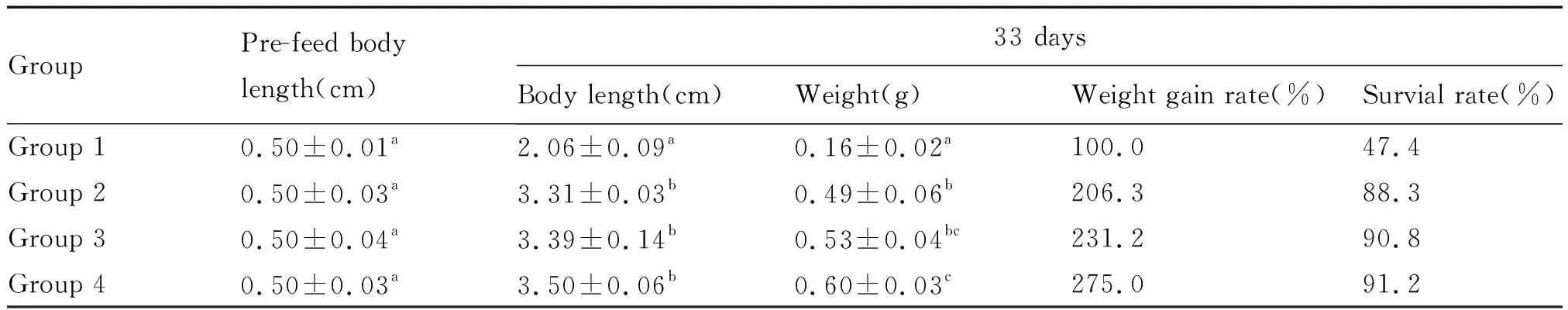
表1 试验33 d后各组的体长、体重、增重率和成活率Tab.1 The body length, weight, weight gain rate and survival rate of each group after 33 d incubation
注:表中同列数据肩标不同表示差异显著(P<0.050)
Note:There was significant difference in shoulder mark of the same column of data in the table (P<0.050)
2.2 微生物菌剂对饲养池底泥中弧菌数量的影响
在对虾的培育过程中,弧菌(Vibriospp.)对其危害较大[13-15]。当环境条件恶化,对虾抵抗力降低时,弧菌就会乘虚而入,引起对虾的病变,使其生长缓慢乃至死亡。从图1可以看出,对照组(组1)的弧菌个数是使用了微生物菌剂的试验组(组2、组3和组4)中的弧菌个数的14倍。在养殖前期(2018年5月23日),四个组饲养池中,1 g池底干泥中弧菌的数量无显著差异(P>0.050)。在养殖初期(前10 d),对照组(组1)的弧菌数呈上升趋势,而使用了微生物菌剂的试验组(组2、组3和组4)弧菌个数则缓慢减少(P=0.000)。以上结果表明,使用微生物菌剂能有效改善养殖水体环境,抑制有害菌体的生长。
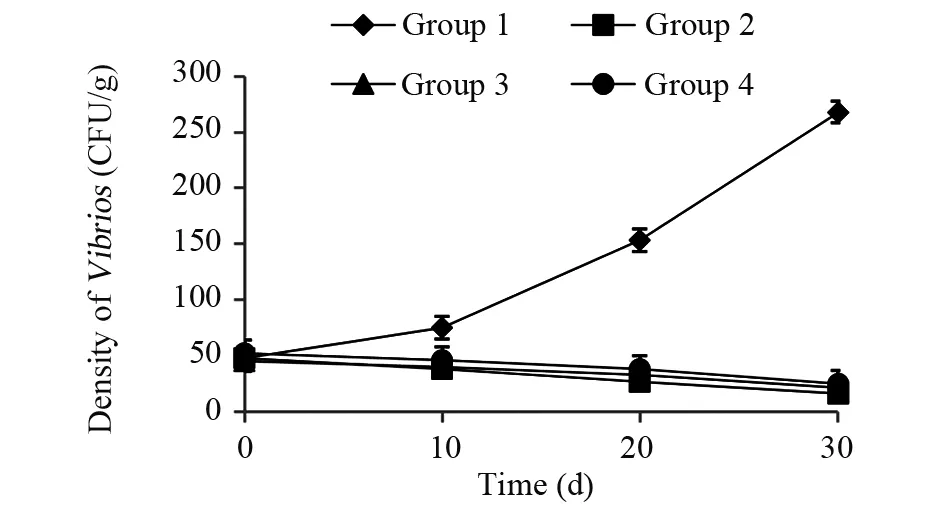
图1 试验期间各组饲养池中1 g池底干泥中弧菌的数量动态变化Fig.1 Dynamics of Vibrios during the 33 d incubation
2.3 微生物菌剂对养殖水体中pH和DO含量的影响
水中的酸碱度可直接影响对虾的新陈代谢,在对虾的生长过程中起着至关重要的作用。将各数据进行重复测量的方差分析,不同时间的pH值具有显著差异性(P<0.050)。如图2a所示,随着养殖时间的增长,使用了微生物菌剂的试验组(组2、组3和组4)的pH值逐渐降低,组4最低值达到7.01,对照组下降曲线则较为平缓。组1与组4在第0天时数据不具有显著差异性(P>0.050),第10天以后出现显著差异(P<0.050),这说明含2.0%的微生物菌剂的饲料可降低pH值。以上结果表明,使用微生物菌剂有助于控制养殖水池的pH值,以达到养殖水体环境质量的要求。
养殖水体中的溶解氧是对虾养殖过程中影响生长的重要因素,充足的溶解氧有助于对虾生长。在四次采样数据中,不同时间的溶解氧具有显著差异(F=191.959,P=0.000)。从图2b可以看出,4个组的溶氧量在33 d时间内呈下降趋势,使用了微生物菌剂的试验组(组2、组3和组4)水中DO含量比对照组(组1)高,养殖期间(2018年5月23日至2018年6月24日)DO含量波动范围在5.46~6.67 mg/L之间,对照组(组1)养殖水池中DO含量波动范围在4.39~6.45 mg/L之间。从各时间点看,除了第0天4个组的数据和第10天组3、组4的数据不具有显著差异外(P>0.050),其他时间点均以对照组的DO含量最低(P<0.050)。上述结果表明,使用微生物菌剂,能增加水体的DO,保证了对虾的正常生长。
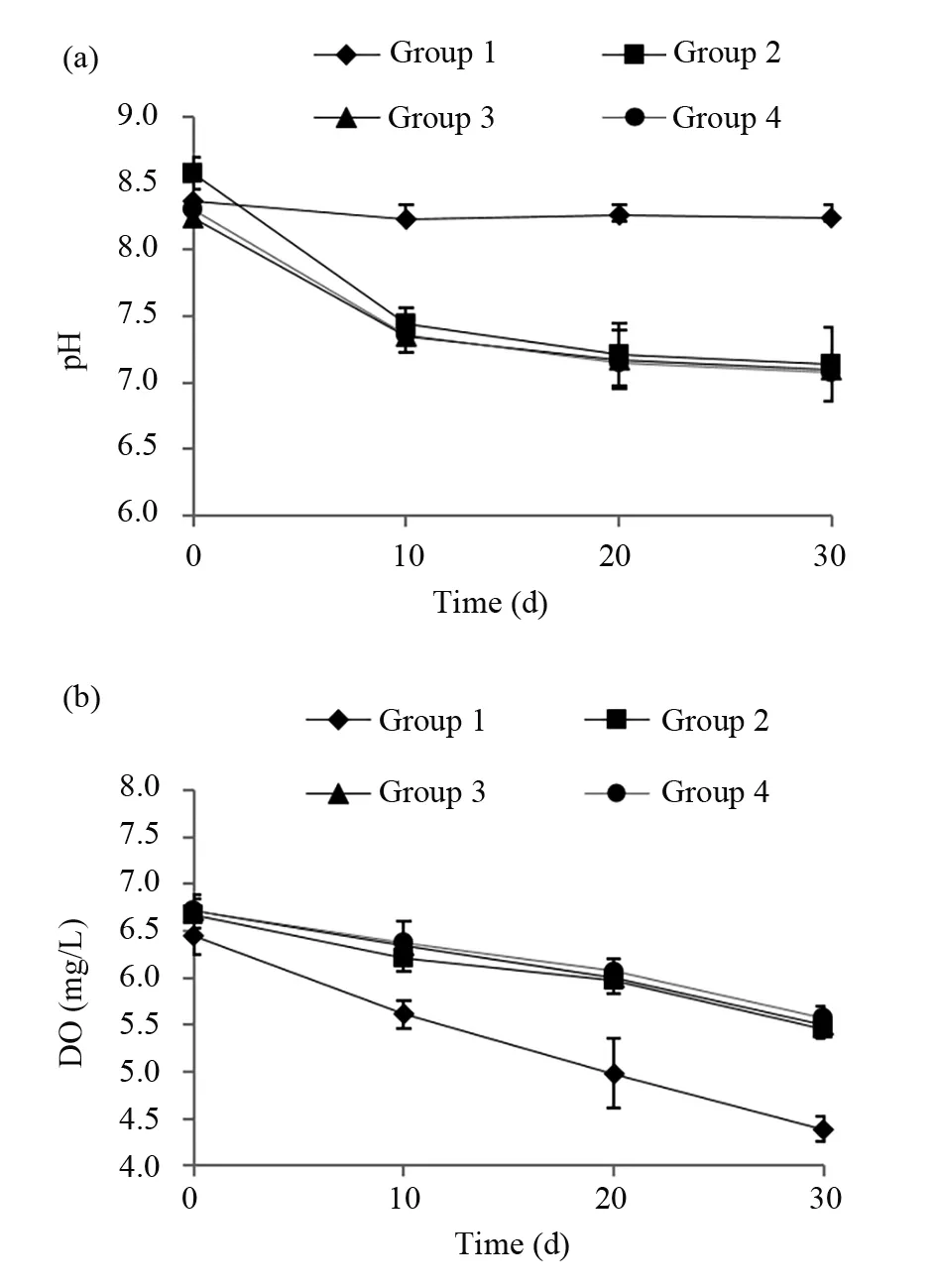
图2 试验期间各组养殖水体中pH和DO含量的动态变化Fig.2 Dynamics of pH and DO content in aquaculture water during the 33 d incubation(a)试验期间各组养殖水体中pH含量的动态变化;(b)试验期间各组养殖水体中DO含量的动态变化(a)Dynamics of pH content in aquaculture water during the 33 d incubation;(b)Dynamics of DO content in aquaculture water during the 33 d incubation
2.4 微生物菌剂对养殖水体中氮素形态的影响
氨氮(NH4-N)是养殖过程中产生的有害物质,浓度过高会制约对虾的养殖和造成水体富营养化等环境污染[16]。如图3a所示:在养殖初期(前10 d),4个养殖水池的NH4-N质量浓度都呈上升趋势,随着养殖时间的增加,使用微生物菌剂的试验组(组2、组3和组4)中的NH4-N质量浓度逐渐减少,而对照组(组1)的NH4-N质量浓度继续呈现上升趋势(F=250.633,P=0.000);在养殖前期(2018年5月23日),4个养殖水池的NH4-N质量浓度无显著差异(P>0.050),其他时间点均以对照组的NH4-N质量浓度最高(P<0.050);到养殖后期,使用微生物菌剂的试验组(组2、组3和组4)中的NH4-N质量浓度均低于0.070 mg/L,而对照组(组1)的NH4-N质量浓度已达0.162 mg/L。
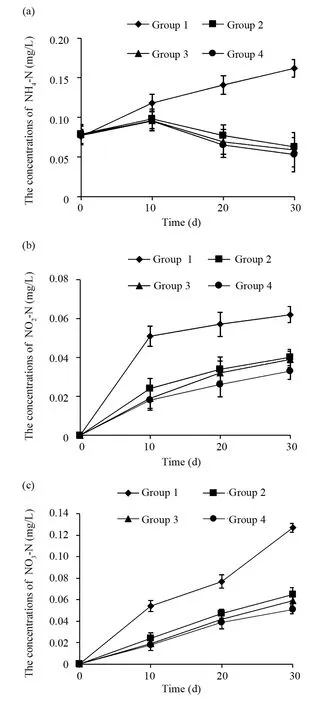
图3 试验期间各组养殖水体中NH4-N、NO2-N和NO3-N的动态变化Fig.3 Dynamics of NH4-N, NO2-N and NO3-N in aquaculture water during the 33 d incubation(a)试验期间各组养殖水体中NH4-N的动态变化;(b)试验期间各组养殖水体中NO2-N的动态变化;(c)试验期间各组养殖水体中NO3-N的动态变化(a)Dynamics of NH4-N in aquaculture water during the 33 d incubation;(b)Dynamics of NO2-N in aquaculture water during the 33 d incubation;(c)Dynamics of NO3-N in aquaculture water during the 33 d incubation
海水中亚硝酸氮(NO2-N)作为硝态氮(NO3-N)和铵态氮(NH4-N)还原与氧化过程的中间产物[17],含量相对较低且不稳定,但在虾塘养殖水环境中含量相对较高,经常被作为水质的一个考核指标。亚硝酸氮(NO2-N)也是养殖过程中产生的有害物质,浓度过高同样会制约对虾的养殖。如图3b所示:在养殖前期(2018年5月23日),4个养殖水池的NO2-N质量浓度均为0 mg/L,随着养殖时间的变化,4个养殖水池的NO2-N质量浓度逐渐上升(F=659.806,P=0.000);到了养殖后期,对照组(组1)水中的亚硝酸氮质量浓度均高于试验组(P<0.050),达到了0.062 mg/L,而使用了微生物菌剂的试验组(组2、组3和组4)水体中的亚硝酸氮质量浓度维持了较低的水平(P<0.050)。
海水中硝酸氮(NO3-N)是含氮有机物氧化分解的最终产物。水中的氮以硝酸盐形态存在,属低毒性或无毒性。其含量变化主要受海洋生物活动和有机质氧化分解的影响。如图3c所示,随着养殖时间的变化,4个组中的NO3-N质量浓均有增加(F=1 937.649,P=0.000),但使用微生物菌剂的试验组(组2、组3和组4)中的NO3-N质量浓度始终低于对照组(组1)(P<0.050)。
以上结果表明,微生物菌剂中的有益微生物能利用水体中的无机氮,使得养殖水体中的NH4-N、NO2-N和NO3-N维持在一个较低的水平,保证了对虾生存环境的健康。
3 讨论
在本研究中,复合微生物菌剂作为饲料添加剂对对虾有很明显的促生长作用,在第33天,对照组与各试验组的体重具有显著差异性(P<0.050),同时复合微生物菌剂还能显著地提升对虾的存活率。之前有报道指出,微生物菌剂中含有许多可提高动物免疫能力的生理活性物质[18],复合微生物菌剂中的益生菌定植在对虾肠道中可增强对虾的抗病力,提高其成活率[19-21]。Dicks等[22-24]的研究发现,添加酵母菌、乳酸菌、放线菌、芽孢杆菌和光合细菌等有益菌的复合微生物菌剂不仅可以抑制对虾体内病原菌生长,还能产生丰富的代谢产物,如维生素、类胡萝卜素和促生长因子等。本文中所用微生物菌剂中的益生菌也具有类似的效果,产生的代谢产物可促进宿主消化吸收[25],因此能够有效地促进对虾生长并能净化水质。
在水产养殖中,水体DO值和pH值是养殖环境监测的重要指标。本试验中,DO值在试验开始时各组数据中不具有显著差异,而在养殖10 d后,对照组与各试验组数据出现显著差异(P<0.050),且溶氧量低于试验组,随着养殖时间的延长,水体溶氧量会逐渐降低,但是添加微生物菌剂的试验组水体溶氧量在养殖期间始终高于对照组。养殖环境的酸碱度也能影响对虾的生长代谢,在养殖期间,各组pH值呈下降趋势(F=191.959,P=0.000),且试验组为7.0左右,而对照组呈弱碱性环境。有研究报道,乳酸菌和光合细菌都能增加水体溶氧量,调控水体酸碱度[26],这说明微生物菌剂中的乳酸菌可能在调节水质方面发挥着重要的作用。
水质的好坏是养殖成败的关键,微生物菌剂中的有益微生物能吸收和利用养殖水体中的无机氮,氨化功能细菌和硝化功能细菌在生物脱氨的各个环节中发挥协同作用,把有害的亚硝酸氮转化为无害的硝酸盐和菌体蛋白,从而使养殖水体的水质维持在对虾健康生长的标准,在维持养殖环境的生态平衡方面发挥着重要作用[16,17]。随着对虾的生长,各类有毒氮素含量会逐渐增加,在监测NH4-N、NO2-N和NO3-N动态变化的试验中,除了第0天各组数据无显著差异外(P>0.050),各试验组的氮素含量均低于对照组,F值分别为250.633、659.806和1 937.649,P值均为0.000。表明复合微生物菌剂可促进有害氮素转化为无害的硝酸盐,维持较好的水质环境。
总之,复合微生物菌剂作为饲料添加剂,可增强对虾的抗病力,促进对虾的消化吸收生长,在提高幼虾成活及成虾产量等问题上有较高的使用价值,且具有捕捞后无兽药、激素等残留的优点,可有效替代抗生素在水产养殖业中广泛应用。作为净水剂,在消除有机物污染、净化水质的同时,还能有效抑制水体中有害微生物的生长繁殖,显示出良好的应用效果。
