人髓样分化因子88的生物信息学分析
2020-07-09施晓波陈建林
王 道,施晓波,陈建林
(中南大学湘雅二医院妇产科, 长沙 410011)
人髓样分化因子88(myeloid differentiation factor 88,MyD88)属于调节先天免疫的衔接蛋白,在人体内病毒和细菌感染的免疫应答中发挥重要的功能[1-4]。Lord等[5]在髓样前体的鼠骨髓中分析发现了MyD88基因。以往研究发现其在免疫细胞如单核细胞系、胸腺细胞系、T 淋巴细胞系、B淋巴细胞系、Th1细胞系和Th2细胞系中表达,说明人MyD88蛋白具有广泛分布性[6-8]。而且,大量研究集中关注人MyD88在炎症、肿瘤等领域发挥的作用[9-12]。Chen等[13]发现MiR-146a通过TLR4/MyD88信号转导途径能够减轻急性痛风性关节炎。Zhu等[14]和Sewastianik等[15]发现人MyD88影响了癌细胞的增殖、侵袭和迁移。Kfoury等[16,17]报道人MyD88可能具备双重功能,既发挥促肿瘤作用,也可以通过调节免疫反应发挥抗肿瘤作用。本文对人MyD88结构模型进行相关生物信息学分析,并阐述其功能,为疾病治疗等提供新的思路。
1 材料与方法
1.1 材料
人(Q99836)、大鼠(Q6Y1S1)、小鼠(P22366)、鸡(A5HNF6)、猪(A0A140TAK4)的 MyD88 蛋白序列都从UniProt数据库(http://www.uniprot.org)获取,人MyD88基因的核酸序列Accession(NC_000003.12)从NCBI数据库(https://www.ncbi.nlm.nih.gov/)获取。
1.2 方法
对人MyD88使用多种生物信息数据库进行结构和功能分析,具体见表1。

表1 预测分析人MyD88结构和功能的生物信息数据库Tab.1 Important databases for predictive analysis of human MyD88 structure and function
2 结果与分析
2.1 人MyD88基因的开放阅读框和染色体定位
人MyD88基因全长为5 670 bp,位置为38 138 006~38 143 675,共有649个开放阅读框,如图1a所示。Ensemble(http://asia.ensembl.org/)显示该基因位于3号染色体上(3p22.2)(图1b)。
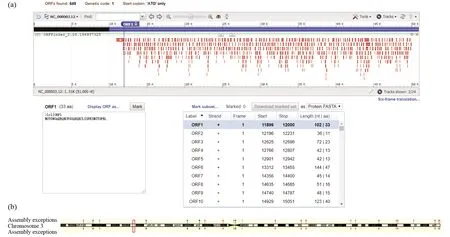
图1 人MyD88基因的开放阅读框(a)和基因的染色体定位信息(b)Fig.1 The open reading frame (a) and chromosome location of human MyD88 gene (b)
2.2 人MyD88蛋白的理化性质分析
使用ProtParam预测分析了人MyD88蛋白的理化性质,发现该蛋白由296个氨基酸残基组成,含有36个带正电荷的氨基酸残基(Arg+Lys)和38个带负电荷的氨基酸残基(Asp+Glu);总分子式为C1 471H2 361N403O437S16,总原子数为4 691,分子质量为33 233.36;半衰期是30 h;等电点是5.89;消光系数是38 430;疏水值是92.30,平均亲水性是-0.174;不稳定系数是45.58,人MyD88为不稳定蛋白质。
2.3 人 MyD88 蛋白物种同源性分析
把人(Homosapiens)(Q99836)MyD88 的氨基酸序列与大鼠(Rattusnorvegicus) (Q6Y1S1)、 小鼠(Musmusculus)(P22366)、鸡(Gallusgallus)(A5HNF6)和猪(Susscrofa)(A0A140TAK4)的氨基酸序列进行多序列比对和构建进化树。比对结果如图2a所示,具有相似性高的氨基酸是从第145位至第295位,5个物种的氨基酸序列相似性较高,同源性较高。进化树结果如图2b所示,人与猪、小鼠、大鼠进化距离较近,但是与鸡相距较远,说明人MyD88蛋白在哺乳动物之间的保守性较高,可推测其有重要的功能。

图2 人MyD88氨基酸序列比对(a)和进化树分析(b)Fig.2 Sequence alignment analysis (a) of human MyD88 and phylogenetic tree (b)
2.4 人MyD88蛋白在正常组织的表达分布
通过GEDS在线分析数据库(http://bioinfo.life.hust.edu.cn/web/GEDS/)分析,结果显示,人MyD88蛋白在血液中表达量最高,其次是脾脏和肺,心脏、脑的含量处于较低水平,在肌肉中的表达量是最低的,可推测其在血液中的表达量对发挥生物学作用是至关重要的(图3)。
2.5 人MyD88蛋白的信号肽和亚细胞定位预测分析
利用SignalP 4.1 Server网站(http://www.cbs.dtu.dk/services/SignalP- 4.1/)进行信号肽分析,Cut-off default=0.450。结果显示,C-Max Position、Y-Max Position、S-Max Position 分别为 46、46、44,其中C-Max Value、Y-Max Value、S-Max Value 分别为0.185、0.182、0.500,S-mean(1~ 45)和D (1~ 45)分别为0.182、0.182,得分值Score<0.450,提示人MyD88不存在信号肽,属于非分泌性蛋白(图4)。采用Genecards网站(https://www.genecards.org/)进行人MyD88蛋白的亚细胞定位分析,根据Confidence(0~5)对应颜色的深浅,发现该蛋白主要分布在细胞核、细胞质和囊泡中,而且在质膜、线粒体、溶酶体中也有分布,表明人MyD88参与了维持细胞正常形态和骨架结构的过程(图5)。
2.6 人MyD88蛋白的磷酸化位点和苏木化位点预测分析
提交人MyD88蛋白的氨基酸序列到NetPhosK 2.0和SUMOPLOT进行软件预测分析,结果显示,有25个磷酸化位点,其中磷酸化丝氨酸位点15个(氨基酸位置分别为 15、16、18、19、34、85、108、137、194、224、230、242、244、266、294位),磷酸化苏氨酸位点6个(氨基酸位置分别为 17、66、149、202、237、272位),磷酸化酪氨酸位点4个(氨基酸位置分别为 58、116、227、276位)(图6)。人MyD88蛋白上存在一些容易发生苏木化修饰的位点,其中K261位点发生概率最高(Score=0.80>0.50),K262位点概率较小(Score=0.13<0.50)(图7)。结果表明,人MyD88可能发生丝氨酸、苏氨酸、酪氨酸激酶磷酸化以及K261位点的苏木化修饰发挥调控机制。
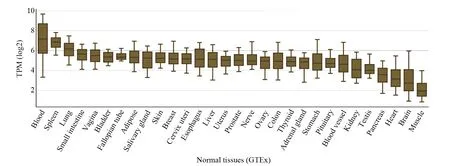
图3 人MyD88在正常组织的表达量分析Fig.3 Analysis of normal tissues expression of human MyD88
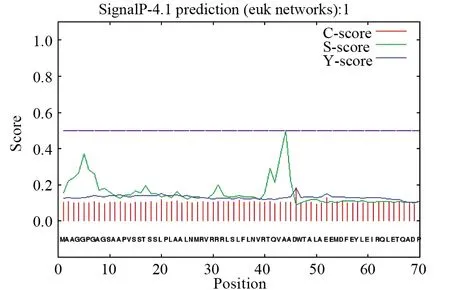
图4 人MyD88信号肽预测Fig.4 Signal peptide prediction of human MyD88
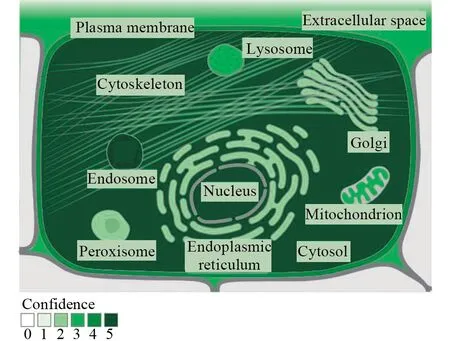
图5 人MyD88亚细胞定位预测Fig.5 Subcellular location prediction of human MyD88
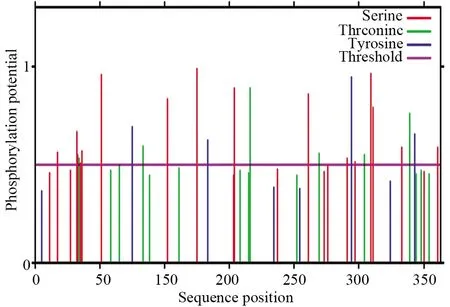
图6 人MyD88蛋白磷酸化位点预测Fig.6 Phosphorylation sites prediction of human MyD88
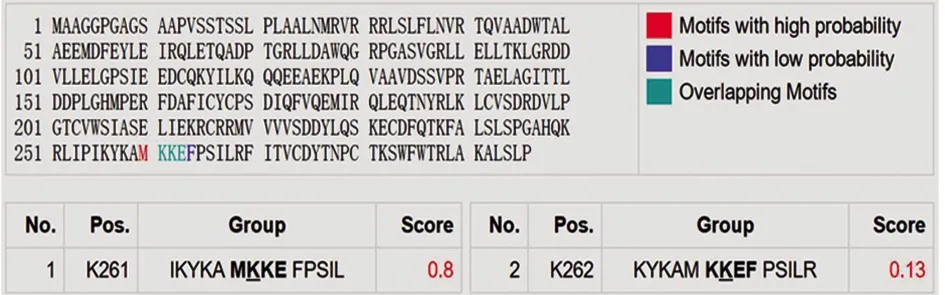
图7 人MyD88蛋白SUMO化位点预测Fig.7 Sumolation sites prediction of human MyD88
2.7 人MyD88蛋白质高级结构预测分析
运用Jpred 4.0蛋白二级结构在线分析网站(http://www.compbio.dundee.ac.uk/jpred/)进行预测,发现人MyD88蛋白存在145个α-螺旋,其占55.07%(163/296),存在 30个β-折叠,其占38.18%(113/296),剩余的是无规则卷曲。说明该蛋白是以α螺旋为主,具有超过50%氨基酸的有序空间构象(图8)。
Swiss-Model网站(https://swissmodel.expasy.org/)预测人MyD88三级结构存在2种模型。模型A(图9a)和模型B(图 9b)对应的模板都不同,其主要重叠分别在第146~296 位氨基酸、第26~117 位氨基酸,序列等同度分别为62%、59%。而且图9c峰图波形比图9d峰图稳定,可推测模型A更加符合人MyD88蛋白的三级真实结构。进一步对模型A的可靠性进行分析,如图10拉曼图表明,除160位、188位和269位的精氨酸(Arg),150位和199位的亮氨酸(Leu) 以及244位的丝氨酸(Ser)和202位的苏氨酸(Thr)以外, 大于90%的氨基酸位于红色核心区域,其中黄和红色区域形成二面角合理, 有较好的三级构象空间,深入证明了模型A的三级结构的可靠性。

图8 人类MyD88二级蛋白结构分析Fig.8 Secondary protein structure analysis of human MyD88 H:α-螺旋;E:β-折叠H:α-helix; E:β-sheet
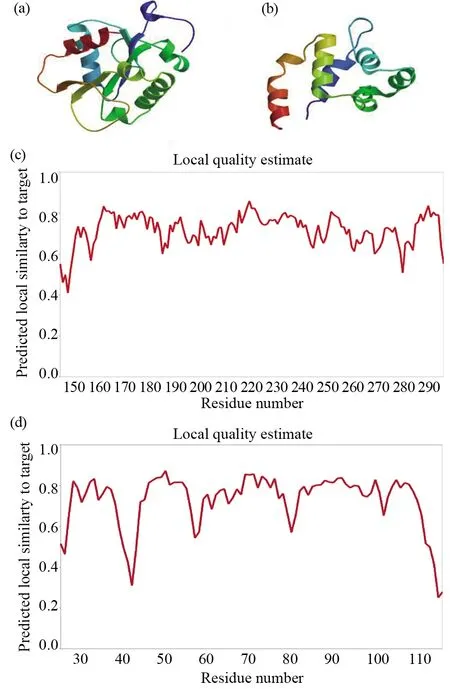
图9 人类MyD88的三级蛋白结构构象图Fig.9 Tertiary protein structure model prediction of human MyD88(a)人类MyD88三级结构模型A; (b)人类MyD88三级结构模型B; (c)与模型A的模板相似性峰图; (d)与模型B的模板相似性峰图(a)The tertiary structure model A of human MyD88; (b)The tertiary structure model B of human MyD88; (c)Peak map of template similarity to the model A; (d)Peak map of template similarity to the model B

图10 人类MyD88模型A的拉曼构象图分析Fig.10 Ramachandran map analysis model A of human MyD88
2.8 人MyD88蛋白String分析和GO分析
通过 String 数据库分析预测与人MyD88发生相互作用的蛋白,发现与人MyD88 相互作用前10的蛋白质为IL1R1、IRAK4、IRAK1、TRAF6、IRAK2、TLR3、IRAK3、IRF7、TLR7、MAP3K7,具体如图11所示。其中IL1R1、IRAK1、IRAK4、IRF7 等蛋白在先天免疫应答中起关键作用,TLR3和TLR7蛋白属于先天和适应性免疫的关键组成部分,表明该蛋白在先天性免疫反应中起核心作用。
GO(gene ontoloty)注释分析的细胞组分结果提示:人MyD88蛋白主要定位在核内体,在胞质内大量分布;分子功能结果表明,人MyD88蛋白属于Toll样受体(TIR),具有TIR结构域,能够与白介素-1受体和凋亡受体等其他蛋白受体结合且形成二聚体结构;生物学过程表明,人MyD88 参与调控趋化因子的生物合成、诱导机体抵抗、调节机体炎症反应和细胞凋亡等过程,分析结果和人 MyD88 互相作用蛋白参与免疫反应相一致(图12)。
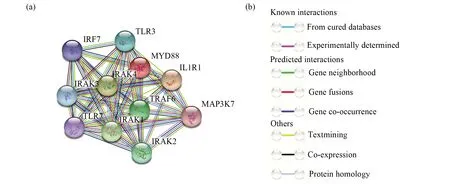
图11 预测与人类MyD88发生相互作用的蛋白网络Fig.11 Protein network interacted with human MyD88(a)相互作用蛋白网络图;(b)蛋白相互作用连线说明(a)Interacting protein prediction;(b)Instructions with protein interaction lines
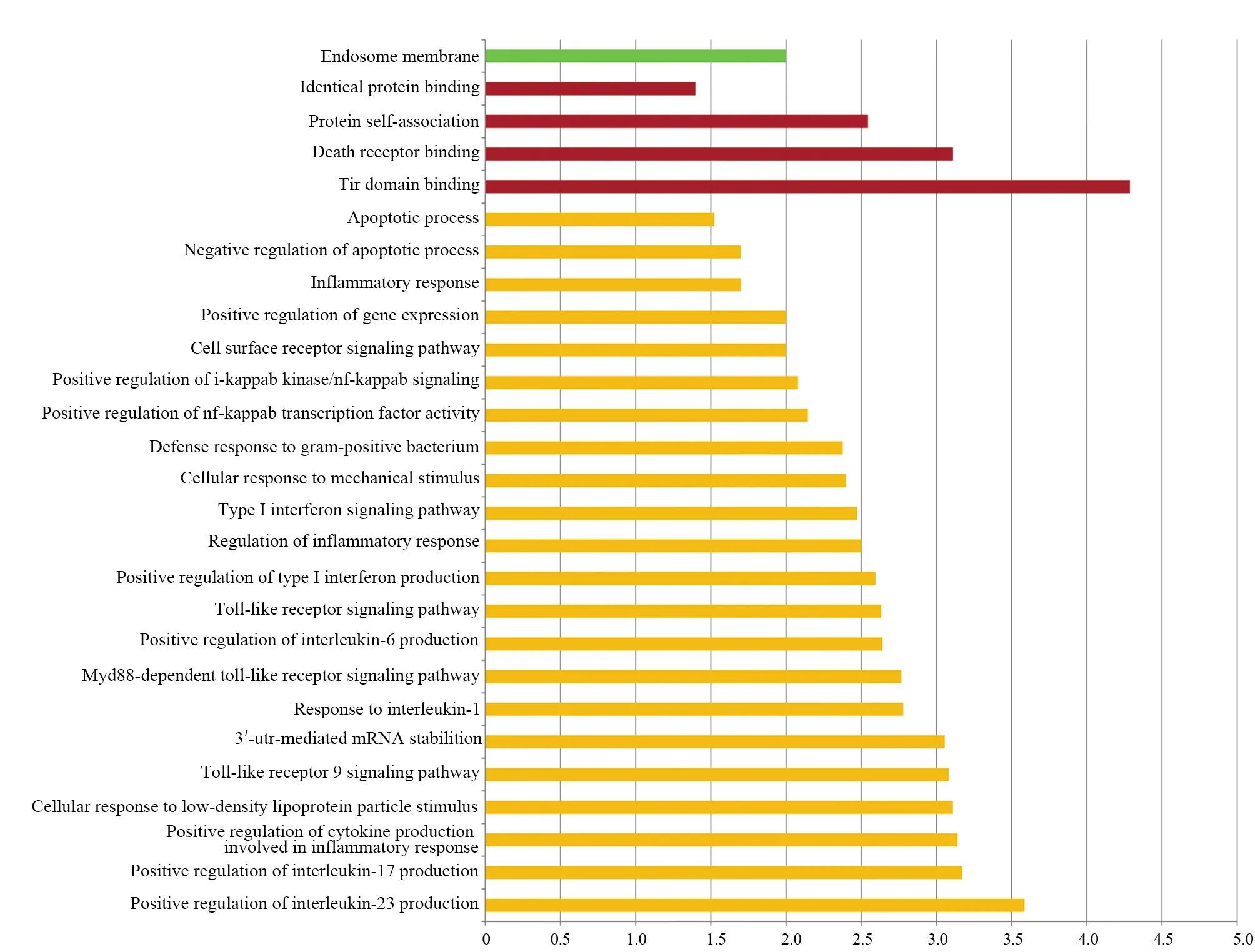
图12 人类MyD88的GO注释分析Fig.12 GO analysis of human MyD88绿色表示细胞组分;红色表示分子功能;黄色表示生物学过程Green means cellular component;Red means molecular function;Orange means biological processes
3 讨论
人MyD88是由296个氨基酸构成,以α-螺旋为主的二级结构蛋白,本文结果表明,其在血液、脾脏等淋巴器官中存在高度表达,与相关文献报道的其在单核细胞、T、B、NK和树突细胞表达是相符的[18,19]。以往研究也证实,由于所有TLR/IL-1R都能与人MyD88发生相互作用,病原体和宿主的刺激对TLR/IL-R的异常激活,可以产生一系列炎症细胞因子和其他介质[20]。当前,人MyD88在肿瘤细胞的侵袭和转移过程中的作用也受到人们的日益关注。Wu等[21]在乳腺癌中发现人MyD88表达水平与乳腺癌细胞转移程度呈正相关。我们推断检测人MyD88在肿瘤中的表达可以预测人类癌症,如脾脏、淋巴、结肠肿瘤等。最近,Wang等[22]的研究也发现人MyD88具有双重功能,诱导肿瘤细胞的侵袭和自我更新,发挥促肿瘤作用以及维持肿瘤的抗肿瘤作用,推测人MyD88可能参与癌症相关细胞信号通路以外的其它机制。
为了探究这种可能的机制,我们首先对人MyD88基因进行分析,结构分析表明,该基因位于3号染色体上,基因全长为5 670 bp,同源比对结果表明人、猪、小鼠和大鼠均具有较高的相似性。这提示我们在进行动物模型研究中需选取同源性较高的部分序列,研究其在进化中保留的重要生物学作用。而且,人MyD88蛋白是一个不稳定蛋白,不含信号肽,亚细胞定位大量存在于细胞核和细胞质中,在线粒体和溶酶体内也有一些分布,这些都揭示其能够在胞内组装折叠成相应结构并结合相应蛋白质,随后参与线粒体、细胞核、过氧化物酶体等免疫应激反应,与Balaji等[23,24]报道其可能定位于核内并行使较多功能的特点相一致。我们还推测,人MyD88存在25个磷酸化位点和2个苏木化位点,这与Wu等[25]运用磷酸化蛋白质组学证实的磷酸位点和 Lanfranca等[26]证实的E3泛素连接酶能苏木化修饰且阻断人MyD88下游的信号传导同时能降低其表达的报道是一致的。
此外,本文预测的人MyD88和IRAK、TLR等发生相互作用也在相关文献中有报道[27,28]。有趣的是,Wang等[29]证实人MyD88与caspase3介导的凋亡途径有关。Huang等[30]发现 TLR4-MyD88-JNK信号通路促进大鼠的炎症反应,从而引起神经元细胞凋亡。Saxena等[31]发现通过抑制人MyD88阻断IL-1受体信号,可以减少对血管损伤的新内膜形成,降低平滑肌细胞的过度增殖。
综上所述,生物信息学是一种新的研究蛋白质结构和功能预测的重要手段,能够进一步挖掘基因的潜在功能。后续我们还需进行人MyD88蛋白表达及功能验证试验来判定预测结果的精准性,为其今后成为潜在的靶分子用于疾病诊断和治疗奠定基础。
