Mdivi-1对cuprizone诱导的脱髓鞘性病变小鼠少突胶质细胞的保护作用*
2020-07-06李艳花刘晓琴牛春红薛秀花张晓娟尉杰忠马存根
李艳花,刘晓琴,牛春红,黄 芳,薛秀花,徐 芳,张晓娟,尉杰忠△,马存根,△
(1山西大同大学脑科学研究所,神经炎症及变性疾病基础与应用研究山西省重点实验室,山西大同037009;2北京师范大学细胞增殖及调控生物学教育部重点实验室,北京100875;3山西中医药大学神经生物学研究中心,国家中医药管理局多发性硬化益气活血重点研究室,山西晋中030619)
多发性硬化(multiple sclerosis,MS)属于中枢神经系统脱髓鞘疾病[1]。有较多研究表明,MS患者中存在着补体的激活[2]。复发缓解型和继发进展型MS患者的脑脊液中C1q水平较对照组有显著提升[3],复发的MS患者脑和脊髓组织病灶内补体因子B(complement factor B,CFB)和C3b均有高表达,补体激活在MS病理过程中的神经细胞、轴突和髓鞘损伤中起着重要的作用,有可能成为MS治疗的靶点[4-5]。
线粒体是一种动态的细胞器,发动蛋白相关蛋白1(dynamin-related protein 1,Drp1)磷酸化后转移到线粒体,与线粒体分裂蛋白1(mitochondrial fission protein 1,Fis1)相互作用,引起线粒体分裂。Drp1的超级活化会造成线粒体分裂过度,形成线粒体碎片导致氧化应激、生物能量缺陷和促凋亡因子的释放,从而介导细胞损伤[6]。最近,越来越多的研究发现,在MS患者血清、脑脊液和中枢神经系统病灶区存在诸多线粒体损伤的现象[7]。线粒体分裂抑制剂1(mitochondrial division inhibitor-1,Mdivi-1)是一种分子量为353.22的有机小分子化合物,可以通过血脑屏障进入脑内,其作用靶点是Drp1蛋白[8]。Mdivi-1通过抑制Drp1蛋白过度磷酸化,减少线粒体过度分裂,在脑缺血、帕金森病[9]、亨廷顿病、肌萎缩侧索硬化、阿尔茨海默病[10]等疾病中都展示出良好的治疗效果,但对MS的治疗却鲜有报道[11]。
材料和方法
1 材料
1.1 实验动物 健康雄性C57BL/6小鼠32只,体重18~20 g,8周龄,从北京维通利华动物有限公司购买,生产许可证号为SCXK(京)2019-0008,使用许可证号为SYXK(晋)2018-0002。
1.2 主要试剂 含0.2%cuprizone的饲料(Envigo);OCT(optimum cutting temperature)包埋剂(Sakura Finetek);抗髓磷酯蛋白脂质(myelin proteolipid,PLP)抗体(LifeSpan BioSciences);抗C1q抗体、抗CFB抗体、抗C3b抗体和抗C5b-9抗体(Abcam);抗半乳糖脑苷脂酶(galactocerebroside,GalC)抗体(Millipore)。
2 方法
2.1 动物分组及模型制备 所有动物实验均符合山西大同大学动物伦理委员会的相关规定,尽可能减少动物使用量,避免疼痛,清洁级饲养。上述C57BL/6小鼠饲喂含或无0.2%cuprizone的饲料[12-14],从第15天起开始给药处理,共分为4组,每组8只:(1)DMSO正常(DMSO+normal)组(d42),饲喂无cuprizone的饲料,从第15天起持续腹腔给予0.1%DMSO水溶液,至第42天麻醉处死;(2)cuprizone模型组(d15),饲喂含cuprizone的饲料15 d,于给药起始时处死;(3)DMSO+cuprizone模型组(d42),饲喂含cuprizone的饲料,从第15天起持续腹腔给予0.1%DMSO水溶液,至第42天麻醉处死;(4)Mdivi-1干预(Mdivi-1+cuprizone)组(d42),饲喂含cuprizone的饲料,从第15天起持续腹腔给予Mdivi-1(25 mg·kg-1·d-1,溶解于0.1%DMSO水溶液),至第42天麻醉处死。处理流程见图1。
2.2 标本采集 给药结束时,采用0.3%戊巴比妥钠每只0.2 mL腹腔麻醉后,断颈处死,用生理盐水经心脏灌注,再用40 mL的4%多聚甲醛灌注,取脑组织,体外2%多聚甲醛室温过夜固定。蔗糖梯度脱水,OCT包埋,于液氮中快速冷冻,冰冻切片机切片,将各个实验组样本的切片依次粘贴在同一张载玻片上,切片厚度为10 μm(前囟-0.94 mm至-2.18 mm,见图1),-80℃冰箱中冷藏备用。
2.3 LFB髓鞘染色 使用本实验室改良的固蓝(Luxol fast blue,LFB)染色流程将上述冰冻切片进行染色,具体如下:切片晾干,70%和95%乙醇各浸泡30 s,乙醇∶二甲苯(1∶1)溶液中5 min,纯二甲苯中15 min,脱脂;再次在乙醇∶二甲苯(1∶1)溶液、95%乙醇中依次浸泡30 s,除去二甲苯。之后按常规放入LFB溶液中,57℃恒温摇床温育8 h。经酒精梯度复水至70%乙醇,0.05%碳酸锂2 min,70%乙醇10 min,分化完成。乙醇、二甲苯梯度脱水透明,中性树胶封片,显微镜下观察胼胝体(位置如图1所示)。
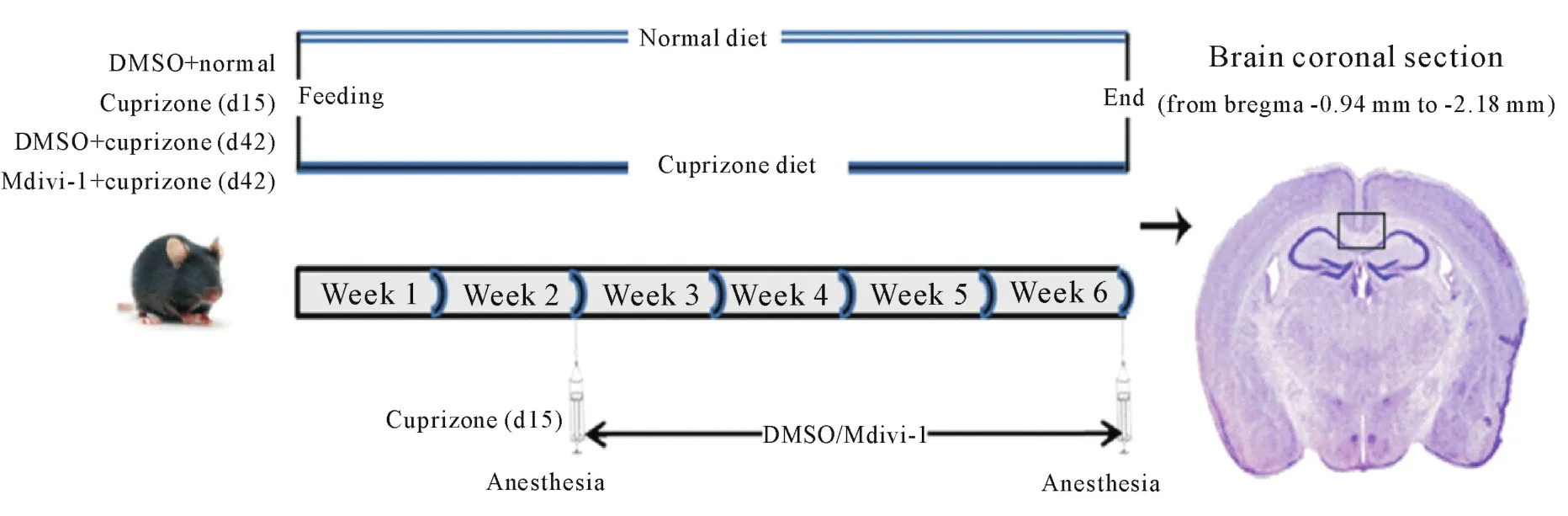
Figure 1.Timeline depicting the experimental design for mice exposed to cuprizone and DMSO or Mdivi-1 treatment for 15 d or 42 d.The animals were divided into DMSO+normal group,cuprizone(d15)group,DMSO+cuprizone(d42)group and Mdivi-1+cuprizone(d42)group.图1 实验分组及cuprizone处理实验设计
2.4 免疫荧光染色 将上述冰冻切片晾干,PBS浸洗3次,每次5 min,1%BSA/PBS封闭2 h,用1%BSA/0.3%Triton X-100/PBS稀释I抗(抗PLP抗体、抗C1q抗体、抗CFB抗体、抗C3b抗体、抗C5b-9抗体和抗GalC抗体),4℃孵育过夜,PBS洗3次,每次5 min,再加入相应的II抗,室温孵育1.5 h,PBS洗3次。50%甘油封片。未加I抗处理的切片作为阴性对照。用激光共聚焦显微镜采集数据。
2.5 TUNEL染色 根据TUNEL试剂盒说明书操作,使用4%多聚甲醛溶液将上述冰冻切片固定10 min,PBS浸洗3次,每次5 min,用1%BSA/0.3%Triton X-100/PBS通透10 min,PBS浸洗3次,在TUNEL荧光素染色液中浸染10 min,PBS浸洗3次,50%甘油封片。用激光共聚焦显微镜采集数据。
3 统计学处理
每组8只小鼠,所有实验均重复至少3次。使用Image-Pro Plus软件选取计数或面积参数,对上述图片进行分析。GraphPad Prism 5软件对数据进行单因素方差分析。统计图中的数据采用均数±标准差(mean±SD)表示,以P<0.05为差异有统计学意义。用Excel软件统计功能中的CORRL工具做两变量之间的相关系数分析。
结 果
1 Mdivi-1保护胼胝区髓鞘免受cuprizone损伤
在模型制备的第42天,麻醉处死所有剩余动物,脑组织冰冻切片行LFB髓鞘染色和PLP抗体免疫荧光染色。结果显示,与DMSO正常组比较,cuprizone饲喂42 d导致小鼠大脑胼胝体区的髓鞘明显丢失,残留很少[LFB:(28.73±8.78)%;PLP:(20.15±3.77)%],然而Mdivi-1干预明显减少了髓鞘丢失[LFB:(73.16±10.96)%;PLP:(58.88±6.65)%],LFB髓鞘染色结果和PLP抗体免疫荧光染色结果相似,见图2。
2 Mdivi-1降低Drp1(Ser616)磷酸化水平
Drp1(Ser616)过度磷酸化会导致线粒体过度分裂,导致细胞损伤。已有研究显示Mdivi-1能抑制Drp1的过度磷酸化,起神经保护作用。因此,我们检测了Mdivi-1是否能够抑制Drp1的过度磷酸化。结果显示,DMSO正常组Drp1磷酸化的细胞较少;cuprizone饲喂15 d导致Drp1磷酸化水平明显升高,饲喂42 d时Drp1磷酸化水平达到高峰,并定位于GalC+的少突胶质细胞;Mdivi-1干预明显减少了Drp1磷酸化,见图3。
3 Mdivi-1干预明显减少了细胞凋亡
前人研究显示Drp1(Ser616)过度磷酸化会引发细胞凋亡,因此,我们利用TUNEL试剂盒检测了细胞凋亡情况。结果显示,cuprizone饲喂15 d,胼胝体区出现大量凋亡细胞,持续饲喂42 d时,凋亡细胞数减少近50%;Mdivi-1干预明显减少了凋亡细胞的数目(P<0.01),见图4。
4 Mdivi-1抑制少突胶质细胞的补体激活替代通路
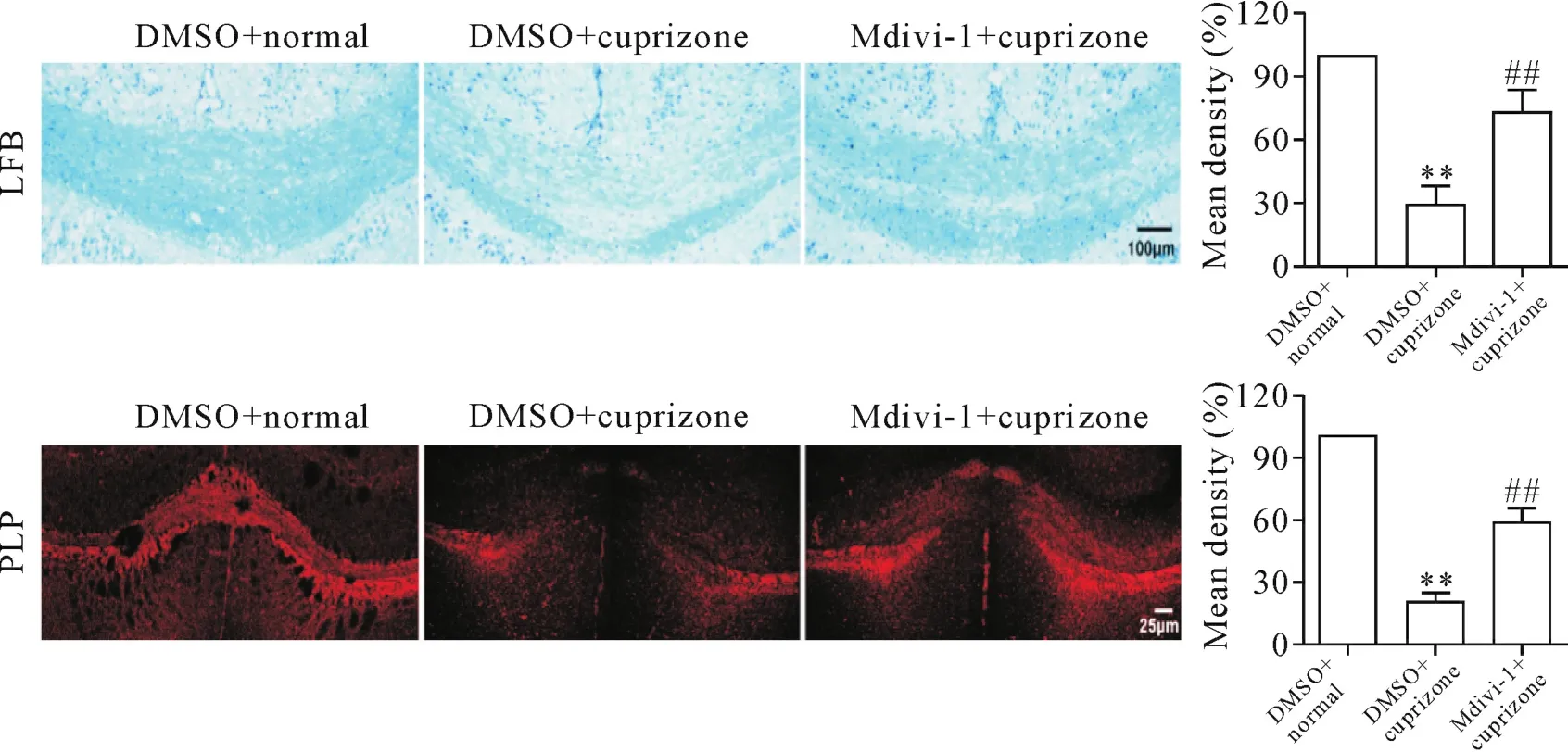
Figure 2.Mdivi-1 prevented myelin loss after cuprizone treatment.LFB staining and immunofluorescence of PLP-positive myelin in the corpus callosum of brain,and quantitative analysis of the myelin density were performed.Mean±SD.n=8.**P<0.01 vs DMSO+normal group;##P<0.01 vs DMSO+cuprizone group.图2 Mdivi-1保护胼胝体髓鞘免受cuprizone诱导的损伤

Figure 3.Mdivi-1 inhibited the phosphorylation of Drp1 on day 42 after cuprizone treatment.Representative microphotographs for p-Drp1(Ser616)+and quantitative analysis were shown.Representative microphotographs for p-Drp1+GalC+cells in the brain of mice were also exhibited.Mean±SD.n=8.**P<0.01 vs DMSO+normal group;##P<0.01 vs cuprizone group;△△P<0.01 vs DMSO+cuprizone group.图3 Mdivi-1降低cuprizone诱导的少突胶质细胞Drp1磷酸化水平
细胞死亡的另一个原因可能与补体激活导致的攻膜复合体在细胞膜上组装相关。补体活化分为经典途径、替代途径和凝集素途径3种。我们采用免疫荧光染色技术,检测了补体通路中重要的成分:C1q、CFB、C3b和C5b-9。结果显示,DMSO正常组以上补体分子的表达量均很低,cuprizone饲喂15 d导致C1q、CFB、C3b和C5b-9表达量升高,持续饲喂42 d时C1q、CFB、C3b和C5b-9表达量到达高峰,而Mdivi-1处理明显降低了CFB、C3b和C5b-9的表达,但不影响C1q的表达;再使用免疫荧光双色标记实验发现,补体分子C1q表达于Iba-1+的小胶质细胞上,CFB、C3b和C5b-9均定位于GalC+的少突胶质细胞上,见图5。这说明Mdivi-1明显地抑制了CFB相关的攻膜复合体在少突胶质细胞的组装。
5 Drp1磷酸化水平与补体激活相关

Figure 4.Mdivi-1 significantly inhibited cell apoptosis in the corpus callosum of the mice(TUNEL staining).Mean±SD.n=8.*P<0.05,**P<0.01 vs DMSO+normal group;##P<0.01 vs cuprizone group;△△P<0.01 vs DMSO+cuprizone group.图4 Mdivi-1抑制胼胝体区细胞凋亡
用Excel软件将不同实验组的p-Drp1、TUNEL、C1q、CFB、C3b、C5b-9各项检测指标的阳性细胞面积做线性图,分析Drp1磷酸化程度与其它检测指标的相关系数。结果显示,Drp1磷酸化程度与TUNEL、C1q、CFB、C3b和 C5b-9的相关系数分别为 0.27、0.44、0.99、0.98和0.98,可见Drp1磷酸化与TUNEL的相关系数最小,而与CFB/C3b/C5b-9补体分子的相关系数较大,见图6。
讨 论
cuprizone脱髓鞘模型是国际上公认的研究MS的一种动物模型,小鼠喂食cuprizone后,在大脑胼胝体区可出现明显的髓鞘丢失和成熟少突胶质细胞减少的现象[15]。2017 年,Luo等[16]的研究显示体外H2O2、TNF-α处理少突胶质细胞可导致大量的Drp1转移到线粒体;在MS的动物模型——实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)和cuprizone模型小鼠的脊髓和脑组织中也出现Drp1(Ser616)磷酸化程度升高的现象,认为Drp(Ser616)的过度激活与少突胶质细胞损伤直接相关。P110是一种小分子肽,能抑制Drp1激活,干扰Drp1与Fis1的相互作用,抑制线粒体过度分裂,减少线粒体碎片化,具有髓鞘保护作用[16]。Mdivi-1通过抑制Drp1蛋白过度磷酸化,减少线粒体过度分裂,具有保护线粒体的功能[8],与P110相似,但由于Mdivi-1是小分子化合物,使用成本更低,应用价值更高。本研究通过饲喂含cuprizone日常鼠粮,成功造成了小鼠胼胝体的髓鞘脱失,导致磷酸化Drp1阳性细胞增加,凋亡细胞也增加;与cuprizone模型组(d15)比较,DMSO+cuprizone模型组(d42)胼胝体区磷酸化Drp1阳性细胞明显增多,但TUNEL阳性细胞数量减少了约50%;Mdivi-1干预明显减少了Drp1磷酸化和细胞凋亡。另外,磷酸化Drp1阳性细胞面积与TUNEL阳性细胞面积的相关性系数只有0.27。这些结果表明,凋亡是cuprizone造成少突胶质细胞早期丢失的原因,但在cuprizone模型晚期,凋亡作用减弱,细胞凋亡与磷酸化Drp1相关性较小。那么,在cuprizone模型晚期,Drp1大量激活与什么相关,该时期造成髓鞘丢失的主要原因又是什么呢?
前人研究显示补体途径激活能导致攻膜复合体的组装,在MS发展过程中发挥双重作用,膜结合型攻膜复合体在EAE急性期具有促炎和溶解髓鞘的作用;亚溶解型攻膜复合体(sublytic C5b-9)则通过抑制细胞色素C释放及caspase-9和caspase-3的激活,促进凋亡前体蛋白BAD磷酸化来减少少突胶质细胞的凋亡,提高其存活率,进而发挥神经保护作用[17]。因此,本研究对补体激活途径及其终产物的表达进行了分析,结果显示cuprizone导致C1q、CFB、C3b和C5b-9的表达量增加,与cuprizone模型组(d15)比较,DMSO+cuprizone模型组(d42)胼胝体C1q、CFB、C3b和C5b-9表达量升高更明显,Mdivi-1干预明显降低了CFB、C3b和C5b-9的表达量,但是没有影响C1q的表达;并且C1q定位于小胶质细胞,而CFB、C3b和C5b-9定位于少突胶质细胞。这些结果提示,cuprizone处理可以导致少突胶质细胞中补体替代途径的激活,并导致攻膜复合体在少突胶质细胞上的组装。因此,攻膜复合体的组装有可能是凋亡之外,cupri-zone模型中少突胶质细胞丢失的另一个重要原因。另外,磷酸化Drp1阳性细胞面积与CFB、C3b和C5b-9阳性细胞面积的相关性系数较大,说明Drp1的过度激活可能与替代途径补体分子的激活和攻膜复合体的组装相关。目前,未见研究显示Drp1磷酸化/线粒体失调在补体激活过程中起作用。在将来,探索Drp1过度激活导致补体激活的信号通路可能具有重要的意义。

Figure 5.Mdivi-1 significantly inhibited the activation of CFB/C3b/C5b-9 pathway.Observation of C1q,CFB,C3b and C5b-9 positive staining in the corpus callosum of the mice was accessed by immunofluorescence method,and the quantitative analysis was performed.Double immunofluorescence staining for C1q+Iba-1+,CFB+GalC+,C3b+GalC+,and C5b-9+GalC+were showed.Mean±SD.n=8.*P<0.05,**P<0.01 vs DMSO+normal group;##P<0.01 vs cuprizone group;△△P<0.01 vs DMSO+cuprizone group.图5 Mdivi-1抑制CFB/C3b/C5b-9补体途径的激活
综上所述,我们推测在cuprizone模型的早期,少突胶质细胞死亡的主要原因是凋亡,其机制可能与Drp1介导的线粒体通路相关性较小;而在模型的晚期,少突胶质细胞死亡的主要原因可能是补体替代途径激活的膜结合型攻膜复合体的组装,其机制可能与Drp1介导的线粒体通路相关性较大。Mdivi-1干预可抑制少突胶质细胞凋亡和膜结合型攻膜复合体的组装,起到保护少突胶质细胞和髓鞘的作用,但其机制仍需要深入探讨。
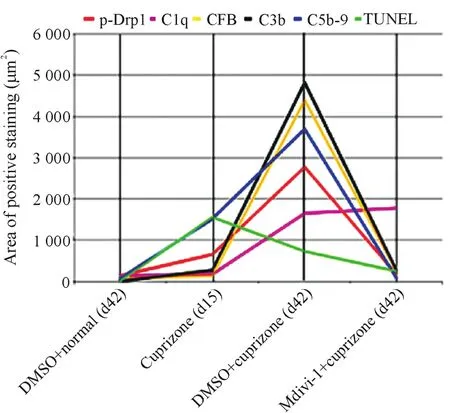
Figure 6.Analysis of correlation.The trendlines of different detection factors in different groups were shown.The correlation coefficients for p-Drp1 between TUNEL,C1q,CFB,C3b and C5b-9 were 0.27,0.44,0.99,0.98 and 0.98,respectively.图6 相关性分析
