MCP-1/CCR2信号途径介导酒精诱导的乳腺癌血管新生*
2020-07-06何晓刚徐晓丹徐晓军李菲菲
季 丹,何晓刚,汪 刚,罗 涛,张 露,徐晓丹,徐晓军,3,李菲菲△
(1安徽医科大学基础医学院,安徽合肥230032;2安徽医学高等专科学校,安徽合肥230061;3安徽医科大学第一附属医院乳腺外科,安徽合肥230022)
近年来,许多恶性疾病被认为是免疫异常的结果,其中细胞因子和趋化因子作为重要的炎症介质,参与了肿瘤的发生与恶性转化,涉及肿瘤细胞生物学的许多方面,包括监管肿瘤细胞的生长、血管生成、肿瘤转移以及宿主的免疫反应[1-2]。单核细胞趋化蛋白 1(monocyte chemoattractant protein-1,MCP-1)也被称为CC趋化因子配体2(CC chemokine ligand 2,CCL2),其受体为CC趋化因子受体2(CC chemokine receptor 2,CCR2)。研究表明,MCP-1/CCR2信号途径在炎症反应中发挥招募和激活单核细胞、调节免疫反应的重要作用[3]。新近文献报道,MCP-1的分泌及其受体CCR2的表达与酒精导致的细胞毒性、免疫损伤及肿瘤侵袭性生长相关[4]。乳腺癌作为女性发病率和致死率最高的恶性疾病,其发生发展机制复杂。流行病学调查表明,饮酒会以剂量依赖的方式增加患乳腺癌的风险[5-6],但酒精促进乳腺癌发生发展的分子机制是否与MCP-1相关还有待进一步阐明。本研究旨在观察酒精促进乳腺癌生长转移与趋化因子MCP-1/CCR2介导的肿瘤血管新生的关系。
材料和方法
1 主要材料和试剂
小鼠乳腺癌E0771细胞和人乳腺癌MDAMB231细胞由Dr.Enrico Mihich(Roswell Park Cancer Institute,Buffalo,NY)提供。DMEM培养基、纤维蛋白原、蛋白酶抑制剂、凝血酶和酒精购自Sigma;抗MCP-1抗体和抗CCR2抗体购自BD Biosciences;Cytodex 3微珠购自Amersham Pharmacia Biotech;其它试剂材料为本实验室常规保存。
2 实验方法
2.1 细胞培养 E0771细胞用含有10%胎牛血清、1×105U/L青霉素、100 mg/L链霉素和0.25 mg/L两性霉素B的DMEM培养基于37℃、5%CO2的细胞培养箱中培养。MDA-MB231细胞和小鼠血管内皮细胞SVEC4-10EE2(SVEC)用含10%胎牛血清、1×105U/L青霉素和100 mg/L链霉素的DMEM培养基于37℃、5%CO2的细胞培养箱中培养。MDA-MB231细胞是具有侵袭性的乳腺癌细胞并且对酒精暴露敏感。用1 g/LⅠ型胶原酶使人脐静脉内皮细胞(human umbilical vein endothelical cells,HUVEC)脱离新鲜的人类胎盘,并于EGM-2培养基中培养。
2.2 小鼠乳腺肿瘤移植瘤模型的建立 健康C57BL/6小鼠购自江苏集萃药康生物有限公司,许可证号为SCXK(苏)2018-0008。将C57BL/6小鼠随机分成2组,每组8只:(1)正常对照(control)组;(2)2%酒精(EtOH)组。其中,control组给予常规灭菌饮用水;EtOH组晚上8点到次日早上8点给予含2%酒精的饮用水,再换回常规灭菌饮用水,到晚上8点再换成2%酒精,依次循环。饮酒后1周进行肿瘤细胞接种:取对数生长期的E0771细胞,胰酶消化,离心后用PBS或无胎牛血清的DMEM重悬,将细胞混匀,用1 mL无菌注射器抽取0.3 mL的细胞悬液,将细胞皮下接种到C57BL/6小鼠下腹部第2乳腺处,每只小鼠接种0.1 mL的细胞悬液,即每只小鼠接种3.5×105个E0771细胞。细胞接种后,每2~3 d观察肿瘤生长情况,并称重小鼠体重,于第21天处死小鼠,取瘤组织、称重固定,-80℃保存。
2.3 免疫组化和微血管密度检测 从上述移植瘤标本取癌组织和癌旁组织,按常规程序脱水、固定、切片制成组织切片。分别加Ⅰ抗[抗MCP-1、CCR2、血小板内皮细胞黏附分子1(platelet endothelial cell adhesion molecule-1,PECAM-1)和血管内皮生长因子(vascular endothelial growth factor,VEGF)抗体]孵育后PBS清洗4次,Ⅱ抗孵育25 min后PBS清洗4次,然后显色、封片、拍照。以每张切片超过10%肿瘤细胞浆或细胞膜呈棕黄色者,作为MCP-1和CCR2蛋白的阳性表达。微血管密度(microvessel density,MVD)的测定:以PECAM-1(CD31)单抗染成鲜红色的单个内皮或内皮细胞群作为一个微血管,在40倍镜下选取5个血管丰富的视野,于100倍镜下用北航CMIAS图像分析系统对染色阳性血管进行密度定标。由计算机自动求和并取平均值。
2.4 3D肿瘤细胞-内皮细胞共培养系统 HUVEC或SVEC被胰蛋白酶消化后(1×106)与Cytodex微珠(3×103)在4 mL培养基(HUVEC用EGM-2培养基,SVEC用DMEM培养基)中混合,加入50 mL离心管中。混合物在5%CO2、37℃环境下孵育4 h,每隔20 min混匀一次。在孵育的第4 h,加入4 mL的培养基后继续孵育4 h。然后将包被有内皮细胞的微载体混合液转移到25 mL的组织培养瓶中继续培养过夜,使细胞不附着到微珠但附着在瓶体。第2天,将培养瓶轻轻冲洗后将混合液转移到50 mL离心管中,用不含Ca2+和Mg2+的PBS轻洗3遍,重悬于含有2.5 g/L纤维蛋白原和1.5×102U/L蛋白酶抑制剂的DMEM培养基中。在24孔板中加入0.625 U的凝血酶包被,再加入0.5 mL的微载体和纤维蛋白原溶液的混合液,室温静置凝结5 min,然后37℃、5%CO2孵育20 min。形成的纤维蛋白凝胶中内皮细胞粘附在微珠上。每孔加入1 mL含1.5×102U/L蛋白酶抑制剂的培养基,使其与纤维蛋白凝块平衡在37℃培养箱中孵育30 min。将24孔板内培养基吸掉,加入1 mL含1.5×102U/L蛋白酶抑制剂的新鲜培养基,于37℃恒温、5%CO2孵箱中培养,5~96 h后4%多聚甲醛固定,邻苯二甲酸二烯丙酯(diallyl phthalate,DAP)染色,观察倒置显微镜下“出芽”(sprouts)的情况;对照组为不含肿瘤细胞的空白培养基模型。结果判断:在规定观察时点,每个培养孔在倒置显微镜下,随机取3个视野,观察“出芽”情况,计算出芽的微珠占总数的百分比(percentage of beads with sprouts)。
2.5 乳腺癌细胞酒精暴露实验 在培养基中添加酒精(95%酒精),稀释至所需水平的酒精浓度(0.2%)。培养的细胞被放置在一个有密封盖子的塑料容器中。在每个容器底部都有200 mL的水浴,水浴中酒精的浓度与培养基中相同。密封每个容器之前,注入60 mL CO2。将容器置于加湿的环境中,并维持在37℃、5%CO2环境中。用这种方法,培养基中的酒精浓度可以准确地维持。
2.6 细胞迁移实验 将Transwell小室插入培养板中,由一个孔径为8 μm的膜分成一个上室和一个下室。上室接种SVEC(3×104)并用含2%胎牛血清的DMEM维持。下室充满了含2%胎牛血清和不同浓度MCP-1(0.5和10 μg/L)的培养基。将小室放于37℃、5%CO2环境下孵育12 h。用甲醇固定膜,残留在上室的细胞被除去。迁移的细胞吉姆萨染色并计数,每个孔选择5个随机的镜下视野进行计数,每个孔得到3个视野的平均数。
3 统计学处理
各组数据均以均数±标准差(mean±SD)表示,两组间均数比较用t检验,多组间均数比较用单因素方差分析,以P<0.05为差异有统计学意义。所有的统计分析使用SPSS 10.0软件进行。
结 果
1 MCP-1和CCR2在饮酒的乳腺癌移植肿瘤小鼠的癌组织中高表达且与血管新生指标相关
小鼠乳腺癌组织免疫组化染色结果显示,MCP-1和CCR2在肿瘤组织中均呈阳性表达,在饮酒小鼠组织中强阳性表达,见图1A,且与微血管标志物PECAM-1和VEGF表达水平正相关,见图1B。微血管计数显示,饮酒组小鼠肿瘤组织中微血管密度显著高于非饮酒的对照组肿瘤组织(P<0.05),见图1C。
2 成功建立乳腺癌细胞和内皮细胞共培养3D血管生成模型
在乳腺癌细胞和内皮细胞共培养系统中内皮细胞附着在Cytodex微珠表面生长,形成一个3D毛细管状网络结构,表明血管生成。如图2A所示,SVEC附着Cytodex微珠从微珠发芽形成短而狭窄的条索状结构。在这个系统中加入乳腺癌细胞(2×104或4×104E0771细胞)共培养可以明显增加了SVEC“出芽”的数量和长度:SVEC单独培养的“出芽”率为57.2%,SVEC和E0771共培养的“出芽”率显著提高(P<0.05);然而,高密度的E0771细胞(4×104)并没有进一步增加出芽,表明适宜的肿瘤细胞数更能促进血管新生,见图2B。
3 MCP-1可以通过其受体CCR2促进肿瘤血管生成
为了研究MCP-1是否直接参与肿瘤血管生长,我们利用三维血管生成的体外模型,共培养血管内皮细胞和肿瘤细胞(乳腺癌细胞E0771或MDAMB231),观察在MCP-1直接诱导下,微载体表面的血管生成情况。结果显示:E0771或MDA-MB231细胞与内皮细胞共培养时,都可见明显的内皮细胞出芽式血管生成(E0771组68%,MDA-MB231组70%);然后,在内皮细胞的三维培养体系里加入在MCP-1诱导以代替肿瘤细胞的共培养,同样观察到了微载体表面有大量微血管形成(两组分别为65.3%与69.7%),与诱导前的对照组相比显著增多(P<0.01);而使用MCP-1受体CCR2的抑制剂(CCR2 antagonist,CCR2 AT)处理后,血管生成分别降至52.7%和51.9%,与MCP-1诱导组相比显著减少(P<0.05),见图3。由此可见,MCP-1不仅直接诱导内皮细胞形成微血管的能力,并且是为血管形成所必需的因子之一。

Figure 1.Analysis of MCP-1,CCR2 and angiogenesis of the breast cancer tissues in mice between ethanol consumption group(EtOH)and control group(Con).A:immunohistochemical staining of MCP-1 and CCR2 in breast tumor tissues(×100);B:immunohistochemical staining of PECAM(CD31)and VEGF in breast tumor tissue(×100)C:effect of ethanol on microvessel density(MVD)of E0771 transplanted tumor tissues.Mean±SD.n=8.*P<0.05 vs control group.图1 MCP-1和CCR2的组织表达与微血管分布的相关性
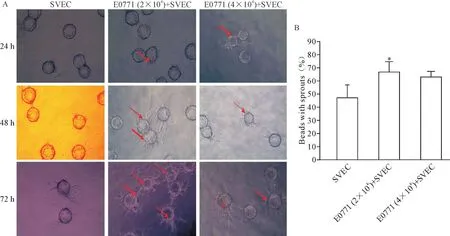
Figure 2.Sprouts and new micro-vessels formation in three-dimensionalin culture models of SVEC and Cytodex in fibrin medium.A:sprouts were observed on the beats surface as shown in red arrows per 24 h;B:sprouts were counted at 72 h after co-cultured in 3D medium.Mean±SD.n=6.*P<0.05 vs SVEC group.图2 脐静脉内皮细胞SVEC、Cytodex微载体及E0771细胞在Fibrin胶中3D共培养时新生血管生成的情况

Figure 3.MCP-1 can increase angiogenesis in vitro.E0771 or MB231 were co-cultured with SVEC pre-beaded with cytodex in 3D angiogenesis system.Then cells were treated with MCP-1 or MCP-1 antagonist.After 96 h,besds with sprouts were counted under microscope.Mean±SD.n=6.*P<0.05,**P<0.01 vs control group;#P<0.05 vs tumor cell group and MCP-1 group.图3 MCP-1在体外诱导肿瘤血管生成
4 CCR2抑制剂可以特异性阻断酒精诱导的肿瘤血管生成
我们在肿瘤细胞与内皮细胞三维共培养体系中加入MCP-1受体拮抗剂,观察对血管生成的影响。结果显示:内皮细胞SVEC4-10-EE2单独培养时,无论加入酒精与否,都未见有明显的“出芽”。在与E0771共培养后,微载体表面形成较多的微血管样结构,加入0.2%的酒精刺激后,微血管结构进一步增多(P<0.05)。在使用CCR2AT后,无论有无酒精刺激,血管生成均明显受到抑制(P<0.01),见图4。由此可见,当CCR2生物学效应被阻断时,酒精加速的血管生成的诱导肿瘤效应明显减弱,酒精相关乳腺肿瘤血管生成与MCP-1/CCR2信号密切相关。
5 MCP-1/CCR2过增加内皮细胞迁移促进血管新生
血管生成是由内皮细胞的活化调节的,包括内皮细胞的增殖增加或迁移两种主要形式。为了进一步了解MCP-1/CCR2途径究竟通过何种机制来促进血管新生,我们观察检测了MCP-1/CCR2对内皮细胞增殖和迁移的影响。结果显示,MCP-1并不能引起人脐静脉内皮细胞的增殖;但是通过迁移实验发现,5 ng和10 ng计量的MCP-1均可以显著刺激内皮细胞的迁移,而这种迁移被CCR2拮抗剂阻断(P<0.01),见图5B。以上结果说明MCP-1/CCR2信号途径是通过增加血管内皮细胞迁移来促进血管新生的。
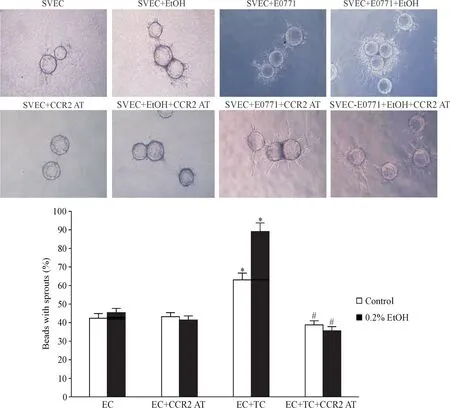
Figure 4.CCR2 antagonist inhibited tumor angiogenesis with or without Ethanol in vitro.A:morphologic change of tumor angiogenesis after treatment of CCR2 antagonist with or without ethanol in vitro;B:statistics of beads with sprouts in different groups.Mean±SD.n=6.*P<0.05 vs control,**P<0.01 vs control and 0.2%EtOH groups.TC:tumor cell;EC:endothelial cell.图4 CCR2阻断剂CCR2AT可以抑制体外肿瘤血管新生

Figure 5.The effects of MCP-1/CCR2 on HUVEC proliferation and migration.A:MCP-/CCR2 didn’t affect HUVEC proliferation;B:MCP-1 promted HUVEC migration.Mean±SD.n=6.*P<0.05 vs control group;**P<0.05 vs MCP-1 group.图5 MCP-1/CCR2途径对内皮细胞增殖和迁移直接影响
讨 论
在肿瘤新生血管的来源中,其中一个重要理论就是认为肿瘤细胞自身分泌的多种细胞因子可以活化内皮细胞,从而刺激其增殖或迁移,形成新的脉管结构[7]。在本研究中我们通过使用3D肿瘤-内皮细胞共培养模型,来评估酒精是否能刺激肿瘤细胞,引起肿瘤细胞和内皮细胞的相互作用,促进血管新生。实验结果表明,在这个3D系统中加入乳腺癌细胞共培养一段时间,明显刺激了血管生成,在此基础上我们进一步研究证明了酒精的刺激可以增强此种血管新生作用,其作用机制是与MCP-1相关,当使用MCP-1抑制剂或者其受体CCR2抑制剂,血管新生效应大大受到抑制。
MCP-1是炎症领域单核细胞和巨噬细胞的一个强有力的趋化因子,并且参与感染性疾病、肿瘤发生发展[8-9]。MCP-1在正常乳腺上皮导管细胞中极少表达,但在乳腺癌细胞中广泛表达[10]。已经有大量研究表明MCP-1是乳腺癌发生发展的重要促进因子。它介导的亲肿瘤活性可能与以下因素有关:(1)刺激有害的肿瘤相关巨噬细胞(tumor-associated macrophages,TAM)的增加,从而抗肿瘤T细胞活性的抑制;(2)增加肿瘤细胞和肿瘤微环境的细胞之间的相互适应,起到促肿瘤生长转移作用;(3)对乳腺癌细胞的迁移和侵袭特性直接增加[11-13]。
此外,近年来还发现MCP-1也是一种促血管生成因子,它可以通过增加TAM的活性,通过TAM促进血管生成因子VEGF等分泌,从而促进血管新生[14]。乳腺肿瘤在发生发展中血管新生密度显著增加,在饮酒患者中尤为显著,那MCP-1是否能通过酒精作用,进一步促进肿瘤血管生成和肿瘤生长的呢?本研究结果证实,外源的MCP-1可以直接促进肿瘤血管新生作用,这种作用可能是通过肿瘤细胞分泌MCP-1,介导血管内皮细胞迁移来实现的。使用MCP-1受体拮抗剂CCR2 AT能有效抑制了酒精处理过的乳腺癌细胞促血管生成作用;在没有MCP-1刺激时,同培养体系也能出现大量新生血管,但是如果用CCR2抑制剂则可以大大阻断这一效应,提示乳腺癌细胞可能以旁分泌的方式产生MCP-1,通其受体CCR2介导酒精暴露刺激下的肿瘤血管新生。
酒精介导的血管生成和促肿瘤机制非常复杂,可能涉及多种参与者和调节者。除了其他潜在途径,本研究阐明了MCP-1在酒精诱导血管生长和肿瘤生长中的作用及其调节肿瘤生长转移的可能机制。
