敲减NLRC3表达对人正常支气管上皮BEAS-2B细胞生长的影响*
2020-07-06黄铀新孟祥磊张敏鸿罗耀玲
黄铀新,孟祥磊,张敏鸿,罗耀玲,李 杰△
(赣南医学院第一附属医院 1核医学科,2呼吸内科,3临床科研中心,江西赣州341000)
流行病学调查结果显示肺癌的发病率和死亡率均位于其它肿瘤之首[1-2]。肺癌的早期临床表现不典型,早期诊断率较低[1-2]。基因突变是导致肺癌发生的一个重要因素,虽然目前已观察到诸多生物标志物,如RECQL4(RecQ protein-like 4)、FOXM1(forkhead box M1)等[3-4]与肺癌发病相关,但仍不能满足临床上肺癌早期诊断需求,故仍需对肺癌进行探索以寻找肺癌诊断标志物及治疗靶点,利于肺癌的早期诊断、早期治疗和降低肺癌患者的死亡率。
含胱天蛋白酶募集结构域的NOD样受体家族蛋白3(NOD-like receptor family caspase recruitment domain containing 3,NLRC3)是NOD样受体(NOD-like receptors,NLRs)家族的一员,由位于16p13.3染色体的NLRC3基因所编码,是胞质内固有的免疫调节因子,能够抑制核因子κB(nuclear factor-κB,NF-κB)控制的主要炎症通路[5]。在结肠癌和肝癌中的研究显示,NLRC3有抑癌作用,是预测和治疗肿瘤的潜在肿瘤标志物和新靶点[4-5]。然而NLRC3是否在肺癌发生中起作用,目前尚不清楚。本研究拟通过小片段干扰RNA(small interfering RNA,siRNA)技术,敲减NLRC3在人正常支气管上皮BEAS-2B细胞内的表达,观察细胞活力和凋亡的变化,并初步探索NLRC3参与调控肺癌发生的分子机制。
材料和方法
1 材料
BEAS-2B细胞株购自中科院上海细胞生物研究所细胞库。RPMI-1640培养液和胎牛血清购自GIBCO;Lipofectamine™ 2000和TRIzol购自Invitrogen;荧光定量PCR试剂盒购自BIO-RAD;RIPA裂解液购自上海碧云天公司;JC-1和annexin V-FITC/PI细胞凋亡检测试剂盒均购自BD;β-actin、Bcl-2和Bax抗体及II抗购自中杉金桥公司;3条NLRC3siRNA片段(分别记为siNLRC3-1、siNLRC3-2和siNLRC3-3)及阴性对照序列(negative control siRNA,siNC)由生工生物(上海)股份有限公司设计合成。
2 方法
2.1 细胞培养 BEAS-2B细胞培养于含10%胎牛血清的RPMI-1640培养液;于37℃、5%CO2饱和湿度的恒温细胞培养箱中培养。细胞表现为贴壁生长,后续实验所用细胞均是取自处于对数生长期的细胞,活细胞数达95%以上。
2.2 BEAS-2B细胞的siRNA转染及最佳干扰片段的筛选 按照Lipofectamine™2000转染操作说明书将荧光标记的FAM-siRNA片段按照不同比例转染于6孔板中BEAS-2B细胞,转染6 h后荧光显微镜下观察转染效率。
为筛选最佳干扰片段,将细胞分为未转染(untransfected,UT)组、siNC组、siNLRC3-1组、siNLRC3-2组和siNLRC3-3组。各实验组均取处于对数生长期的细胞,胰酶消化后,计数,按每孔1.5×105个细胞接种于6孔板,待细胞密度达30%~50%后开始转染。转染6 h后将培养液更换为完全培养液继续培养24 h。收集各组细胞,采用TRIzol法提取各组细胞总RNA,并通过紫外分光光度仪测定浓度及纯度。
将各组总RNA浓度调一致后,按照TaKaRa的PrimeScript™ RT Master Mix(Perfect Real Time)逆转录试剂盒说明书的指导进行cDNA逆转录反应操作,荧光定量PCR验证3条干扰片段的干扰效果,挑选最佳干扰片段。NLRC3的上游引物序列为5'-GACATGAAGGCGTTTGGTGT-3',下游引物序列为5'-GCCATAGTAATACGCGGCTG-3',产物长度为153 bp。内参照β-actin的上游引物序列为5'-TATCCAGGCTGTGCTATCCC-3',下游引物序列为5'-CCATCTCTTGCTCGAAGTCC-3',产物长度为 320 bp。PCR条件为:94℃预变性10 min;94℃变性15 s,60℃退火30 s并收集荧光,共40个循环。数据采用相对定量法,以 2-ΔΔCt来进行分析,ΔCt=Ct目的-Ct内参照,ΔΔCt=ΔCt实验组-ΔCt对照组。
2.3 MTT法检测3个干扰片段对BEAS-2B细胞的活力影响 胰酶消化对数生长期的BEAS-2B细胞,计数并按每孔4×103个来接种96孔培养板,待过夜培养贴壁后以siNLRC3∶Lipofectamine™2000为0.25 μL∶0.25 μL的量进行细胞转染,UT组用PBS处理,转染6 h后更换新的培养液继续培养24 h,然后每孔加入20 μL 5 g/L的MTT溶液,继续培养4 h,培养结束后小心吸去孔内液体,然后每孔加入200 μL DMSO,避光振荡10 min使结晶物充分融解,随后用酶标仪于570 nm波长测定各孔吸光度(A570)。实验重复3次。细胞相对活力(%)=干扰组A570/UT组A570×100%。
2.4 JC-1检测线粒体膜电位 将细胞分为3组:UT组、siNC组和siNLRC3-3组。取对数生长期的BEAS-2B细胞,按每孔1.5×105接种于6孔板,待细胞密度达50%后开始转染,转染6 h后更换培养液继续培养24 h。然后收集各组的细胞,计数;再用PBS洗涤2次,重悬,调节细胞浓度为1×109L。从中取细胞悬液100 mg/L加入流式管,加入终浓度为10 mg/L的JC-1,37℃温育30 min,然后上流式细胞仪进行检测。
2.5 annexin V-FITC/PI凋亡检测试剂盒检测细胞凋亡率 实验分组、细胞培养及转染方法同前JC-1实验。收集转染24 h后的各转染组细胞及未转染组细胞,冷PBS洗涤2次,4℃、192×g离心 5 min,用 1×Binding Buffer调整浓度1×109/L;从中取细胞悬液100 μL(1×105个细胞)加入流式管,并向管中加入5 μL annexin V-FITC,轻轻摇匀后避光室温孵育10 min,再于管中加入5 μL PI,室温下避光孵育15 min;孵育结束后向管内添加400 μL 1×Binding Buffer,轻轻摇匀后1 h内用流式细胞仪进行检测。计算凋亡细胞占总细胞的百分比。
2.6 Western blot检测敲减NLRC3表达对Bcl-2和Bax蛋白表达的影响 实验分组、细胞培养及转染方法同前,转染48 h后弃培养液并用1×PBS洗涤3遍,随后置冰上用RIPA裂解液(用前加入PMSF,终浓度为1 mmol/L)充分裂解各组细胞30 min,继之以4℃、16 400×g离心5 min,上清液即是总蛋白。使用BCA蛋白定量试剂盒测定各组蛋白量;每组蛋白上样30 μg;SDS-PAGE分离蛋白后切取目的蛋白凝胶进行电转PVDF膜;后经封闭、I抗孵育、洗膜、II抗孵育、洗膜、ECL发光等步骤,在Bio-Rad凝胶成像仪上成像,并将条带进行灰度分析。
3 统计学处理
运用SPSS 18.0软件对数据进行统计分析,结果以均数±标准差(mean±SD)表示;多组数据间的比较采用单因素方差分析(one-way ANOVA),组间两两比较若方差齐采用LSD法,方差不齐采用Tamhane’s T2检验。P<0.05为差异有统计学意义。
结 果
1 荧光显微镜观察转染效率
FAM-siNC转染6 h后,于荧光显微镜下观察发现,转染比例100 pmol∶5 μL组发出绿色荧光的细胞约占观察视野下细胞总数的90%以上,且细胞生长状态良好,见图1。
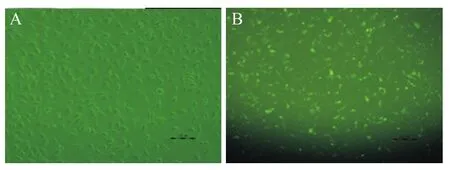
Figure 1.The transfection efficiency(6 h after FAM-siNC transfection)observed under fluorescence inverted microscope(scale bar=100 μm).A:bright field image;B:fluorescence field image.After transfection,the cells grew well with normal shape,and 90 percentage of the cells were stained.图1 FAM-siNC转染6 h后观察转染效果
2 RT-qPCR筛选干扰片段
RT-qPCR结果显示,UT组、siNC组和siNLRC3-2组NLRC3 mRNA的表达水平无显著差异(P>0.05);siNLRC3-1组NLRC3 mRNA的表达水平显著低于 UT组(P<0.05);与UT组比较,siNLRC3-3组NLRC3 mRNA 的表达水平显著降低(P<0.01),见图2。

Figure 2.Comparison of the interference effects of the 3 interference segments.Mean±SD.n=3.*P<0.05,**P<0.01 vs UT group.图2 3个干扰片段干扰效果的比较
3 MTT法检测敲减NLRC3对BEAS-2B细胞活力的影响
MTT法检测3个干扰片段转染后各组细胞的活力,进一步验证干扰片段的干扰效果。结果显示,与UT组相比,siNC组和siNLRC3-2组细胞活力无显著差异(P>0.05);siNLRC3-1组和siNLRC3-3组细胞活力与UT组相比显著增强(P<0.05),见图3。结合RT-qPCR筛选结果和MTT结果,我们认为siNLRC3-3片段具有较好的干扰效果,可用于后续实验。

Figure 3.The effect of NLRC3 knock-down on viability of BEAS-2B cells.Mean±SD.n=3.*P<0.05 vs UT group.图3 敲减NLRC3基因对BEAS-2B细胞活力的影响
4 敲减NLRC3对BEAS-2B细胞线粒体膜电位的影响
采用JC-1荧光探针和流式细胞术检测线粒体膜电位,R2门代表正常细胞,R3门代表凋亡细胞,R2/R3比值增加表示线粒体膜电位升高,早期细胞凋亡减少。结果显示,siNLRC3-3组的R2/R3与UT组和siNC组相比显著增加(P<0.05),见图4及表1。
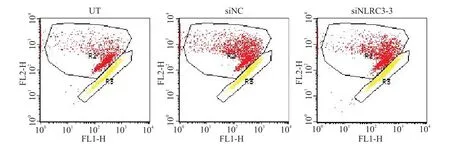
Figure 4.The mitochondrial membrane potential detected by flow cytometry with JC-1 staining.图4 JC-1和流式细胞术检测线粒体膜电位

表1 线粒体膜电位变化的比较Table 1.Comparison ofmitochondrialmembrane potential changes(n=3)
5 敲减NLRC3对BEAS-2B细胞凋亡的影响
采用annexin V/PI染色和流式细胞术检测检测细胞凋亡,结果显示,siNLRC3-3组凋亡率与UT组和siNC组相比显著下降(P<0.05),而siNC组和UT组的细胞凋亡率相比无显著差异(P>0.05),见图5。
6 Western blot检测敲减NLRC3对Bcl-2和Bax蛋白表达的影响
Western blot结果显示,与UT组和siNC组相比,siNLRC3-3组中Bcl-2蛋白表达水平显著上调,而Bax蛋白表达水平显著下调(P<0.01),见图6。

Figure 5.The effect of NLRC3 knock-down on apoptosis of BEAS-2B cells.Mean±SD.n=3.*P<0.05 vs UT group.图5 敲减NLRC3对BEAS-2B细胞凋亡的影响

Figure 6.The effect of NLRC3 knock-down on the protein expression levels of Bcl-2 and Bax.Mean±SD.n=3.#P<0.01 vs UT group.图6 敲减NLRC3对Bcl-2和Bax蛋白表达水平的影响
讨 论
NLRC3又称NOD3、CLR16.2,属于NLRs家族成员[6-8],在结直肠癌和肝细胞癌组织中显著低表达[9-10]。已有研究表明,NLRC3在调节免疫、抗炎、调节细胞增殖和凋亡等病理生理过程中起重要作用[7,11-14]。
本研究探索了NLRC3在肺癌发生中的作用。MTT检测结果表明,敲减NLRC3后BEAS-2B细胞活力显著增强,与Ma等[10]和Zha等[14]所观察到的低表达NLRC3对细胞增殖影响的结果相一致。肿瘤的特征之一是增殖能力增强[15-16],因此我们推测NLRC3低表达可能是导致肺癌发生的一个关键因素。同时细胞凋亡检测结果表明,NLRC3低表达后线粒体膜电位显著升高,晚期凋亡细胞数减少。线粒体跨膜电位下降是内源性细胞凋亡级联反应过程中最早发生的事件[17-18]。脂质荧光探针JC-1是一种广泛用于检测线粒体膜电位的理想荧光探针。JC-1在线粒体膜电位较高时为聚合物,产生红色荧光;在膜电位较低时为单体,产生绿色荧光[19-20]。通过JC-1荧光颜色的转变很容易地检测到线粒体膜电位的变化。根据本实验结果结合既往研究推测NLRC3可通过内源性线粒体凋亡途径调节BEAS-2B细胞凋亡/增殖平衡,当NLRC3低表达后其在细胞凋亡信号网络中的调节作用减弱,最终导致凋亡/增殖失衡。既往研究表明,NLRC3在调节细胞生长、增殖、分化、凋亡等生理过程中起一定的作用,我们观察到在BEAS-2B细胞中敲减NLRC3可导致细胞活力、凋亡等细胞生物学行为发生改变,提示NLRC3低表达可能在肺癌起始过程中发挥作用,但相关机制仍需进一步研究。
基因表达异常引起肿瘤发生往往涉及到凋亡相关蛋白Bcl-2和Bax的表达改变,因此我们进一步在蛋白分子水平探索NLRC3低表达后引起凋亡/增殖失衡的机制,Western blot结果显示,敲减NLRC3后Bcl-2蛋白表达上调,而Bax蛋白表达下调。Rezaei等[21]的研究显示,抑制Bcl-2蛋白表达并过表达Bax蛋白,上调Bax/Bcl-2比例,能够诱导HepG2和L929细胞凋亡。Bcl-2蛋白家族是线粒体膜蛋白,其中Bcl-2蛋白是重要的抗调亡蛋白[22],而Bax蛋白是重要的促凋亡蛋白[23],Bcl-2/Bax被认为是启动细胞凋亡的分子开关[24-26],参与内源性线粒体凋亡信号通路的调控。内源性线粒体凋亡信号通路活化可引起线粒体因子(如细胞色素C)释放,细胞色素C与凋亡蛋白酶激活因子1(apoptotic protease-activating factor 1,APAF-1)、caspases-9形成凋亡小体并被活化,最终启动细胞凋亡,参与并维持细胞凋亡与增殖平衡。由此可推测,Bcl-2和Bax蛋白可能是NLRC3的调节靶点,影响凋亡相关因子Bcl-2和Bax的表达可能是低表达NLRC3影响BEAS-2B细胞生长、增殖、凋亡等细胞生物学行为的方式之一。
本研究表明,敲减NLRC3表达能够对Bcl-2和Bax蛋白的表达水平产生影响,但我们仍然不清楚NLRC3是通过直接还是间接的作用方式影响Bcl-2和Bax蛋白表达及与它们相互作用的方式。此外,由于信号网络的复杂性,其中所涉及的作用机制及信号通路也不清楚。
综上所述,本研究证实了敲减NLRC3表达可抑制BEAS-2B细胞凋亡,增强细胞活力。本研究揭示了NLRC3低表达可能是引起肺癌发生的一个关键因素,同时也提示NLRC3低表达可能是肺癌的潜在肿瘤标志物和潜在治疗靶点。但由于实验的局限性,探索还不够十分深入和广泛,需要后期从蛋白质组学、动物体内实验和临床水平实验进一步探索。
