Beckwith⁃Wiedemann综合征患者的麻醉管理:病例汇报与文献复习
2020-07-04杨淑婷彭玉璇杜素娟叶西就
杨淑婷,彭玉璇,杜素娟,叶西就
Beckwith⁃Wiedemann综合征(Beckwith⁃Wiede⁃mann syndrome,BWS),即突脐⁃巨舌⁃巨体综合征(exomphalos⁃macroglossia⁃gigantism syndrome),亦称EMG综合征、WiedemannⅡ型综合征、Wilm瘤和半身肥大综合征、Beckwith综合征、新生儿低血糖巨内脏巨舌小头综合征(neonatal hypoglycemia visceromegaly macroglossia microcephaly syndrome)等。该综合征是一种少见的先天畸形,1963年由Beckwith首次描述,1964年Wiedemann对其进行补充[1-3]。主要特征为脐膨出、巨舌和巨体,还可伴有其他畸形和异常,如低血糖、内脏肥大、半身肥大、小头、脐部异常、面部红斑痣、隐睾、阴蒂肥大、心脏畸形、巨肾、巨输尿管、巨眼球等。巨舌是该综合征容易观察到的体征,而围手术期麻醉管理常因气道解剖异常变得复杂[1-6]。低血糖也对麻醉管理提出挑战。本文汇报1例行腹股沟疝和脐膨出修补术的BWS患者病例,并通过文献复习探讨该罕见综合征的麻醉管理。
1 病例介绍
1.1 一般资料
患儿,男性,11月龄,身长76.5 cm,体重10.05 kg。主诉为“发现右腹股沟可复性肿物、脐部突出11月”。诊断为:①右侧腹股沟疝;②脐疝;③巨舌;④左手背血管瘤,拟行“右侧腹股沟疝和脐疝修补术”。患儿病史如下:早产儿,出生时无窒息、抢救、吸氧史。无家族遗传病史。喂养困难,无明显睡眠呼吸暂停表现,无低血糖病史,无抽搐病史。体格检查:心脏听诊和肺听诊正常。入院后辅助检查:葡萄糖4.1 mmol/L,碱性磷酸酶201 U/L,肌酐36 μmol/L,白细胞计数17.83×109/L,血小板计数560×109/L。心电图诊断为窦性心律,不完全性右束支阻滞,T波改变(Ⅱ低平,ⅢaVF V1⁃V5倒置)。胸部正位X片未见明确异常。患儿临床表现图1~3所示。术前并未诊断为“Beckwith⁃Wiede⁃mann综合征”。
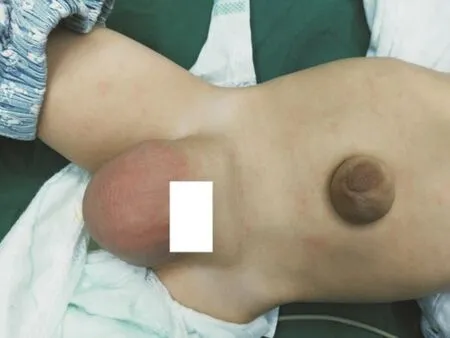
图1 腹股沟疝,脐疝
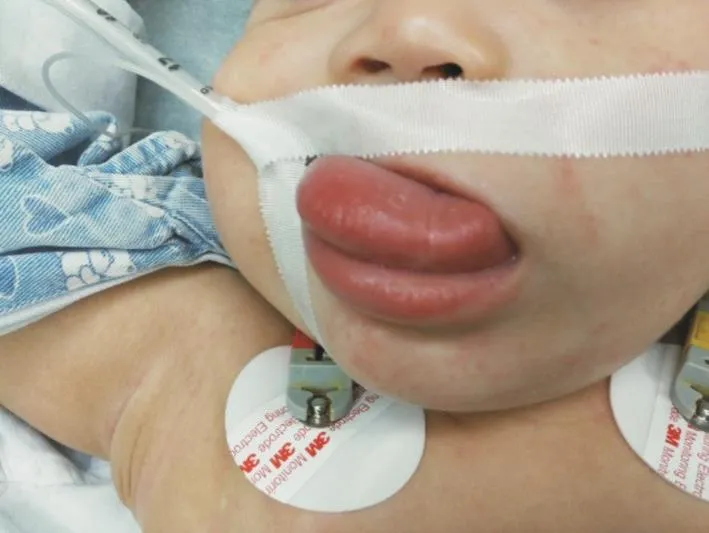
图2 巨舌
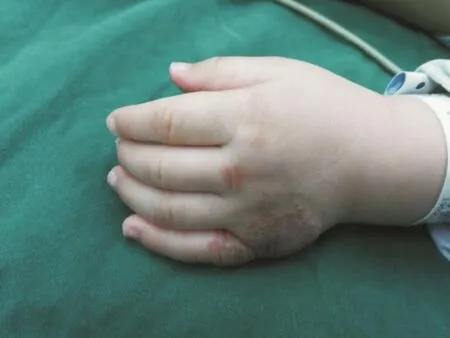
图3 左手背血管瘤
1.2 麻醉管理
1.2.1 麻醉诱导 患儿哭闹严重,抵抗面罩,已建立静脉通道,故采用静脉通道进行麻醉诱导。静脉推注丙泊酚20 mg,入睡后,完善心电图、脉搏氧饱和度、无创血压监测,确定无面罩通气困难后,继续给予丙泊酚30 mg,顺式阿曲库铵1.5 mg,肌肉松弛后,出现上呼吸道梗阻,单手手控通气困难,改为双手机械通气,通气改善,待麻醉深度达到插管要求后,轻柔置入2号可视喉镜,声门暴露良好,Cormack⁃Lehane分级I级,顺利插入4.0#带套囊的气管导管,未见黏膜组织等损伤。听诊双肺呼吸音清晰对称,固定导管后行机械通气。
1.2.2 麻醉维持 七氟烷⁃瑞芬太尼静吸复合全麻维持。压力控制通气模式,通过调整气道压和呼吸频率,将呼气末二氧化碳分压维持在35~45 mmHg,术中气道压范围为 11~16 mmHg,呼吸频率变化于15~18次/分,根据手术需要调整麻醉深度,术中七氟烷浓度为0.9~1.4 MAC,瑞芬太尼0.01~0.23μg/(kg·min)。
1.2.3 麻醉苏醒 手术历时1小时25分。较深麻醉下充分吸引口腔分泌物后,待患儿恢复自主呼吸,潮气量稳定在正常范围,呼吸频率稳定,出现吞咽动作时拔管。拔管顺利,拔管后清醒哭闹,氧饱和度不下降,送回病房。无麻醉不良事件发生。
1.3 术后随访
患儿术后第1天,第2天随访无明显特殊。术后第7天出院。出院诊断为:①双侧腹股沟疝修补术后;②脐膨出修补术后;③Beckwith⁃Wiede⁃mann综合征。
2 讨论
2.1 BWS的病因、临床表现、常见手术和预后
BWS是一种过度发育和有肿瘤倾向性的综合征,表型变异性很强,为印迹基因11p15.5区域的遗传或表观遗传改变所致[7,8]。通常在新生儿或婴幼儿时期即可诊断,预估患病率为1∶10,000~26,000[9,10]。患病率与性别和种族无关。生育辅助技术可使BWS患病率增加5~10倍[11,12]。
BWS的主要症状为产前及产后过度发育、巨舌、脐膨出、巨体,还可伴有其他畸形和异常,如新生儿低血糖、内脏肥大、心脏畸形、胚胎源性肿瘤、肾上腺皮质癌等[13]。巨舌是该综合征最常见的体征,可见于90%因巨体确诊的病例。50%的病例合并新生儿低血糖[14]。
BWS的预后主要取决于新生儿期并发症和肿瘤风险。新生儿期病死率主要与该时期并发症相关,如低血糖,巨大脐膨出,或巨舌引起的呼吸道梗阻[15]。婴儿和8岁以下儿童肿瘤风险最高,而成年患者肿瘤风险似乎没有增高。8%的BWS儿童合并有胚胎性肿瘤,如肾母细胞瘤、神经母细胞瘤、肝母细胞瘤[16,17]。其中,肾母细胞瘤占50%,肝母细胞瘤占15%,神经母细胞瘤占10%,横纹肌瘤占5%,肾上腺皮质癌占5%[18]。因此,BWS确诊后应常规行腹部B超检查,每三个月一次,至少到7周岁[16]。合并肿瘤者的肿瘤治疗方式及预后与其他儿童相同。儿童期肿瘤治疗效果比成年期好,合并胚胎性肿瘤者存活率高达90%,合并肾上腺皮质癌者则为 70%[19,20]。
因此,BSW患者手术治疗主要有:①新生儿期,通常在出生后一周内,因脐膨出行脐膨出闭合术,减少肠麻痹、腹膜炎等腹腔感染及对呼吸循环的影响;②婴儿期,因巨舌行缩舌术,以改善喂食、发音形成和颌面部发育、减少呼吸道并发症等。缩舌术通常在3岁以内完成;③婴儿期、儿童期因合并肿瘤行肿瘤切除术。困难气道、低血糖是BWS患者麻醉管理所面临的主要问题。
2.2 BWS麻醉管理
2.2.1 气道评估及管理 舌头大小的绝对或相对增加可使舌后气道变窄,易导致上呼吸道梗阻。巨舌作为BWS的常见体征,故术前应充分评估该类患者的气道情况。目前可通过多种检查评估舌头大小、舌头与气道的关系以及上呼吸道梗阻的部位。例如,颈部侧位X线检查、MRI、CT等[21]。超声测量舌体积和皮肤到舌背面的距离也可评估是否困难气道[22]。最佳方法是镇静下直接喉镜或纤维支气管镜检查,明确舌头在气道中的位置和会厌暴露程度。
麻醉诱导前充分准备在通气困难、插管困难病例中尤为重要。应预先准备的物品有不同型号面罩及气管导管,导丝,鼻/口咽通气道,喉罩,纤维支气管镜和气管切开包,并确保物品随手可得。气管导管类型及内径大小的选择:首选有气囊气管导管。由于巨体,气管内径可能大于根据身高、体重推算公式得出的型号。若使用无气囊气管导管可能会严重漏气,而不得不更换型号,这将极大增加气道风险。可根据Motoyama公式[23]:ID=(年龄/4)+3.5或Khine公式[24]:ID=(年龄/4)+3选择气管导管内径大小。有条件的情况下,可预先在超声下测量声门下气管横径进行选择[25]。
麻醉诱导:术前使用抗胆碱类药物,以减少口咽分泌物和喉痉挛发生、改善气道喷洒利多卡因的表面麻醉效果。不宜镇静过度,必要时在监测血氧饱和度下使用小剂量抗焦虑药物。对于上呼吸道梗阻严重者,可选择保留自主呼吸的吸入麻醉慢诱导,插管前利多卡因表面麻醉可能更为安全[26]。确保麻醉足够深度后置入喉镜,若如能看到声门可直接插管或快诱导插管。若显露困难,可使用备用特殊插管工具。如可视喉镜,通常能良好暴露会厌、声门,安全有效[27]。但近期研究表明不使用肌松药容易发生插管困难,直接喉镜下易引发喉痉挛[28],故建议辅助其他静脉药物完成。与吸入麻醉诱导比较,在已建立静脉通道的哭闹严重/抵抗面罩的患儿采用静脉诱导也有明显优势。在可预测的困难气道患者中,清醒气管插管是较为常见的困难气道处理方法,需要患者的良好配合,但小儿往往不能配合气道管理相关人员进行清醒插管,故清醒插管不适用于小儿患者[29]。在困难气道处理中,喉罩因可快速开放气道、改善缺氧、减少血流动力学波动及气道损伤,已成为小儿困难气道管理的有效工具[30]。若无禁忌证,行短小手术时可也优先考虑喉罩。计划经鼻气管插管时,插管前充分润滑气管导管、表面麻醉,局部使用血管收缩药物。合并疝气及肠梗阻患者禁用笑气,防止肠腔进一步的扩张。新生儿还应考虑气栓风险[4]。本例患儿在麻醉诱导肌肉松弛后,出现因巨舌导致上呼吸道梗阻,导致单手手控呼吸困难,改为双手机械通气后,通气良好。插管前应充分准备好插管所需物品。本病例麻醉诱导前,拟使用的可视喉镜镜片、气管导管、导丝和鼻咽通气道均通过石蜡油充分润滑,以减少插管时物品与组织间摩擦力,充分暴露气道,一次在最短时间内完成气管插管,减少或避免组织损伤或其他并发症。
与麻醉诱导相比,困难气道患者拔管和苏醒期更易发生气道管理并发症所致的严重不良后果。无困难气道者,拔管指征与常规者相同。有困难气道及行缩舌术者,应根据患者气道功能和舌水肿严重程度而选择拔管时机。有条件者可通过超声在环甲膜上观察喉头横断面,测量松开气管导管套囊后的气柱宽度加以预测是否能成功拔管。一般来说,缩舌术后舌头肿胀,很可能导致严重气道梗阻,需要术后继续机械通气观察[31]。多数缩舌术后病例能在术毕或术后24小时内拔管。拔管期应准备鼻/口咽通气道、喉罩。拔管前可先置入柔软的鼻咽通气道。应在充分吸引分泌物、完全清醒后进行,并应具有高级气道管理技能者在场,以便随时重新气管插管。拔管后可能会出现气管软化的情况。拔管后,如面罩通气和置入口咽通后仍旧出现难治性的低氧血症,应该考虑气管软化的可能[5]。若术毕拔管尝试失败,常需延迟拔管。
2.2.2 血糖管理 BWS低血糖主要由高胰岛素症引起,即使血糖浓度很低,胰岛素仍会高于正常水平。低血糖定义为,有低血糖症状和/或血糖低于2.6 mmol/L。低于1.5 mmol/L或低至无法测出为严重低血糖。据统计,BWS低血糖发生率占33%~50%,在出生后几小时内即可出现,持续时间长,较难矫正,可反复发作,严重者出现抽搐、意识丧失,甚至影响智力发育等。在出生后1个月内发作最为频繁,以后逐渐减少,一般在3~4个月后可逐渐停止,但也可持续至2~3岁,也有不出现低血糖发作者。低血氧发作有时用高糖疗法或者药物都无法纠正,甚至需要部分切除胰腺。因此,合并低血糖症状的患儿,应尽量缩短术前禁饮禁食时间,禁饮禁食期间可适当静脉补充葡萄糖,防止术前低血糖发生。围术期除了心电图、心率、血氧饱和度、血压、体温等监测外,应常规严密动态监测血糖。本例患儿无低血糖病史、无抽搐病史,术前血糖正常,故术中未监测血糖。合并低血糖的BWS患者应根据低血糖严重程度以及手术预计时间选择指尖血糖或静/动脉血进行血气分析。麻醉诱导前进行基础血糖测定。监测频率根据个体治疗差异及风险程度而定。一旦发现低血糖,应立即静脉输注葡萄糖,起始量为10%葡萄糖2 mL/kg,以1 mL/min输注泵静脉泵注,后以6~8 mg/(kg·min)静脉泵注维持,每5~15分钟检测一次直至血糖正常,稳定后可每小时复测一次[32]。术中实时监测血糖,及时识别并处理低血糖,可以有效避免低血糖发生以及随之引起的神经系统后遗症。
3 结论
困难气道、低血糖等是BWS患者麻醉管理所面临的主要问题。麻醉医师应充分评估病情从而制定适当的麻醉管理方案。
