一株纤维素降解菌的筛选、鉴定及对饲料粗纤维降解效果的研究
2020-07-04李鹏飞鲁琼芬王后福杨仁辉
李鹏飞 廖 奇 陶 杨 鲁琼芬, 王后福 杨仁辉 冷 静,*
(1.云南农业大学云南省动物营养与饲料重点实验室,云南昆明650201;2.云南农业大学动物科学技术学院,云南昆明650201)
纤维素作为光合作用的主要产物,是自然界中非常普遍和丰富的可再生自然资源[1]。纤维素约占地球总生物量的40%,其中89%左右的纤维素资源未能被开发利用,存在资源的大量搁浅及能源的浪费。通过化学、物理或者生物技术将纤维素分解成小分子物质,被认为是解决当前食品短缺、能源危机、环境污染和生态平衡等问题的有效方法[2]。粗饲料中纤维素含量极高,超过其他碳水化合物含量的总和[3]。但动物消化道自身不含内源纤维素酶,无法直接利用纤维素。研究发现食草反刍动物消化道内共生的细菌、真菌等微生物能够分泌纤维素酶,可帮助分解纤维素为动物提供能量[4]。纤维素酶能够高效与纤维素分子结合,破坏纤维素分子内部的化学键,将纤维素分子分解成可被动物利用的小分子糖类物质。并且在酶促反应过程中,不会产生毒害物质以及造成环境污染。微生物纤维素酶可能会是解决纤维素资源利用问题最环保的好办法。将适量的纤维素酶制剂添加到畜禽饲料当中,植物细胞壁被降解后,可使粗饲料中大量营养物质得到充分释放,能够有效改善饲料营养价值,便于动物对其进行消化和吸收。纤维素酶制剂对提高畜牧业的经济效益、控制饲料成本等均具有积极作用[5]。国内在筛选纤维素降解菌方面做了大量研究,但降解效率并不理想[6]。本文主要针对纤维素降解菌的筛选、分离、鉴定和对饲料纤维降解特性进行研究。通过筛选出高活力的纤维素降解菌为纤维素酶制剂的开发和畜牧业的可持续发展提供理论基础。
1 材料与方法
1.1 材料
1.1.1 样品采集
于云南农业大学实验羊场采集新鲜的成年绵羊(云南萨福克羊×乌骨绵羊,♂,采食黑麦草青贮料、玉米秸秆青贮料、精料)粪便,于4 ℃冰箱保存。
1.1.2 主要仪器
显微镜(奥林巴斯);紫外可见光分光光度计(上海菁华仪器公司);高速冷冻离心机(美国Sigma 公司);恒温培养箱(江苏常州国华有限公司);水浴恒温摇床(江苏常州国华有限公司);高压蒸汽灭菌锅(江苏常州国华有限公司);超净工作台(苏州净化设备有限公司);PCR扩增仪(美国Sigma公司);电泳仪(美国BIO-RAD公司)。
1.1.3 主要试剂基因组提取试剂盒DNeasy Blood Tissue Kit,购自美国Qiagen公司;生化材料,购自大连宝生物公司;柠檬酸铁、七水硫酸亚铁、pNP、pNPG、水杨苷、3,5-二硝基水杨酸、七叶苷、异硫氰酸胍等,购自昆明谋好品科生物有限公司;胰蛋白胨、酵母提取物等,购自云科生物技术有限公司。
1.1.4 培养基
培养基的配制参考梁艳琳[7]和董恒[8]方法。
1.2 试验方法
1.2.1 菌株的富集与初筛
取新鲜的羊粪便样品富集培养后,选取对羧甲基纤维素钠培养基降解效果最好的菌株作为研究对象[9]。
1.2.2 纤维素降解菌的复筛
将经过初筛后获得的菌株接种于CMC-Na 液体复筛发酵培养基中,37 ℃、225 r∕min 摇床培养4 d,测定CMC 酶活力与FPA 酶活力,以酶活力为指标筛选目的菌株。参照Senegani等[10]研究方法绘制葡萄糖标准曲线。参照Christakopoulos P[11]研究方法绘制pNP标准曲线。
纤维素酶活力的测定:运用DNS 分光光度法测定纤维素酶活力,实验原理及操作步骤参考有关资料[12-14]。β-葡萄糖苷酶活力可用比色法测定[11],酶活力定义为1 ml 原酶液每分钟催化底物产生相当于1 μg对硝基苯酚所需的酶量为一个酶活力单位(U∕ml)。
1.2.3 菌株对饲料粗纤维的降解
分别加入3 g过200目筛的黑麦草、麸皮、玉米皮和米糠于4 个装有100 ml 的LB 培养液的锥形瓶中,按照2%的比例接种培养液。每种底物设2个重复和一个未加菌液的空白对照,于37 ℃、220 r∕min分别培养36 h 后,取2 ml 发酵液在4 ℃、8 000 r∕min 离心10 min制备粗酶液,并测其酶活力。然后将残渣全部转入已恒重的200 目的尼龙袋,参照胡艳平等[15]尼龙袋粗纤维测定方法检测粗纤维的含量。
1.2.4 菌株种属的鉴定
形态学鉴定:观察其菌落与菌体形态,并进行革兰氏染色镜检。
分子学鉴定:①基因组提取和16S rDNA基因扩增基因组DNA提取参照李亚丹[16]、包蕾[17]和Yu等[18]的方法提取[16-18]。利用引物P1-F:5’-AGAGTTTGATCCTGGCTC-3’和P1-R:5’-TACGGCTACCTTGTTACGAC-3’,对菌株进行16S rDNA基因序列的扩增[19]。电泳检测扩增产物大小与预期结果相符后,将扩增产物纯化后送至上海铂尚生物技术有限公司测序。②16S rDNA序列分析与系统进化树构建。将菌株的16S rDNA序列在NCBI 中进行Blast 序列比对与同源性分析,选出与该序列相似性较高的核酸序列用于系统进化树构建。从而得到相关菌株16S rDNA 序列,用Mega 5.0软件程序中的Neighbor-Joining法进行聚类分析和构建系统进化树[20],确定该菌株的系统发育学地位。
2 结果与分析
2.1 产纤维素酶菌株的筛选
从新鲜的羊粪便样品中反复筛选分离得到36株菌落,其中25 株能够在羧甲基纤维素钠功能筛选培养基形成清晰的透明圈,根据菌株透明圈与菌株直径比(H∕C)的大小,挑选H∕C 较大的10 株菌落,初步确定此菌株能够产生纤维素酶,将这10 株菌落分别命名为B1、B2、B3、B4、B5、B6、B7、B8、B9、B10;进一步将所筛选到的10株菌株点种在底物为七叶苷的β-葡萄糖苷酶功能筛选培养基平板上,根据菌株黑色圈与菌株直径比(D∕C),挑选D∕C 较大的6 株菌落,分别为B2、B3、B4、B5、B8、B10,初步确定此菌株能够分泌β-葡萄糖苷酶。
根据羧甲基纤维素钠功能筛选培养基H∕C 的大小(表1),挑选出6 个黑色圈与菌株直径比(D∕C)较大的菌株B2、B3、B4、B5、B8、B10 作为后续复筛的目的菌(表2),接种到液体发酵培养基中摇床培养后,分别测定纤维素酶活力,依据复筛的结果,筛选出β-葡萄糖苷酶活力最高的菌株B5 作为后续研究对象。

表1 不同细菌在CMC-Na和七叶苷鉴别培养基上的透明圈∕菌落直径比值

表2 纤维素酶产生菌复筛结果(U∕ml)
2.2 B5菌株对粗纤维饲料降解
提取分别添加有黑麦草、麸皮、玉米皮和米糠发酵培养36 h后的粗酶液,按照DNS分光光度法测定纤维素酶活力以及饲料粗纤维降解率。结果显示,在添加麸皮和黑麦草的培养基中纤维素酶活力较高,分别为1 466 U∕ml 和1 293 U∕ml,对粗纤维降解率分别为34.13%和29.06%,在添加米糠和玉米皮的培养基中纤维素酶活力较低,分别为323 U∕ml 和450 U∕ml,粗纤维降解率为5.78%和7.64%(表3)。相关性分析显示,饲料粗纤维的含量与粗纤维降解率、酶活力的相关系数分别为0.53和0.546,双侧显著性概率值分别为0.47和0.454,在相关系数0.01的水平上没有显著的相关性,酶活力与粗纤维降解率的相关系数为0.999,双侧显著性概率为0.001,双星号标记表明0.999的相关系数在0.01的水平上达到极显著,说明二者相关性很强,并且呈正相关(表4),验证了图1直观结果。
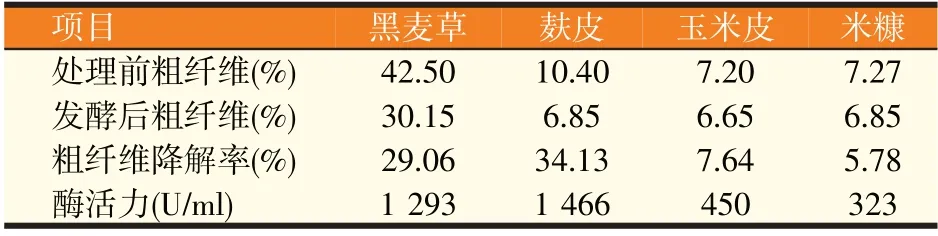
表3 菌株产酶及对饲料粗纤维降解率的影响
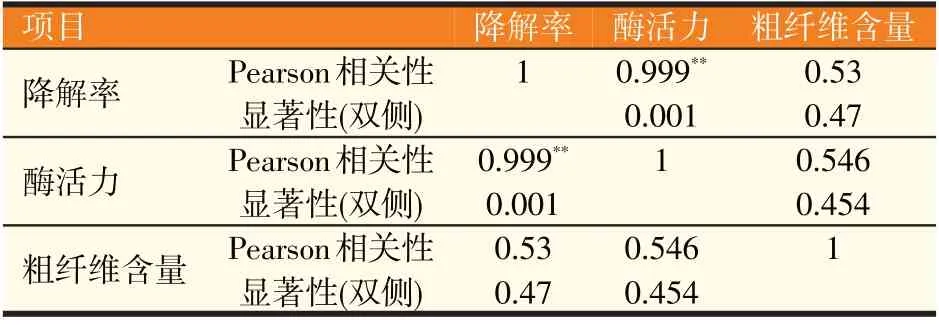
表4 饲料粗纤维含量、粗纤维降解率和酶活力相互之间的影响
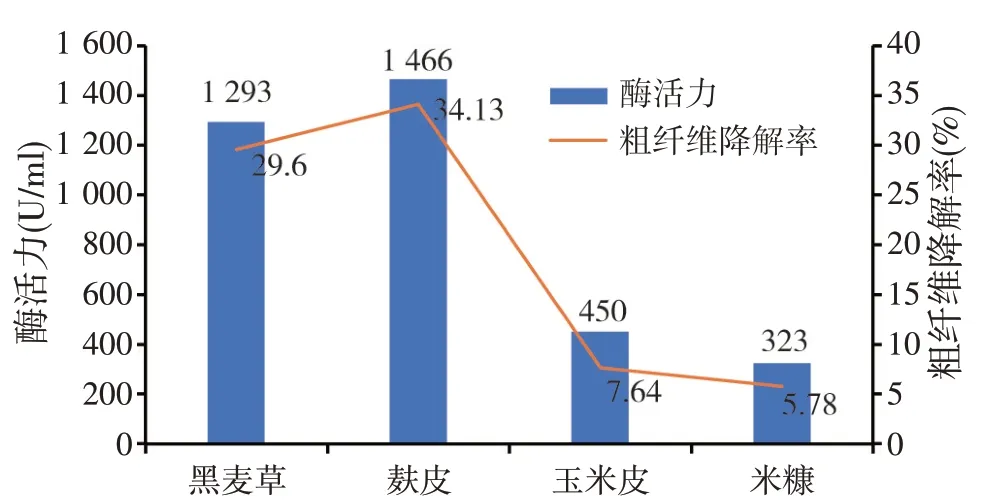
图1 菌株产酶及对饲料粗纤维降解率的影响
2.3 菌株形态学鉴定
菌株B5 在LB 平板上37 ℃培养12 h 后,革兰氏染色呈蓝色,为革兰氏阳性菌,气生菌丝与营养菌丝分明,并且可以观察到个别孢子(图2a),其菌落为不规则圆形,菌落中央微凸、菌落有丝状的纹理、正面白色、干燥、不透明、难以挑取(图2b)。随着培养时间的延长,形成表面为粉末状或颗粒状的典型放线菌菌落,反面呈现暗灰色(图2c、2d),初步鉴定为放线菌。
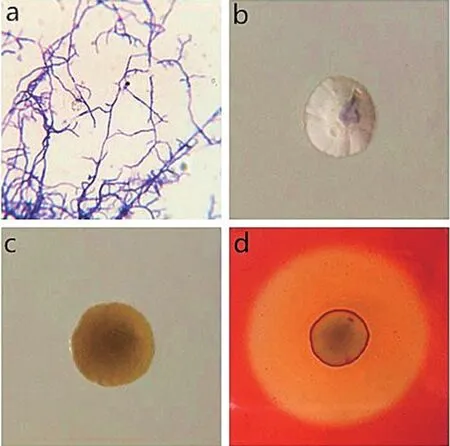
图2 革兰氏染色结果
2.4 B5菌株基因组DNA提取
提取菌株B5 基因组DNA,电泳检测结果大于20 000 bp,基因组DNA片段为一条单带,不含有RNA及蛋白质,质量较好,可以满足PCR 对扩增模板的要求(图3)。
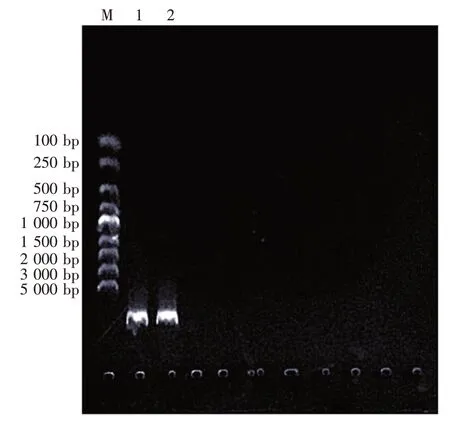
图3 菌株基因组DNA的琼脂糖凝胶电泳图
2.5 B5菌株16S rDNA PCR扩增
以B5菌株基因组DNA为模板,P1-F∕P1-R为引物进行PCR扩增,扩增产物进行电泳检测,结果显示PCR产物为一条单带,大约1 500 bp,与预期相符(图4)。
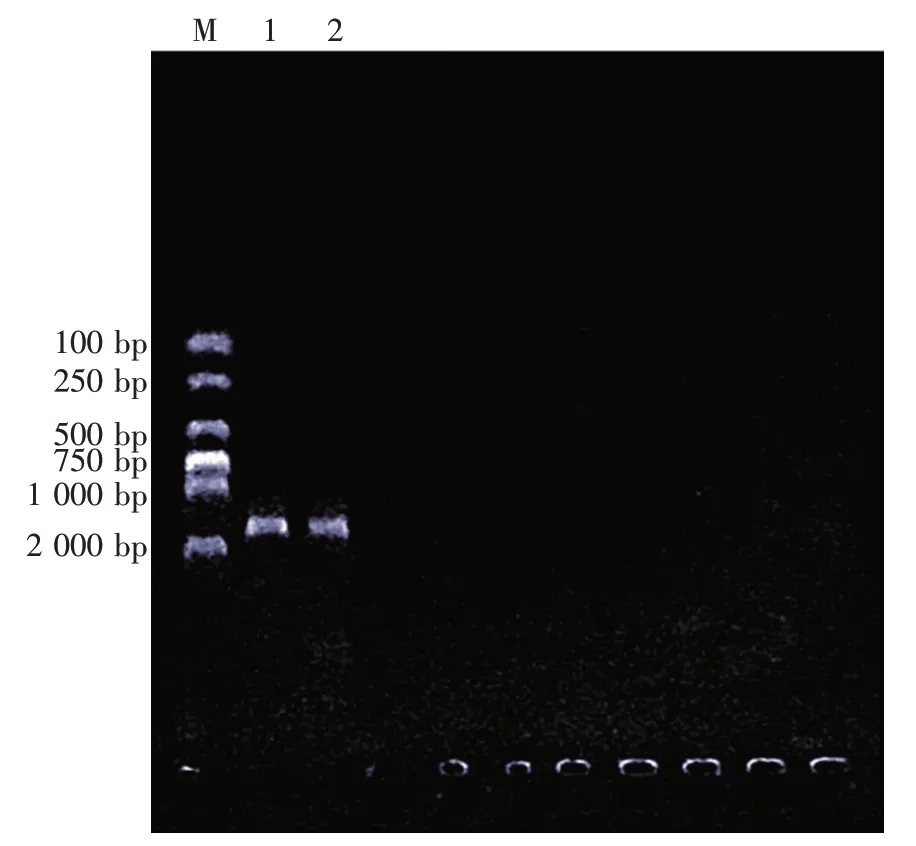
图4 16S rDNA PCR产物琼脂糖凝胶电泳图
2.6 B5菌株16S rDNA序列测定与分析
序列测序结果如图5,B5 菌株16S rDNA 序列全长1 585 bp。

图5 菌株B5的16S rDNA序列
将B5菌株序列提交NCBI进行Blast比对,结果显示B5 菌株与链霉菌属(Streptomyces sp.)同源性达99%(表5)。
2.7 系统发育树分析
利用Clustal X2.0 进行序列比对,在进化关系上B5菌株与链霉菌属(Streptomyces sp.)聚成一簇,同源性高达99%,初步鉴定B5 菌株属于放线菌中的链霉菌属成员(图6)。
3 讨论
3.1 产纤维素酶降解菌的筛选与鉴定
众所周知,在反刍动物瘤胃内栖息着数量庞大且种类复杂的微生物菌群,其参与瘤胃纤维的降解,使得反刍动物能够以富含纤维素的牧草为食。因此,反刍动物体内排出的粪便内存在某些高效纤维素降解菌。张庆芳等[21]从西藏黄牛瘤胃液中筛选得到一株高产纤维素酶的菌株,被鉴定为灿烂类芽孢杆菌。朱立涛等[22]研究发现,反刍动物依靠瘤胃微生物对粗纤维的消化率高达60%。然而未能在消化道内利用的粗纤维会以粪便的形式排出体外,这些难以利用的粗纤维最终会被微生物降解。赵方圆等[23]从羊的粪便中分离出了一株纤维素降解菌,经鉴定为Aspergillus sp. YN1。马雪姣等[24]通过刚果红功能筛选法从牛的粪便中筛选到了3株能够高效降解纤维素的细菌,继代培养后分离到一株能够稳定遗传的菌株。在本研究中,利用刚果红功能筛选法从绵羊粪便中筛选到B5菌株。B5菌株分泌的纤维素酶和β-葡萄糖苷酶活力最大,分别为720 U∕ml与670 U∕ml,H∕C与D∕C分别为4.9与2.8。结果表明,初筛所产生的透明圈与菌落的直径比(H∕C,D∕C)成正相关,与姜立春等[6]、胡艳平等[15]、包衍等[25]研究结果一致。形态学分析表明,B5 菌株的菌落为不规则圆形,正面白色、干燥、不透明、难以挑取,中央微凸,菌落有丝状的纹理,气生菌丝与营养菌丝分明,革兰氏阳性菌,因此,初步鉴定可能为放线菌。
在本研究中,B5 菌株16S rDNA 基因序列全长1 585 bp,与链霉菌属(Streptomyces sp.)同源性高达99%,初步鉴定B5 菌株属于放线菌中的链霉菌属。链霉菌属(Streptomyces sp.)作为自然环境中最丰富的放线菌,能够产生多种纤维素分解酶,是参与纤维素降解的重要菌属[26]。
3.2 菌株B5对不同饲料粗纤维降解率及酶活力分析
饲料的种类以及饲料中纤维素的种类可能是导致粗纤维降解率差异的原因。本实验研究了向LB培养基中添加黑麦草、麸皮、玉米皮和米糠对B5发酵产酶以及对粗纤维降解率的影响。在相同的发酵条件下,添加黑麦草和麸皮的培养基中粗纤维的降解率(29.06%和34.13%)明显高于玉米皮和米糠(7.64%和5.78%)。加入B5菌株的黑麦草与麸皮所得到的纤维素降解率与宋波等[27]、刘旭[28]的研究相似,他们在草食动物粪便与奶牛粪便中筛选到能够分泌高活性纤维素酶的链霉菌,对牛粪便和秸秆的粗纤维降解率分别为17.8%和31.4%。酶活力分析表明,粗纤维的降解率与酶活力呈正相关,在添加黑麦草和麸皮的情况下酶活力分别为1 293 U∕ml 和1 466 U∕ml,远高于玉米皮(450 U∕ml)和米糠(323 U∕ml)。与胡艳平等[15]研究相同,其使用菌株HY3 发酵处理麸皮、麦草秸秆和燕麦秸秆,60 h后麸皮的纤维素降解率为7.41%,显著高于麦草秸秆和燕麦秸秆。但是在相同的发酵时间下,本实验麸皮的纤维素降解率为34.13%,显著高于胡艳平的结果。Xiao等[29]研究发现,通过优化Neurospo
ra.crassa(粗壮脉纹胞菌)对茶粕的发酵条件,在74.9 h后,其粗纤维降解率高达48.65%。文少白等[30]利用无花果曲霉和康宁木霉对香蕉茎秆发酵处理发现,其产生的纤维素酶活力分别为699.8 U∕ml和332.02 U∕ml,粗纤维降解率分别为22.39%和20.89%。在本研究中,黑麦草的纤维素含量最高(42.50%),远高于麸皮(10.40%)、玉米皮(7.20%)和米糠(7.27%),其粗纤维降解率与麸皮接近,远高于玉米皮与米糠。以上研究表明,B5 菌株对饲料粗纤维降解效率与酶活力显著相关,与饲料中纤维素含量相关性不明显。
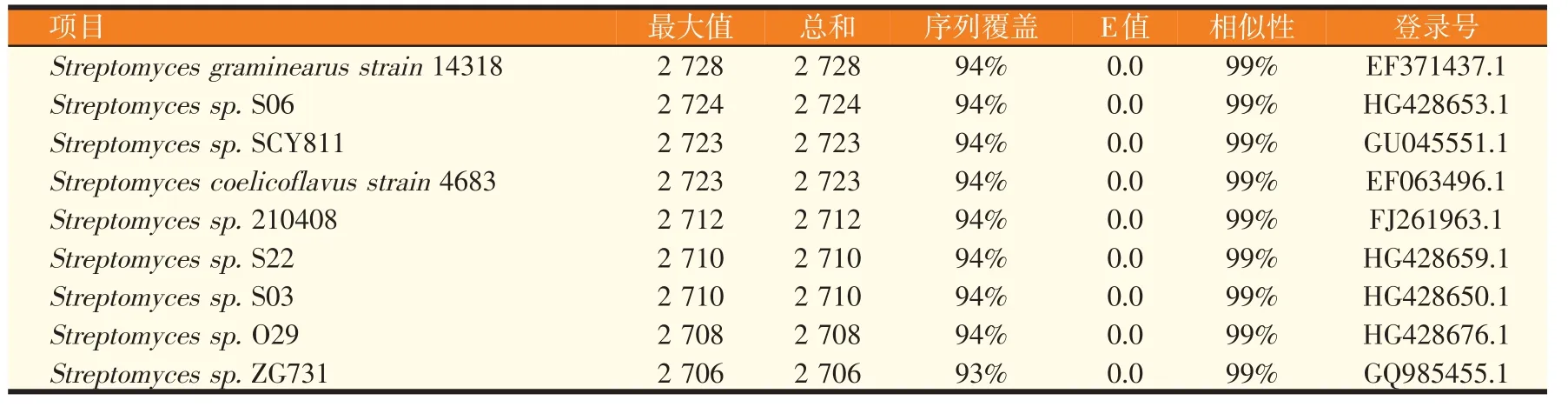
表5 B5菌株16S rDNA同源性比对
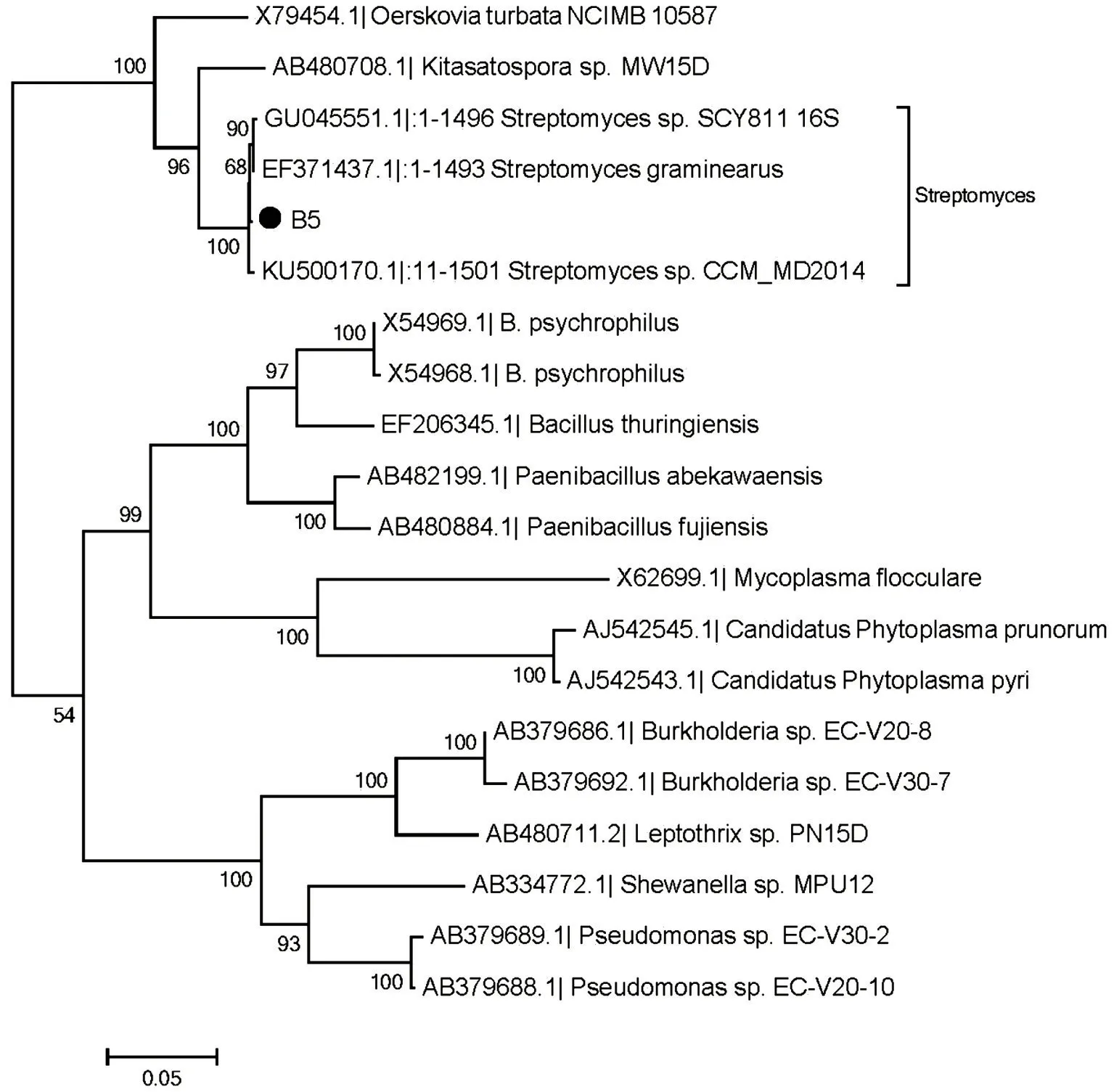
图6 B5系统发育树
4 结论
从绵羊粪便中筛选到25 株纤维素降解菌,并对其中产酶活力最高的一株细菌B5 进行了鉴定,结果显示B5菌株属于放线菌中的链霉菌属。B5菌株对饲料粗纤维的降解效率与其酶活力显著相关,与饲料中纤维素含量相关性不明显。
