miR-630对H2O2诱导的人晶状体上皮细胞的增殖、凋亡与氧化损伤的影响
2020-07-03陈婷妍美丽巴努玉素甫
周 洋 陈婷妍 美丽巴努·玉素甫
白内障(cataract)是一种常见的与年龄有关的疾病,其发生率持续上升[1]。由于其发病机制不清楚,因此白内障的非手术治疗仍然受到限制。晶状体上皮细胞是晶状体中唯一具有分裂活性的细胞,能够保持晶状体的渗透压、维持其内环境的稳定[2]。研究发现,与正常人晶状体上皮细胞凋亡率比较,白内障患者晶状体上皮细胞凋亡率明显增加。体外诱导损伤可以使晶状体上皮细胞凋亡,从而诱发晶状体皮质发生混浊,进而导致白内障的形成[3]。氧化损伤可能是白内障发生、发展的关键因素[4,5]。研究发现,与年龄相关的白内障患者的晶状体中活性氧含量(ROS)显著升高[6]。
H2O2是众多氧化损伤产物中最重要的物质。目前H2O2诱导的晶状体上皮细胞凋亡已成为白内障形成的细胞模型被广泛研究[7]。微小RNA(miRNA)是一类微小的非编码RNA,通过与其靶标miRNA的3′-非翻译区(3′-UTR)中的互补序列结合,miRNA可以诱导miRNA降解或翻译抑制[8]。研究表明,miRNA参与多种生理和病理过程[9]。比如,一些miRNA与年龄相关性白内障的发作有关,这表明miRNA可能成为白内障诊断和治疗的新靶点[10]。miR-211在年龄相关性白内障患者的晶状体中异常表达,可促进晶状体上皮细胞凋亡[11]。Wang等[12]研究表明,miR-630在白内障患者的晶状体中表达上调,但是目前 miR-630在白内障中的具体作用和机制还未见相关研究。因此,本研究使用H2O2刺激人晶状体上皮细胞,体外建立白内障形成模型,探究miR-630对人晶状体上皮细胞增殖、迁移和氧化损伤的影响,探讨其在白内障发病过程中可能的作用和机制,并为miR-630成为白内障靶向治疗提供实验依据。
材料与方法
1.材料:人晶状体上皮细胞系HLE-B3细胞购自中国科学院上海细胞生物学研究所;DMEM低糖培养基、胎牛血清和CCK-8试剂盒购自美国Gibco公司;H2O2购自美国Sigma公司;TRIzol试剂、cDNA反转录试剂盒和SYBR Premix EX TaqTM试剂盒购自日本TaKaRa公司;Annexin Ⅴ-FITC/PI试剂盒、EdU细胞增殖检测试剂盒和BCA试剂盒购自英国Abcam公司;阴性对照(miR-NC)、带荧光标签GFP的miR-630 inhibitor由Genepharma公司合成;LipofectamineTM3000购自美国Invitrogen公司;RIPA裂解液和ROS检测试剂盒购自上海碧云天有限公司;超氧化物歧化酶(SOD)试剂盒购自南京建成生物工程有限公司;兔抗Bcl-2抗体、兔抗Akt抗体、山羊抗兔IgG抗体购自美国Cell Signaling Technology公司。
2.细胞培养及分组:HLE-B3细胞用含10%胎牛血清的DMEM低糖培养基,置于37℃、5% CO2的培养箱中培养,2天更换一次培养基,以保证细胞所需的营养成分。将细胞分为4组:①对照组:不进行任何处理;②H2O2组:加入H2O2(300μmol/L)进行处理[7];③H2O2+阴性对照组(H2O2+miR-NC):转入阴性对照,并用H2O2(300μmol/L)进行处理;④H2O2+miR-630抑制剂组(H2O2+miR-630 inhibitor组):转入miR-630抑制剂,并加入H2O2(300μmol/L)进行处理。
3.细胞转染与H2O2处理:取处于对数生长期的HLE-B3细胞经消化后,接种到细胞培养皿中,待细胞生长融合至 60%~80%时,按照LipofectamineTM3000转染试剂说明书将100nmol/L的miR-NC、miR-630 inhibitor分别转入HLE-B3中。在37℃、5% CO2的培养箱中培养6h后,更换新鲜的培养基继续培养。48h后,加入H2O2(300μmol/L)培养24h,进行后续实验。
4.qRT-PCR:用TRIzol试剂提取各组细胞总RNA。用Nanodrop 2000仪器测量样品总RNA浓度,并将每个配对的样品调节至相同浓度。然后按照cDNA反转录试剂盒将总RNA反转录成cDNA。使用SYBR Premix EX TaqTM试剂盒进行qRT-PCR。使用FTC-3000p实时PCR系统完成实验后,采用2-△△Ct法分析数据。其中使用的引物详见表1。
5.细胞集落形成实验:将HLE-B3细胞按照1×106个/孔接种到6孔板中,待细胞融合至60%~80%,按照材料与方法3进行处理。培养72h后,收集各组细胞并接种到60mm的培养皿中。3天更换一次培养基。10天后用结晶紫染色,并计数含有≥50个细胞的集落,并进行拍照。
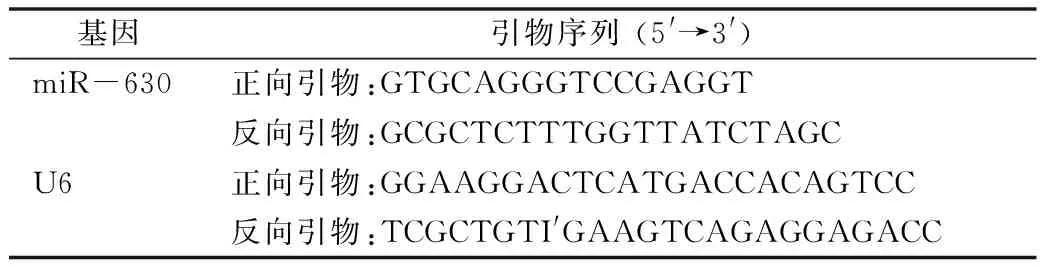
表1 引物序列
6. EdU实验:将HLE-B3细胞以1.6×105个细胞/孔的密度接种在96孔板中,待细胞融合至60%~80%,按照材料与方法3进行处理。培养72h后,随后,向每个孔中加入50mmol/L的5-乙炔基-2′-脱氧尿苷(EdU),并在37℃下孵育4h。然后将细胞在室温下用4%多聚甲醛固定15min,并在室温下用0.5% Triton X-100处理20min以进行透化。将细胞与100ml Apollo混合物在室温下孵育30min,用100ml Hoechst33342染色30min,并在荧光显微镜下成像。使用Image-Pro Plus软件6.0版来计算EdU阳性细胞(红色细胞)的数量。EdU掺入效率表示为HLE-B3阳性细胞(蓝色细胞)中EdU阳性细胞的比例。
7.细胞划痕愈合实验:HLE-B3细胞分别制成单细胞悬液,然后细胞按照1×105个/孔接种在6孔板中,置于37℃、5% CO2的培养箱中孵育。细胞生长融合至60%~80%时,按材料与方法3进行处理。待各组细胞长满后,用200μl无菌移液管在细胞单层做线性划痕,立即在荧光倒置显微镜下进行拍照,并在48h后观察迁移的距离。使用Image J软件测量各组细胞迁移的距离。
8.流式细胞术:收集转染并处理后的各组细胞,离心并重悬于缓冲液中。将细胞依次用异硫氰酸荧光素(Annexin Ⅴ-FITC)溶液(10μl)和碘化丙啶(PI)溶液(10μl)染色。将染色的细胞在室温下黑暗中孵育30min,然后使用FACSCaliburTM流式细胞仪进行分析。
9.ROS水平和SOD的含量测定:(1)ROS水平测定:用无血清的DMEM低糖培养基稀释DCFH-DA,使其终浓度为10μmol/L。用稀释好的DCFH-DA溶液重悬各组细胞,使细胞密度为1×106个/毫升,在37℃、5% CO2的培养箱中孵育20min。用无血清的DMEM低糖培养基洗涤细胞3次,然后使用荧光酶标仪检测荧光强度,激发波长和发射波长分别为488nm和525nm。(2)SOD含量测定:各组细胞按材料与方法3处理,72h后用移液枪吸出细胞上清液,并用预冷的PBS洗涤细胞2次,然后严格按照试剂盒说明书要求进行后续实验,最后用酶标仪在450 nm波长处测定吸光度值。
10.Western blot法:转染并处理后的各组细胞用RIPA裂解提取总蛋白,并通过BCA方法进行定量,样品经变性后进行上样。按照实验步骤进行电泳-转膜-封闭(5%脱脂奶粉)-一抗孵育[兔抗Bcl-2 抗体(1∶1000)、兔抗Akt抗体(1∶1000),4℃过夜]-二抗孵育[山羊抗兔IgG抗体(1∶2000),室温1h]-显影曝光。Image-Pro Plus图像分析系统对蛋白条带进行分析。

结 果
1.miR-630在HLE-B3细胞中的表达:在miR-NC及miR-630 inhibitor转染入HLE-B3细胞48h后,荧光检测结果显示转染了miR-630 inhibitor的HLE-B3细胞中可见携带GFP绿色荧光蛋白,表明转染成功(图1A)。各组细胞培养72h后,提取其总miRNA进行qRT-PCR验证,与对照组比较,H2O2组和H2O2+miR-NC组HLE-B3细胞中miR-630的表达水平上调(P均=0.000),H2O2+miR-630 inhibitor组HLE-B3细胞中的miR-630表达水平明显下调(P<0.01);与H2O2组和H2O2+miR-NC组比较,H2O2+miR-630 inhibitor组HLE-B3细胞中的miR-630表达水平明显下调(P均=0.000,图1B);H2O2组和H2O2+miR-NC组之间比较差异无统计学意义(P>0.05)。
2.miR-630对HLE-B3细胞形态的影响:与对照组比较,H2O2组和H2O2+miR-NC组HLE-B3细胞表现出棒状或长纺锤形形态,细胞与细胞之间的接触失调,细胞散布排列;与H2O2组和H2O2+miR-NC组比较,H2O2+miR-630 inhibitor组HLE-B3细胞具有上皮特征,呈立方状且规则排列,细胞排列相对紧密(图2)。
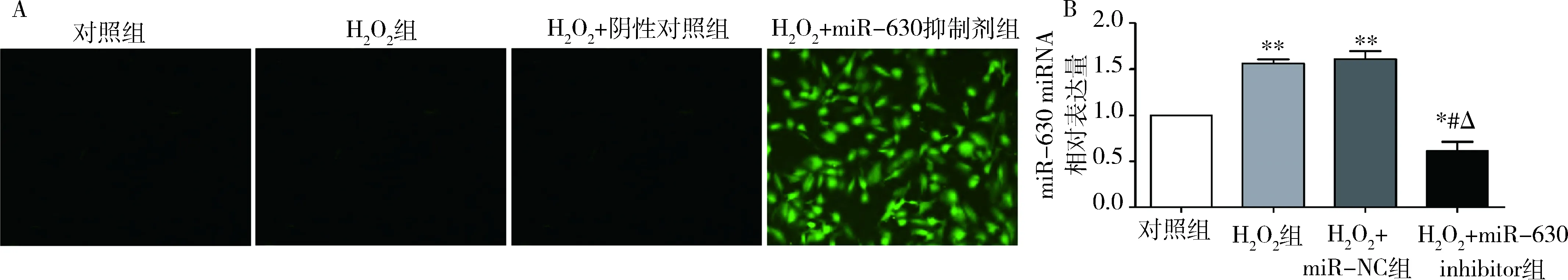
图1 miR-630在HLE-B3细胞中的表达情况A.镜下观察绿色荧光蛋白表达的情况(×200);B.qRT-PCR检测miR-630在HLE-B3细胞中的表达情况;与对照组比较,*P<0.01,**P=0.000;与H2O2组比较,#P=0.000;与H2O2+miR-NC组比较,ΔP=0.000
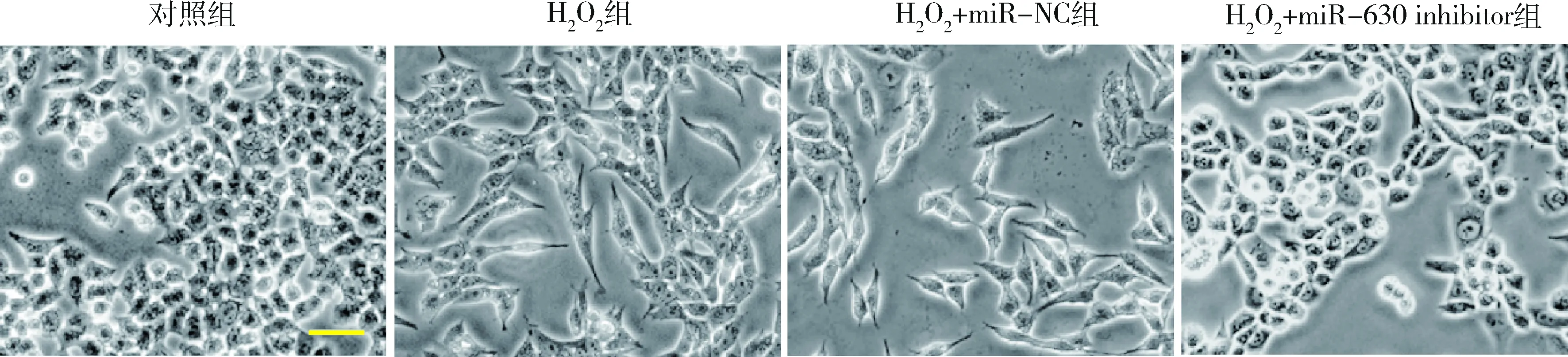
图2 miR-630对HLE-B3细胞形态的影响(×200)
3.miR-630对HLE-B3细胞增殖能力的影响:细胞集落形成实验表明(图3A),与对照组比较,H2O2组和H2O2+miR-NC组HLE-B3细胞的增殖能力显著下降(P均=0.000); 与H2O2组和H2O2+miR-NC组比较,H2O2+miR-630 inhibitor组HLE-B3细胞的增殖能力明显提高(P均<0.01);H2O2组和H2O2+miR-NC组之间比较差异无统计学意义(P>0.05)。EdU实验结果表明(图3B),与对照组比较,H2O2组和H2O2+miR-NC组中的EdU阳性细胞数显著减少(P均=0.000);与H2O2组和H2O2+miR-NC组比较,H2O2+miR-630 inhibitor组中的EdU阳性细胞数明显增加(P均<0.01);H2O2组和H2O2+miR-NC组之间比较差异无统计学意义(P>0.05)。
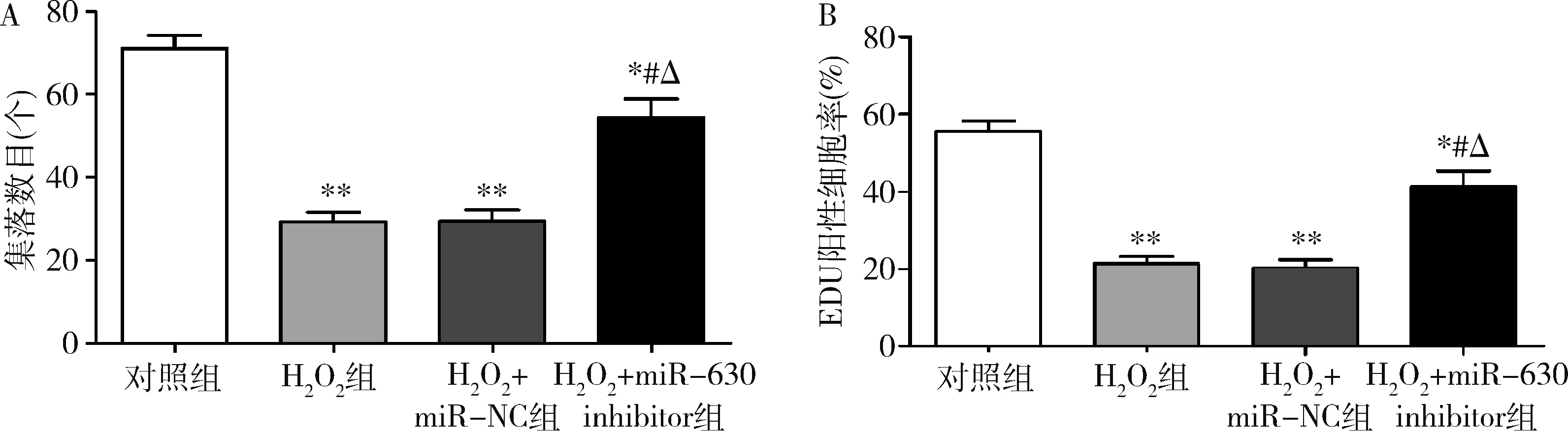
图3 miR-630对HLE-B3细胞增殖的影响A.细胞集落形成实验检测HLE-B3细胞的增殖情况;B.EdU分析HLE-B3细胞的增殖情况;与对照组比较,*P<0.05,**P=0.000;与H2O2组比较,#P<0.01;与H2O2+miR-NC组比较,ΔP<0.01
4.miR-630对HLE-B3细胞迁移的影响:细胞划痕愈合实验表明,与对照组比较,H2O2组和H2O2+miR-NC组HLE-B3细胞的迁移能力显著下降(P均=0.000);与H2O2组和H2O2+miR-NC组比较,H2O2+miR-630 inhibitor组HLE-B3细胞的迁移能力提高(P均<0.05);H2O2组和H2O2+miR-NC组之间比较差异无统计学意义(P>0.05,图4)。
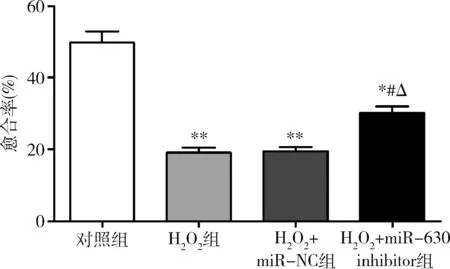
图4 miR-630对HLE-3细胞迁移的影响与对照组比较,*P<0.01,**P=0.000;与H2O2组比较,#P<0.05;与H2O2+miR-NC组比较,ΔP<0.05
5.miR-630对HLE-B3细胞凋亡的影响:流式细胞术结果表明,与对照组比较,H2O2组和H2O2+miR-NC组HLE-B3细胞的凋亡能力显著提高(P均=0.000);与H2O2组和H2O2+miR-NC组比较,H2O2+miR-630 inhibitor组HLE-B3细胞的凋亡能力显著下降(P均=0.000);H2O2组和H2O2+miR-NC组之间比较差异无统计学意义(P>0.05,图5)。
6.miR-630对HLE-B3细胞中ROS水平和SOD含量的影响:与对照组比较,H2O2组和H2O2+miR-NC组中ROS水平上调(P均=0.000),SOD含量减少(P=0.000);与 H2O2组和H2O2+miR-NC组比较,H2O2+miR-630 inhibitor组中ROS水平下调(P均<0.01),SOD含量增加(P<0.05);H2O2组和H2O2+miR-NC组中两者变化均不大,差异均无统计学意义(P>0.05,图6)。
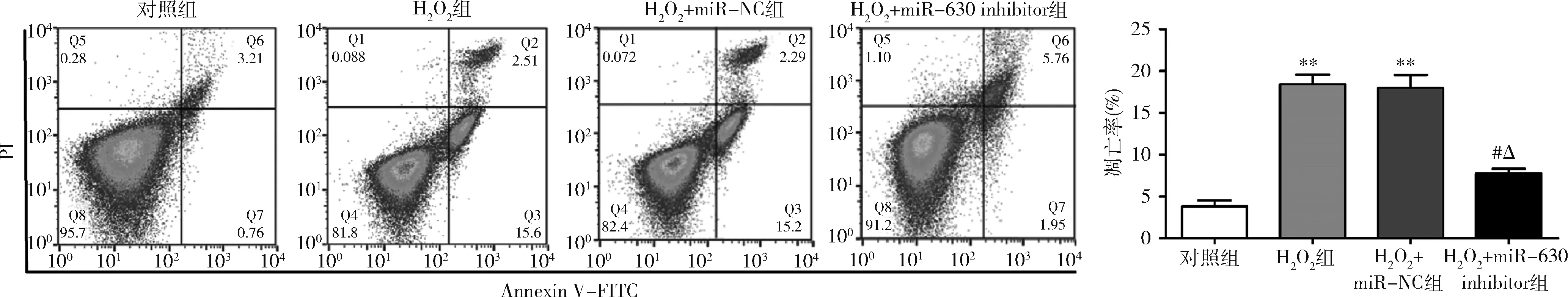
图5 miR-630对HLE-3细胞凋亡的影响与对照组比较,*P=0.000;与H2O2组比较,#P=0.000;与H2O2+miR-NC组比较,ΔP=0.000
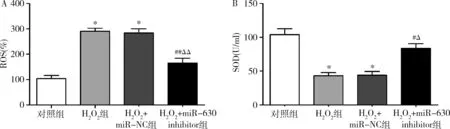
图6 miR-630对HLE-B3细胞中ROS水平和SOD含量的影响A.miR-630对HLE-B3细胞中ROS水平的影响;B.miR-630对HLE-B3细胞中SOD含量的影响;与对照组比较,*P=0.000;与H2O2组比较,#P<0.05,##P<0.01;与H2O2+miR-NC组比较,ΔP<0.05,ΔΔP<0.01
7.miR-630对HLE-B3细胞中Bcl-2和Akt蛋白表达的影响:Western blot法结果表明,与对照组比较,H2O2组和H2O2+miR-NC组中Bcl-2和Akt蛋白表达水平下调(P均=0.000);与 H2O2组和H2O2+miR-NC组比较,H2O2+miR-630 inhibitor组中Bcl-2和Akt蛋白表达水平上调(P<0.01,P<0.05);H2O2组和H2O2+miR-NC组中两者变化均不大,差异均无统计学意义(P>0.05,图7)。
讨 论
白内障是最常见的眼科疾病之一,也是视力障碍或视力丧失的主要原因之一[13]。目前对该病的治疗几乎完全是外科手术,白内障手术是对65岁以上的患者进行的最常见的外科手术[14]。手术治疗虽然有效,但通常花费较大,并给患者带来恐惧[15]。因此,对白内障的有效非手术干预进行研究是一项重要尝试,具有广泛的应用前景和社会效益。
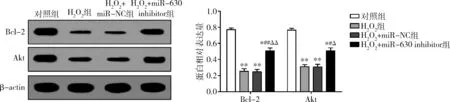
图7 miR-630 对HLE-B3细胞中Bcl-2和Akt蛋白表达的影响与对照组比较,*P<0.05,**P=0.000;与H2O2组比较,#P<0.05,##P<0.01;与H2O2+miR-NC组比较,ΔP<0.05,ΔΔP<0.01
miRNA是一类小的非编码RNA,具有至关重要的基因调节功能,该功能通过与靶基因的3′-非翻译区(3′UTR)结合而起作用[16]。越来越多的证据表明,miRNA在哺乳动物晶状体的多个病理过程中起关键作用[17]。研究表明,miR-26、miR-30a和miR-211通过靶向某些mRNA参与白内障的形成[18~20]。有文献报道,miR-630在白内障患者的晶状体中表达上调,但是miR-630在白内障中的具体作用和机制还未见相关研究[12]。本研究发现,H2O2刺激诱导HLE-B3细胞时,使HLE-B3细胞中miR-630的表达上调,这与miR-630在白内障患者晶状体中的表达结果相一致。
在白内障的形成过程中,晶状体上皮细胞会发生大量凋亡,并且有研究表明,H2O2诱导的氧化损伤能引起晶状体上皮细胞凋亡[21]。本研究通过给予HLE-B3细胞转染miR-630 inhibitor使miR-630低表达,来探究miR-630对晶状体上皮细胞增殖、迁移、凋亡的影响。结果表明,与 H2O2组和H2O2+miR-NC比较,低表达miR-630增加了HLE-B3细胞的增殖能力、迁移能力,降低了HLE-B3细胞的凋亡率。研究报道,多种刺激物可能在眼中产生氧自由基,并且所产生的氧化应激在白内障的发病机制中起着重要作用[22]。
氧化应激代表氧化剂和抗氧化剂之间的平衡发生转移,从而导致组织中的ROS增加。ROS表达增加通常与病理相关,并与引起细胞衰老、凋亡和坏死有关[23]。研究发现,白内障患者晶状体中的ROS水平显著上调[6]。SOD是生物体内重要的抗氧化酶,广泛分布于各种生物体内,如动物、植物、微生物等。SOD具有特殊的生理活性,是生物体内清除自由基的首要物质。它可对抗与阻断因氧自由基对细胞造成的损害,并及时修复受损细胞。本研究发现,下调 miR-630表达能够降低H2O2诱导的细胞内 ROS水平,增加SOD的含量。结果表明,下调miR-630表达可能减少H2O2诱导的晶状体上皮细胞氧化损伤。Bcl-2和Akt是重要的抗凋亡基因,通过抑制超氧阴离子的过多产生或抑制线粒体通透性的改变,阻止线粒体膜转膜电位的下降,从而抑制细胞凋亡[24]。因此,本研究探究了H2O2诱导的人晶状体上皮细胞中miR-630与Bcl-2和Akt的关系。结果表明,在人晶状体上皮细胞中,低表达miR-630能够上调H2O2诱导的Bcl-2和Akt的表达。
综上所述,低表达miR-630可能增加H2O2诱导的人晶状体上皮细胞的增殖、迁移,抑制其凋亡与氧化损伤,其可能与Bcl-2和Akt的表达上调相关。因此,miR-630可能是治疗白内障的潜在靶点。
