基于钙敏感受体探讨花旗泽仁改善胰岛素抵抗的作用机制
2020-07-03黄启晶李佳欣陈思琦吕忠民孙丽英葛鹏玲
王 博 黄启晶 李佳欣 陈思琦 吕忠民 孙丽英 葛鹏玲
糖尿病(diabetesmellitus,DM)是一类常见的由多种病因引发的内分泌代谢性疾病,目前世界上有4.25亿人患有糖尿病,预计2045年世界上将有6.29亿人罹患糖尿病[1~3]。其中2型糖尿病发生率及致死率逐年升高,已被我国列入严重危害人民健康的重大多发病和常见病之一[4]。胰岛素抵抗(insulin resistance,IR)是指机体靶器官或组织对胰岛素生物效应的敏感度降低或丧失,是2型糖尿病发病的主要机制之一。
研究表明,PI3K/AKT通路中蛋白激酶B(AKT)活性降低是发生IR的病理基础[5]。AKT活性可被NPS2390(钙敏感受体拮抗剂)抑制,而GdCl3(钙敏感受激动剂)能增强AKT活性[6]。因此,推测CaSR可能通过激活或抑制AKT的活性,进而调节PI3K/AKT信号通路的转导,从而影响IR。本课题组前期实验结果表明,肝脏、肌肉、脂肪及胰腺组织中均有CaSR的表达,各组织中发生IR时,AKT磷酸化位点Ser473和Thr308表达量降低,且CaSR基因及蛋白表达量均降低[7]。
目前西药治疗IR易产生治疗矛盾,疗效不理想,而中药重视整体调节及辨证论治,且中药治疗具有多渠道、多靶点、毒性不良反应小等特点。本实验所用的花旗泽仁是临床治疗脾虚湿盛、湿热内蕴型糖尿病胰岛素抵抗及相关疾病的经验方,疗效确切[8]。本课题组前期实验结果显示,给予花旗泽仁后肝脏、肌肉、脂肪及胰腺组织中CaSR基因、蛋白及AKT表达量均显著上调。
本研究根据前期体内实验证实CaSR与IR具有相关性的基础上,将进一步在细胞水平上从CaSR角度,通过PI3K/AKT信号通路,探究花旗泽仁改善IR的作用机制,为花旗泽仁在临床的应用及推广奠定基础。
材料与方法
1.实验材料:L6肌细胞株购自ATCC(American Type Culture Collection);健康SD大鼠20只,雌雄各半,体质量200±20g,购自黑龙江中医药大学实验动物中心,实验动物许可证号:SCXK(黑)2013-004。分笼饲养,房间温度为20±2℃,相对湿度为50%左右,自由摄食、饮水,适应喂养1周。
2.药物、试剂与仪器:DMEM,胎牛血清由美国Gibco公司提供;TNF-α由美国Peprotech公司提供;考马斯亮蓝由美国Sigma公司提供;DMSO由美国Sigma公司提供;Trizol Reagen由美国Invitrogen公司提供;DEPC焦炭酸二乙酯由美国Amresco公司提供;AccuPower RocketScript RT PreMix、AccuPower GreenStar qPCR PreMix由韩国Bioneer公司提供;无水乙醇、氯仿、异丙醇、甲醇、吐温20由天津市致远化学试剂有限公司提供;丙烯酰胺由上海埃彼化学试剂有限公司提供;Tris-HCl(pH 6.8)以及Tris-HCl(pH 8.8)由美国Amresco公司提供;RNase-free water (去离子水加入0.01%的DEPC)、10%十二烷基硫酸钠(SDS)、DAPI、ECL化学发光试剂盒由中国Solarbio公司提供;N,N,N′,N′-四甲基二乙胺(TEMED)由美国Sigma公司提供;10%过硫酸铵(AP)由济宁佰一化工有限公司提供;蛋白裂解液,4×蛋白上样缓冲液由上海碧云天生物技术有限公司提供;蛋白预染marker由美国Thermo公司提供;CaSR抗体、β-actin由英国Abcam公司提供;Akt抗体由美国Cell Signaling公司提供;pAkt(s473)抗体、pAkt(T308)抗体由美国Cell Signaling公司提供;FITC标记IgG由中杉金桥公司提供;封闭液(5%脱脂奶粉)由内蒙古伊利实业集团股份有限公司提供。梯度单头PCR仪Bio-RadS1000、real-time PCR仪 Bio-Rad CFX96、电泳仪、Universal Hood Ⅱ型Bio-RAD凝胶成像系统、半干转膜仪由美国伯乐公司提供;生物安全柜ESCO class Ⅱ type B2由新加坡艺恩高科技有限公司提供;微量台式低温离心机Mircro 17R、离心机由美国Thermo公司提供;紫外分光光度计由岛津有限公司提供;荧光显微镜、倒置显微镜由日本奥林巴斯公司提供;摇床由海门市其林贝尔公司提供;酶标仪由美国MD公司提供。
3.分组及模型制备:(1)正常对照组(L6肌细胞的体外培养、传代与诱导分化):L6肌细胞用含10%胎牛血清及青霉素、链霉素的DMEM高糖培养基在37℃、5%CO2培养箱中培养,形成单层贴壁细胞,每隔2天传代1次。将细胞培养瓶中的培养液倒掉,PBS冲洗2次;加入1ml消化液,轻轻晃动,放入37℃、5% CO2培养箱中2min;取出培养瓶,加入4ml培养基,终止消化,将全部细胞吹下来,使细胞脱离培养瓶底部;将细胞悬液放入15ml离心管中,离心5min;离心后,移除上层废液,向离心管红加入培养基,将细胞吹散;沿瓶壁按1∶3比例稀释加入细胞培养瓶中。当L6肌细胞聚合为60%~80%时,更换为含2%胎牛血清及青霉素、链霉素的DMEM高糖培养液在37℃、5% CO2培养箱中培养,每隔2天换1次液,6~7天后观察L6肌细胞的肌管生长情况。(2)模型对照组[肿瘤坏死因子(TNF-α)诱导L6肌细胞产生IR]:将培养板中分化出肌管的肌肉细胞,TNF-α诱导组为6个样本,TNF-α诱导组每孔加入2ml已配制好的TNF-α溶液(10ng/ml)。(3)花旗泽仁组:根据本课题组前期最佳药量配比实验,得出中药复方花旗泽仁的最佳配比[8]。熬制前,将西洋参、泽泻和薏苡仁三味中药浸泡12h,加入适量的水煎煮,共煎煮3次,第1次水沸后小火煎煮60min,第2次水沸后继续用小火煎煮45min,第3次水沸后小火煎煮30min,合并3次水煎液,过滤,水浴浓缩,含生药量约为0.54g/ml,4℃保存。含药血清制备:取正常SD大鼠10只,花旗泽仁组按1ml / 100g灌胃花旗泽仁水煎液,连续给药7天。根据本课题组前期对花旗泽仁主要活性成分在大鼠血浆中药代动力学的研究,得出在末次给药后1h,血药浓度达到峰值,因此,在末次给药后1h,按3.5ml/kg腹腔注射10%水合氯醛,麻醉后无菌条件下经腹主动脉采血,室温下将血液静置30min,待凝血坚固,血清析出,4℃ 3000r/min离心15min,再静置15min后取上清液,同组混匀,56℃灭活30min,经0.22μm滤膜过滤除菌分装,-80℃保存备用。临用前将血清用DMEM培养基稀释成10%的含药血清溶液。(4)阳性对照组:取罗格列酮4.735mg溶于1ml DMSO中配制成10mmol/L溶液冻存备用,使用时终浓度为10-5mol/L。(5)细胞骨架考马斯亮蓝染色鉴定:在培养板上将已爬好的玻片用PBS浸洗3次,用2.5%戊二醛固定30min,PBS浸洗3次,每次3min,用1%Triton-100(PBS配制)室温通透10min,蒸馏水漂洗3次,加入0.2%考马斯亮蓝R-250染色30min,蒸馏水清洗3次,用滤纸吸干水滴,并于显微镜下观察。
4.葡萄糖氧化酶法测培养基中葡萄糖浓度将葡萄糖工作试剂加入100ml ddH2O中,振荡混匀;96孔板中每孔取8μl培养液,加入含1ml工作试剂的试管中,振荡混匀,另取标准液8μl,加入含1ml 工作试剂的试管中;37℃水浴20min;每试管取100μl混合液,加入96孔酶标板中;酶标仪在510nm 处测吸光光度值(A值);根据公式计算待测液葡萄糖浓度。待测葡萄糖浓度(mmol/L) =待测液A值/标准液A值×5.5mmol/L。
5.免疫荧光法检测CaSR在L6细胞上的定位:在培养板上将已爬好的玻片用PBS浸洗;用4%多聚甲醛固定爬片;用0.5% Triton-100(PBS配制)室温通透20min;PBS浸洗玻片,在玻片上滴加正常山羊血清,室温封闭30min,每张玻片滴加足量稀释好的一抗放入湿盒中,4℃孵育过夜;第2天,PBST浸洗爬片,滴加稀释好的二抗,湿盒中孵育1h,PBST浸洗玻片,滴加DAPI避光孵育5min,对细胞进行染核,PBST浸洗,尽量洗去多余DAPI;用含抗荧光淬灭剂的封片液封片,然后在荧光显微镜下观察采集图像。
6.实时荧光定量PCR检测L6细胞上CaSR mRNA的表达:(1)RNA提取的实验方法:96孔板细胞长至90%以上,弃去培养液,PBS清洗3次后,每孔加入Trizol 1ml,摇匀,静置消化3~5min;将各孔内消化好的细胞吸入DEPC水处理过的1.5ml EP管中,加入氯仿0.2ml,轻摇15s;室温静置2~3min,4℃,12000r/min离心15min后取上清无色水相(约0.5ml)移到新EP管中,加0.5ml异丙醇,室温下静置10min;4℃,12000r/min离心10min,观察到到管底有白色沉淀即为总RNA,弃去上清,以75%乙醇洗涤EP管后,4℃,7500r/min离心5min;弃上清,将带有沉淀物的离心管倒扣于滤纸上,干燥10min;用15~20μl DEPC水溶解后,56℃助溶10min,-20℃低温保存。(2)qRT-PCR实验:在配套的PCR反应管中加入1.0μl dT20、1.0μl 样本RNA、18.0μl DEPC;将上述溶液混合并按条件进行反转录反应;以反转录所得cDNA为模板进行PCR扩增,具体试验操作流程依据相关试剂盒操作说明,CaSR引物序列(正向引物序列:5′-TTCTTTGAACCTGGACGACGAGT-3′,反向引物序列:3′-GCGAGGAAGGATTTGTAC-5′)。PCR反应条件:95℃ 10min、95℃ 10s、47℃ 30s,共40个循环。按照2-△△Ct相对定量法分析目的基因与内参基因的相对表达水平。
7.蛋白印迹法检测L6细胞上CaSR蛋白表达量及Akt活性:(1)CaSR蛋白提取:倾倒培养液,每瓶细胞加入3ml 4℃预冷的PBS,洗涤细胞3次;洗涤后将培养瓶置于冰上,每瓶细胞加入100μl的细胞裂解液(1ml RIPA+10μl PMSF+10μl蛋白酶抑制剂+10μl磷酸酶抑制剂),于冰上裂解30min,来回摇动使细胞充分裂解;裂解完后,用移液枪将细胞碎片和裂解液移至1.5ml离心管中(整个过程尽量在冰上进行);4℃ 12000r/min离心15min;将离心后的上清分装,-80℃保存。(2)免疫印迹实验:用微量进样器加入裂解后的细胞样品,80V电压开始电泳;电泳结束后,取出凝胶放入转膜液中,按照膜面积的1.5倍作为电流,恒流转膜;转膜结束后,将PVDF膜取出,放入装有适量的5%牛奶封闭液的平皿中,37℃平缓摇动1h;将一抗用TBST稀释比例为1∶1000,将PVDF膜放入一抗中4℃过夜;将二抗用TBST稀释比例为1∶5000,将PVDF膜放入二抗中37℃,孵育1h;将ECL化学发光试剂滴加到PVDF膜正面上,反应2~3min后置于凝胶成像系统中曝光。
结 果
1.细胞骨架考马斯亮蓝染色鉴定结果:诱导分化前L6细胞相互交织,以梭形为主,也可见不规则三角形、多角形等,立体感差,其形状与成纤维母细胞相似,未见肌性结构出现;显微镜下观察可见,诱导分化后,L6细胞成长梭形,体力感强,细胞体积变小、排练紧密,多个细胞可融合成一条长的肌纤维(图1A),考马斯亮蓝染色后长的肌纤维可见多个细胞核(图1B),说明此时可用于建立IR模型实验。

图1 诱导分化后L6细胞形态(考马斯亮蓝染色,×100)
2.花旗泽仁对胰岛素抵抗L6肌细胞模型葡萄糖消耗量的影响:在L6肌细胞中,与正常对照组比较,模型对照组葡萄糖消耗量明显下降(P<0.01),说明胰岛素抵抗L6细胞模型被成功建立。与模型对照组比较,花旗泽仁组和阳性对照组葡萄糖消耗量均明显升高(P<0.05),详见表1。
表1 TNF-α对L6细胞葡萄糖消耗量的影响
与正常对照组比较,*P<0.01;与模型对照组比较,#P<0.05;RG.葡萄糖剩余量;CG.葡萄糖消耗量
3.钙敏感受体免疫荧光检测结果:在L6肌细胞正常对照组、模型对照组和花旗泽仁组中均发现CaSR的表达,与正常对照组比较,CaSR在模型对照组中的分布较稀疏;与模型对照组比较,花旗泽仁组CaSR的分布较密集,详见图2。
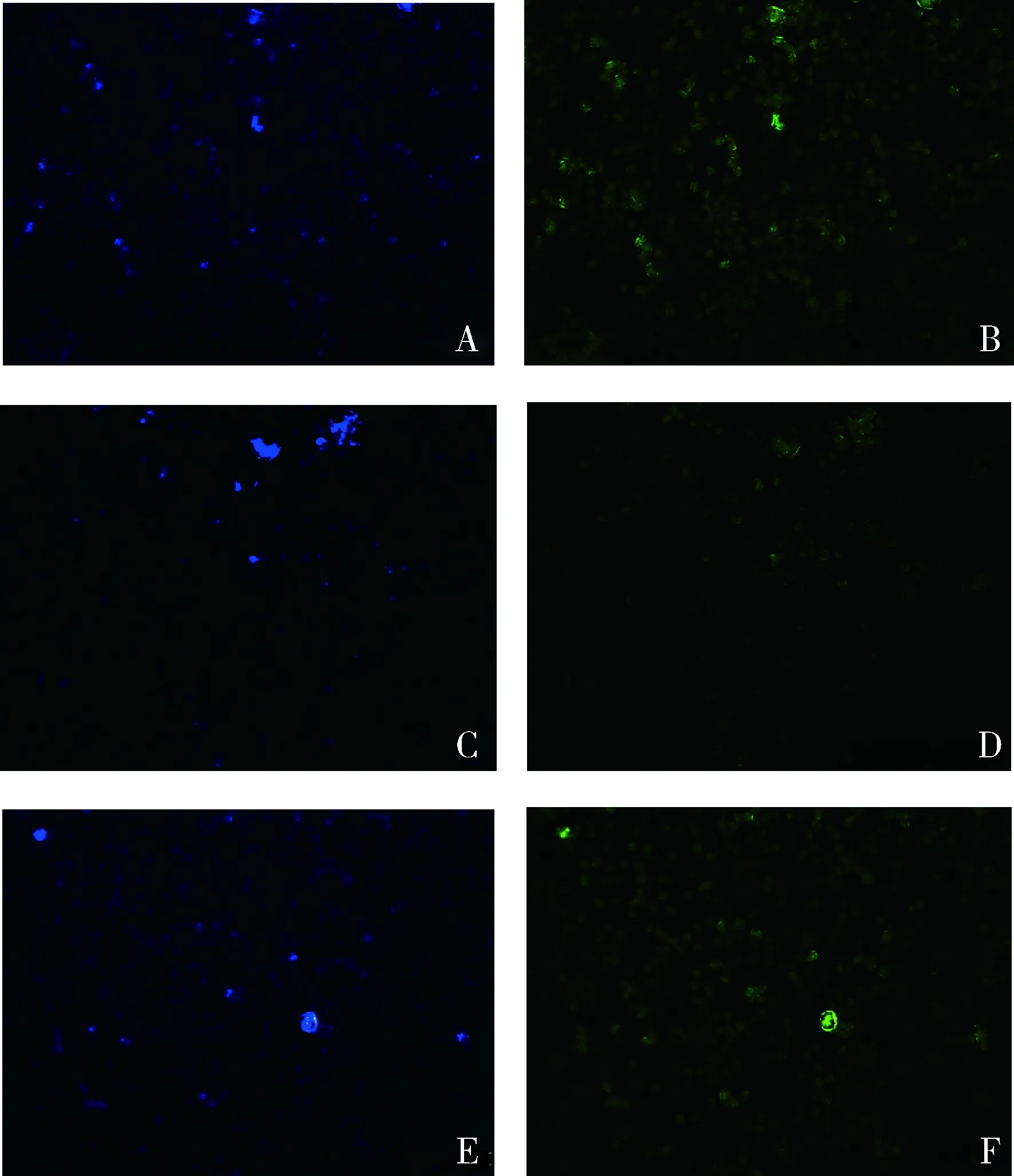
图2 各组钙敏感受体分布图(免疫荧光染色,×50)A.正常对照组细胞核染色;B.正常对照组受体染色;C.模型对照组细胞核染色; D.模型对照组受体染色; E.花旗泽仁组细胞核染色;F.花旗泽仁组受体染色
4.花旗泽仁对胰岛素抵抗L6肌细胞中CaSR mRNA及CaSR蛋白表达水平的影响:在L6肌细胞中,与正常对照组比较,模型对照组CaSR mRNA表达水平下调(P=0.000);与模型对照组比较,花旗泽仁组和阳性对照组CaSR mRNA表达水平显著上调(P<0.01,表2、图3)。CaSR蛋白表达的影响:与正常对照组比较,模型对照组中L6肌细胞CaSR蛋白表达显著下降(P=0.000);与模型对照组比较,花旗泽仁组、阳性对照组中L6肌细胞CaSR蛋白表达水平明显升高(P均为0.000),详见表2、图4。
表2 花旗泽仁对胰岛素抵抗L6肌细胞中CaSR mRNA及CaSR蛋白表达水平的影响
与正常对照组比较,*P=0.000;与模型对照组比较,#P<0.05,##P<0.01,###P=0.000
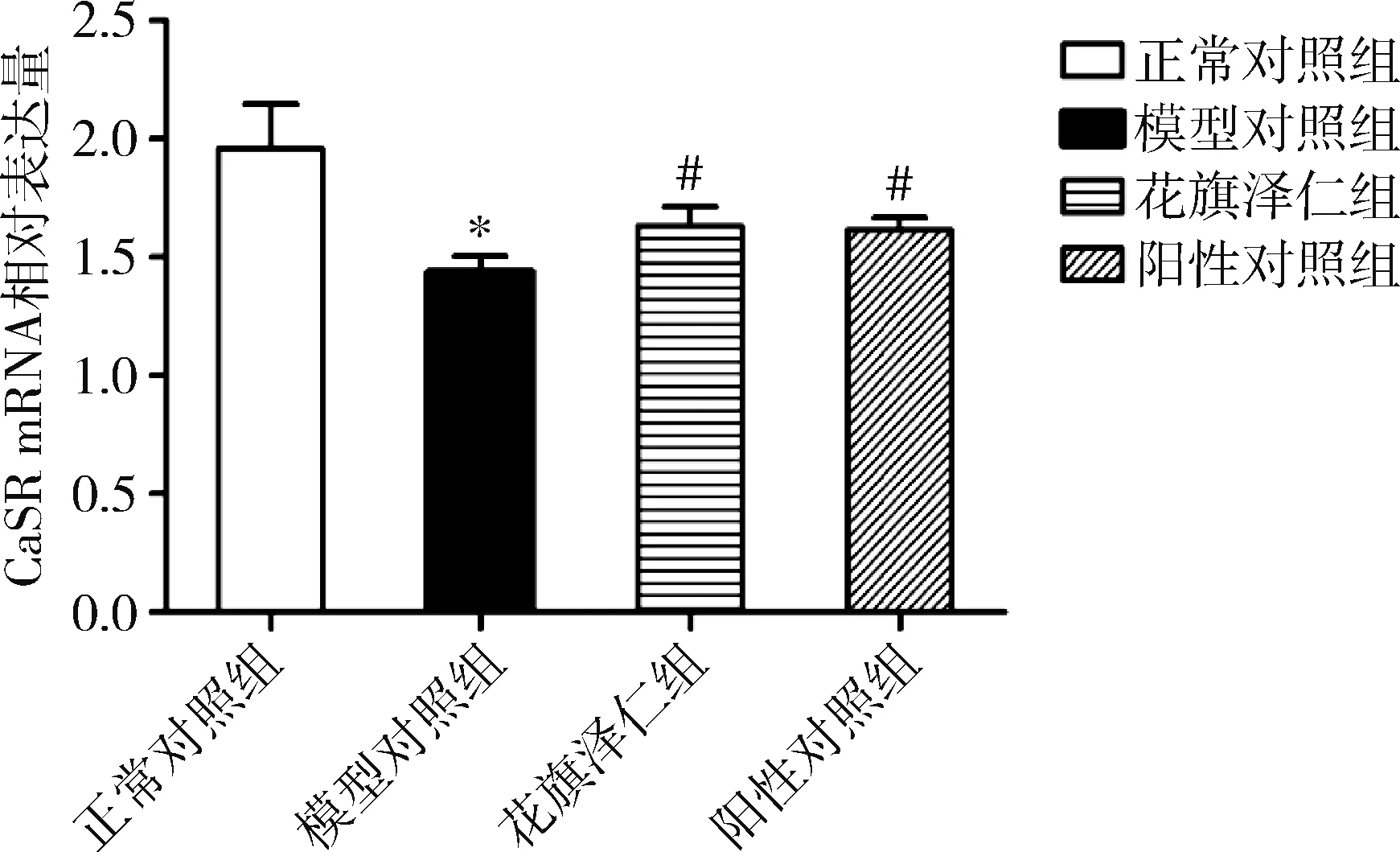
图3 花旗泽仁对L6肌细胞中CaSR mRNA表达水平的影响与正常对照组比较,*P=0.000;与模型对照组比较,#P<0.01
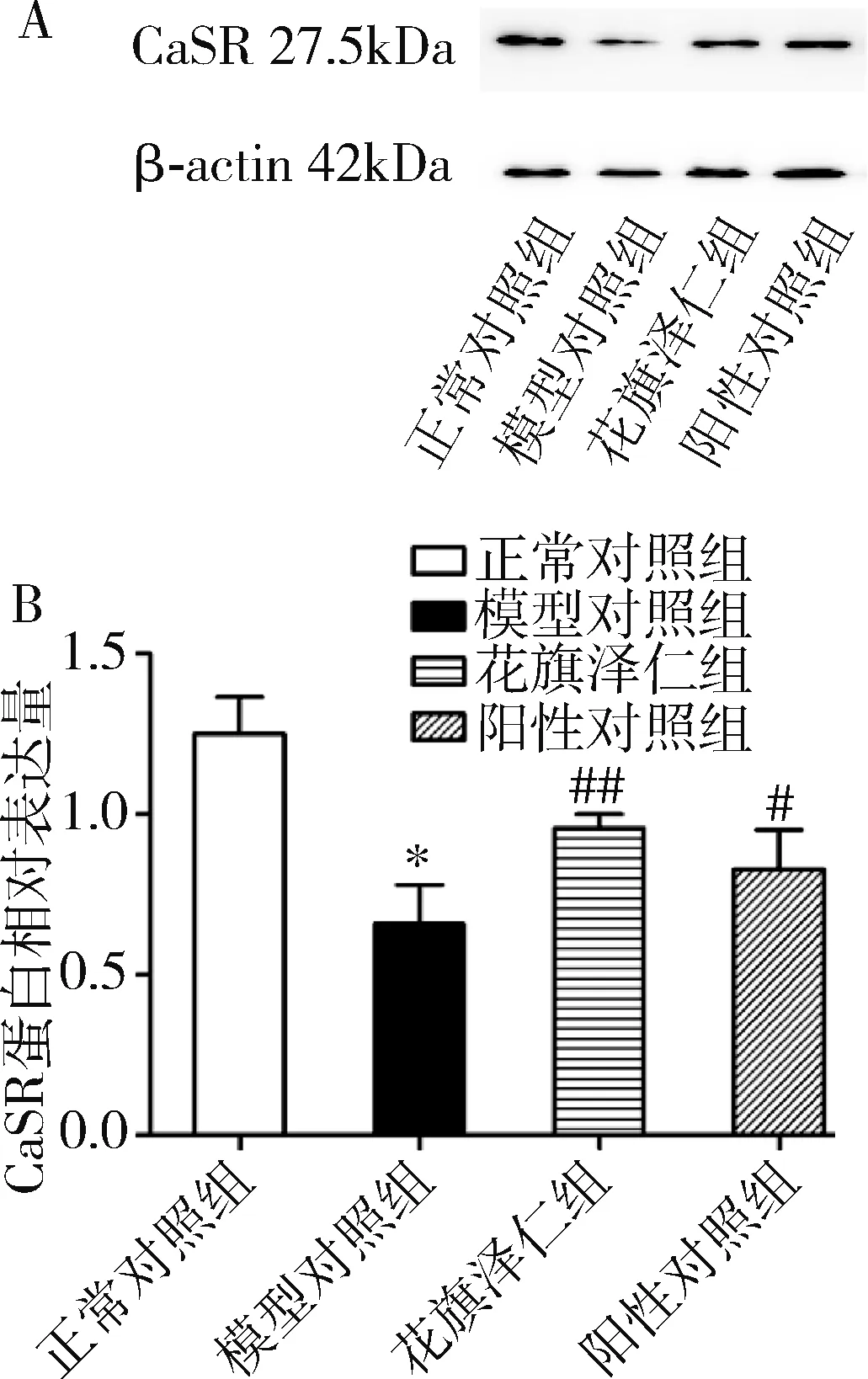
图4 花旗泽仁对L6肌细胞CaSR 蛋白表达水平的影响A.Western blot法检测结果;B.蛋白灰度值。与正常对照组比较,*P=0.000;与模型对照组比较,#P<0.05,##P=0.000
5.花旗泽仁对胰岛素抵抗L6肌细胞蛋白激酶B(AKT)活性的影响:与正常对照组比较,模型对照组L6肌细胞中磷酸化AKT(Thr308和Ser473)蛋白含量显著下降(P均为0.000);与模型对照组比较,花旗泽仁组L6肌细胞磷酸化AKT(Thr308 和Ser473)蛋白表达水平明显升高(P均为0.000);阳性对照组L6肌细胞磷酸化AKT(Thr308)蛋白表达水平明显升高(P=0.000),AKT(Ser473)蛋白表达差异无统计学意义,详见表3、图5。
6.采用免疫印迹法观察CaSR激动剂对IR细胞模型AKT活性的影响:如表4、图6所示,与正常对照组比较,模型对照组L6肌细胞中磷酸化AKT(Thr308和Ser473)蛋白含量显著下降(P<0.01);与模型对照组比较,激动剂对照组L6肌细胞磷酸化AKT(Thr308 和Ser473)蛋白表达水平明显升高(P<0.01)。
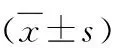
表3 花旗泽仁对L6肌细胞中Thr308和Ser473蛋白磷酸化水平的影响
与正常对照组比较,*P=0.000;与模型对照组比较,#P<0.05,##P=0.000
图5 花旗泽仁对L6肌细胞磷酸化Akt蛋白表达水平的影响A.Western blot法检测结果;B.蛋白灰度值。与正常对照组比较,*P=0.000;与模型对照组比较,#P<0.005,##P=0.000
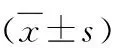
表4 钙敏感受体激动剂对L6肌细胞中Thr308和Ser473蛋白的影响
与正常对照组比较,*P<0.01;与模型对照组比较,#P<0.01
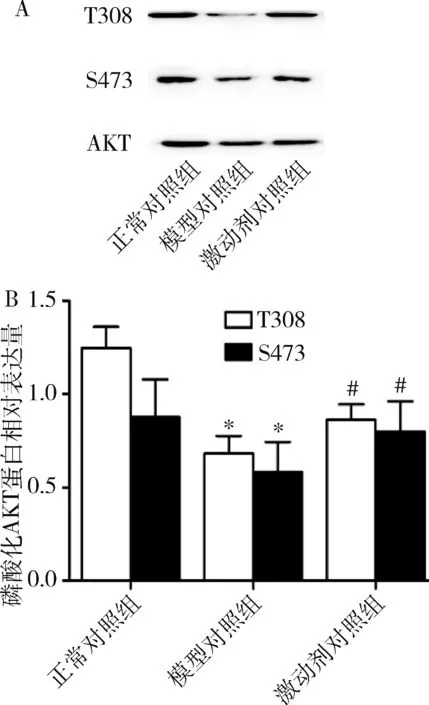
图6 花旗泽仁及CaSR激动剂对L6肌细胞磷酸化Akt蛋白表达水平的影响A.Western blot法检测结果;B.蛋白灰度值。与正常对照组比较,*P<0.01;与模型对照组比较,#P<0.01
讨 论
随着人们生活水平的日益提高,糖尿病,特别是2型糖尿病胰岛素抵抗(insulin resistance,IR)的发生率呈现迅猛增长趋势[2]。IR贯穿2型糖尿病主要发病过程。目前普遍认为,肝脏、脂肪、骨骼肌及胰腺组织是发生IR的重要靶组织[9]。本课题组前期研究已显示花旗泽仁改善IR大鼠肝脏、脂肪、骨骼肌及胰腺组织的相关机制,而本实验采用L6肌细胞为实验研究对象,从细胞水平上进一步探究花旗泽仁改善IR的分子机制。
骨骼肌是全身利用葡萄糖最重要的组织之一,胰岛素刺激的葡萄糖利用中约有80%由骨骼肌摄取[10]。在肌细胞内,胰岛素抗性降低了葡萄糖的吸收。当发展成全身IR时,骨骼肌对葡萄糖的摄取能力下降可能最终导致 2 型糖尿病的发生[11]。骨骼肌细胞摄取葡萄糖主要通过胞内区室GLUT4与细胞质膜和横小管来完成[12]。本实验采用的大鼠L6肌细胞能反映出关于IR的生理病理状态,是研究IR机制很好的体外细胞模型。因此,建立骨骼肌细胞的IR模型对研究IR机制及IR的防治有着重要意义。
钙敏感受体(calcium-sensing receptor,CaSR)是G蛋白偶联受体的C家族成员,是一种整合膜蛋白[13]。本研究中,采用免疫荧光技术检测到在L6肌细胞中有CaSR存在,并且可观察到模型对照组L6肌细胞中的CaSR数量明显低于正常对照组,通过qRT-PCR实验检测到CaSR mRNA的表达,发现发生IR时,在L6肌细胞中CaSR mRNA表达量成下降趋势。并通过免疫蛋白印迹(Western blot)法实验,观察到L6肌细胞中模型对照组中CaSR蛋白表达水平亦显著下调。
蛋白激酶B(AKT),是一种丝氨酸/苏氨酸特异性蛋白激酶,在多种细胞过程中起着关键作用。AKT 通过结合并调节许多下游效应物(例如核因子-κB,Bcl-2家族蛋白)调节细胞存活和代谢[14]。Akt2是胰岛素诱导的葡萄糖转运蛋白4(GLUT4)向质膜转运所必需的。糖原合酶激酶3(GSK3)可被AKT磷酸化后抑制,导致糖原合成增加。GSK3也参与Wnt信号级联,AKT可能也涉及Wnt途径[15,16]。
胰岛素与受体结合后,主要通过促进葡萄糖利用、糖原合成、抑制糖异生而实现其降低血糖的作用[17]。而PI3K/AKT通路是胰岛素实现其上述作用的主要途径,激活PI3K信号通路,可激活绑定在磷脂酰肌醇-3,4,5-三磷酸上的丝氨酸或苏氨酸(Ser473、Thr308)两个主要磷酸化位点,从而激活AKT使其发挥作用[18,19]。本实验采用Western blot法检测L6肌细胞中Thr308、Ser473蛋白,同时采用Western blot法检测CaSR激动剂(GdCl3)对AKT蛋白活性的影响,发现与正常对照组比较,模型对照组蛋白激酶B(AKT)磷酸化(Thr308、Ser473)蛋白表达明显降低,与模型对照组比较,GdCl3对照组L6肌细胞磷酸化AKT(Thr308 和Ser473)蛋白表达水平明显升高。实验结果显示,L6肌细胞发生IR时,磷酸化AKT蛋白含量明显下降,AKT活性被抑制,并且CaSR激动剂(GdCl3)可上调AKT活性,提示CaSR可能参与PI3K/AKT信号通路。
花旗泽仁改善IR中药复方花旗泽仁为临床治疗2型糖尿病IR的有效经验方,本方基于中医药整体观念和辨证论治的理论,从2型糖尿病IR脾虚湿盛,湿热内蕴的病理特点出发,以补气养阴、清火生津之功的西洋参为君药,渗湿健脾的薏苡仁为臣药,利水渗湿、泄热之泽泻为佐药,配伍组成花旗泽仁中药复方,共奏补气、健脾、生津、清热、利湿之功[20]。
本课题组前期通过qRT-PCR与Western blot法技术对比检测2型糖尿病IR大鼠、正常大鼠以及花旗泽仁给药大鼠的肝脏、脂肪、肌肉及胰腺组织中的CaSR mRNA、蛋白表达和AKT(Thr308 和Ser473)蛋白表达水平的差异,结果表明花旗泽仁具有降血糖、升高胰岛素敏感度、上调CaSR mRNA表达、CaSR蛋白表达及AKT(Thr308和Ser473)蛋白表达的作用。
综上所述,本研究与模型对照组比较,花旗泽仁组L6肌细胞中CaSR mRNA、蛋白及AKT磷酸化(Thr308、Ser473)蛋白表达水平显著上升,本研究结果表明,花旗泽仁可能通过调节CaSR基因及蛋白的表达,激活AKT的活性,进而调节PI3K/AKT信号通路的转导,从而改善胰岛素抵抗。
