犬心房肌细胞分离方法的改良及影响因素探讨
2020-07-03王红丽李志强张格格郭玉君
王红丽 李志强 范 平 张格格 郭玉君
心房疾病是一个日益严重的全球性问题。心房颤动(atrial fibrillation,AF)是最常见的心律失常之一,影响全球3300万患者,在未来的30年预计其发生率将增加3倍[1]。目前药物治疗的效果不理想并且还有一定的不良反应,包括药物引起的心律失常和心脏毒性[2]。目前药物的有效性是有局限的,可能是由人们对心律失常复杂的病理生理学认识不完全所致[3]。随着心脏电生理技术的发展尤其是膜片钳技术在基础领域中的广泛应用,越来越多证据表明,心房颤动的发生与离子通道的功能和结构改变密切相关[4,5]。电生理检测过程中由于完整心脏体积较大,导致电压钳实验中不能充分控制膜电位。这种限制是分离单个心肌细胞技术发展的主要动力。阐明离子电流和细胞微结构的病理变化需要分离的单个心房肌细胞。目前关于分离成年犬单个心房肌细胞的方法比较的报道较少[6,7]。急性分离的细胞在结构和功能上都与活的生物体生理性特征相似,非常适合观察细胞结构和细胞内分子精确定位的实验,也经常用于细胞内Ca2+稳态、细胞力学和蛋白质生物化学的研究。心肌细胞急性分离技术方法至关重要,能够保持心肌细胞在体内的功能和完整性。
因此,为了获得稳定的心房肌细胞,本研究运用两种不同的方法分离犬心房肌细胞,并从心房肌细胞成活率、细胞自主收缩、酶的使用量、酶消化时间和记录起搏电流(If)等方面进行比较。笔者对整体心脏的结扎部位、灌流液成分、酶的选择等方面进行改进,摸索出简单、快捷的犬心房肌细胞分离方法,为研究心房肌细胞生理和病理特性提供了实验材料。
材料与方法
1.实验动物:普通级比格犬8条,雌雄不拘,体质量12~14kg,2岁,均购于新疆医科大学实验动物中心 [SCXK(新)2016-0001),课题实验设计、实验方案及具体实施步骤已经新疆医科大学第一附属医院动物伦理学委员会批准、审核,审批号为IACUC-20170210-03。实验实施推进过程严格按照美国国立研究机构设立的实验动物使用和护理指南进行。犬植入起搏器,持续左心耳起搏8周,构建慢性心房颤动模型。
2.主要试剂与仪器:Ⅱ型胶原酶(Worthington),蛋白酶(Protease,美国Sigma公司),牛血清白蛋白(bovine serum albumin,BSA,美国Sigma公司),多导电生理仪(LEAD-7000),多功能监护仪(BeneviewT5),动物实验用的埋藏式起搏器(上海复旦大学电子生物工程有限公司)光学倒置显微镜(日本Olympus公司)。
3.实验前准备:无钙台式液(NaCl 140mmol/L,KCl 5mmol/L,MgCl2·6H2O 1mmol/L,HEPES 10mmol/L,Glucose 10mmol/L)。含钙台式液(NaCl 140mmol/L,KCl 5mmol/L,MgCl2·6H2O 1mmol/L,HEPES 10mmol/L,Glucose 10mmol/L,CaCl21.8mmol/L)。高钾台式液(NaC1 140mmol/L,KC1 15mmol/L,MgCl2·6H2O 1mmol/L,HEPES 10mmol/L,Glucose 10mmol/L,CaCl21.8mmol/L)。KB液(细胞保存液K-Glutamate 120mmol/L,KCl 10mmol/L,KH2PO410mmol/L,MgSO41.8mmol/L,K-EGTA 0.5mmol/L,Taurine 10mmol/L,HEPES 10mmol/L,Glucose 20mmol/L,BSA 0.2%),以上溶液用NaOH调pH值至7.3~7.4。酶液(改良方法):取150ml无钙液,加入浓度为0.5%的Ⅱ型胶原酶、0.01%Protease和0.1%BSA。酶液(传统方法):取250ml无钙液加入Ⅱ型胶原酶(125U)和0.1%BSA。细胞外液(NaCl 140mmol/L,KCl 5mmol/L,CaCl21.8mmol/L,MgCl21mmol/L,BaCl21mmol/L, HEPES 10mmol/L,Glucose 10mmol/L;用NaOH调pH值至7.4)。细胞内液(K+-ATP 5mmol/L,KCl 50mmol/L,MgCl21mmol/L,HEPES 10mmol/L,EGTA 2mmol/L;用KOH调pH值至7.2)。
4.心肌细胞分离方法:改良方法:成年雄性犬称重后,用3%戊巴比妥钠麻醉,静脉给肝素(1000U/kg),开胸取心脏,放入4℃氧饱和的高钾液。在主动脉冠状动脉窦口用高钾液反复冲洗去除心腔及血管内的残血,随后从左前旋支插入自制导管,剪去右心房和左右心室以及室间隔等其他组织,只保留左右心房和心耳(目的是分离心房肌),手术线缝合固定。心脏悬挂于Langendorff灌流,给予30ml/min的含钙液灌流。在各个渗水点用手术线结扎,直到肉眼看不见渗水点为止,此时可见左心耳,左心房充盈。无钙台式液继续灌流,灌流量根据所保留的心脏组织大小而定。酶液充盈于整个心脏时,流出的酶液循环灌流约35~50min,剪取小部分组织在KB液中轻轻摇动,组织消失,显微镜观察是否有细胞,有大量的细胞时终止消化。收集上清液,800r/min离心5min,去酶液。加入新的KB液保存细胞。传统方法:取心脏同上,迅速放入4℃肝素盐水反复冲去除心腔内残血,心脏悬挂于Langendorff 灌流[8,9]。一个通道灌注高钾液,使心脏停止机械搏动,沿主动脉将主动脉切开。自制的导管通过主动脉左冠状动脉窦插入左冠状动脉回旋支内,窦口处缝合固定心脏。沿房室沟分别结扎心外膜冠状动脉右室支、左前分支及回旋支的心室各分支,根据结扎点剪去左、右心室组织,剪完后仍有多处部位漏液体,需要逐一结扎,直至肉眼看不到漏液点。另一个通道灌流无钙台式液5min,去除残留的残血及高钾液。酶液循环灌流45~60min左右至心肌组织松弛呈溶胶状。显微镜观察灌流液内可见数个心肌细胞时终止消化,无钙台式液灌流5min,冲洗残余的酶液。疏松的心房肌放入无钙台式液中切碎,用宽口吸管匀速吹打多次。细胞的悬浊液用200目金属滤网过滤至细胞保存液中(图1)。
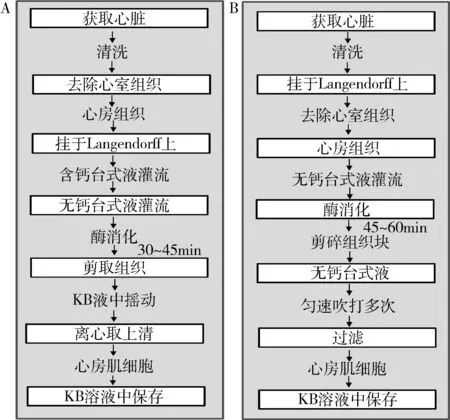
图1 两种不同方法分离心房肌细胞的步骤A.传统方法;B.改良方法
5.细胞存活率的检测:取心肌细胞悬液90μl加入0.4%台盼蓝染液10μl均匀混合,已混匀的细胞悬液沿着盖玻片边缘滴入,将计数板放置于倒置相差显微镜下观察计数,未着上色折光性强的圆形细胞为活的心肌细胞,染成蓝色的为死细胞。随机取4个视野进行细胞计数,计数心肌细胞的存活率(%)=活细胞数/(活细胞数+死细胞数)×100%,重复计数计算5次。
6.膜片钳全细胞记录:选取纹理清晰、杆状、立体感和折光性强的细胞在室温下进行实验,将细胞加入细胞池中,贴壁后开始进行实验。膜片钳记录两种方法分离细胞的起搏电流,采用EPC10放大器和Pulse软件进行记录和数据分析。细胞外液持续恒温灌流细胞池。充满电极内液后电极阻抗为 2~4MΩ,使电极与细胞表面形成高阻封接后破膜,形成全细胞记录模式,记录全细胞If电流,观察左心房细胞的电生理特性。
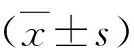
结 果
1.犬心房肌细胞形态学:心房肌细胞在显微镜下观察,改良方法获得单个细胞呈细杆状,狭长,细胞膜表面光滑,横纹清晰,立体感和折光性强,在静息状态下,细胞不发生自发性收缩;传统方法分离的单个细胞呈杆状或矩形,横纹清晰,立体感不强多呈扁平状,在静息状态下,细胞易发生自发性收缩,导致细胞死亡。细胞发生自发收缩,呈团状或椭圆形,成为死细胞。于细胞灌流槽底部的贴壁细胞,呈静息状态,结构及横纹均清晰,不发生自发性收缩,适用于膜片钳实验(图2)。
图2 两种方法分离犬心房肌细胞A.改良方法分离细胞(×200);B.改良方法分离单个细胞(×400);C.传统方法分离细胞(×200);D.传统方法分离单个细胞(×400)
2.细胞的存活情况:改良方法分离的细胞存活率为83.33%±2.87%,室温静置1h后加入含1.8mmol/L钙的细胞外液静置1h后,细胞自发收缩率为20.17%±1.42%;传统方法分离的细胞形态与上述相似,但细胞成活率约70.67%±2.88%,加钙静置1h后,27.83%±1.01%的细胞发生持续的自发收缩,死亡细胞过多,与改良后的方法比较贴壁细胞较少,膜片钳实验操作基本可行。两种方法比较,改良方法的细胞存活率显著高于传统方法 (P<0.05),改良方法的细胞自发收缩率显著低于传统方法 (P<0.05,图3)。
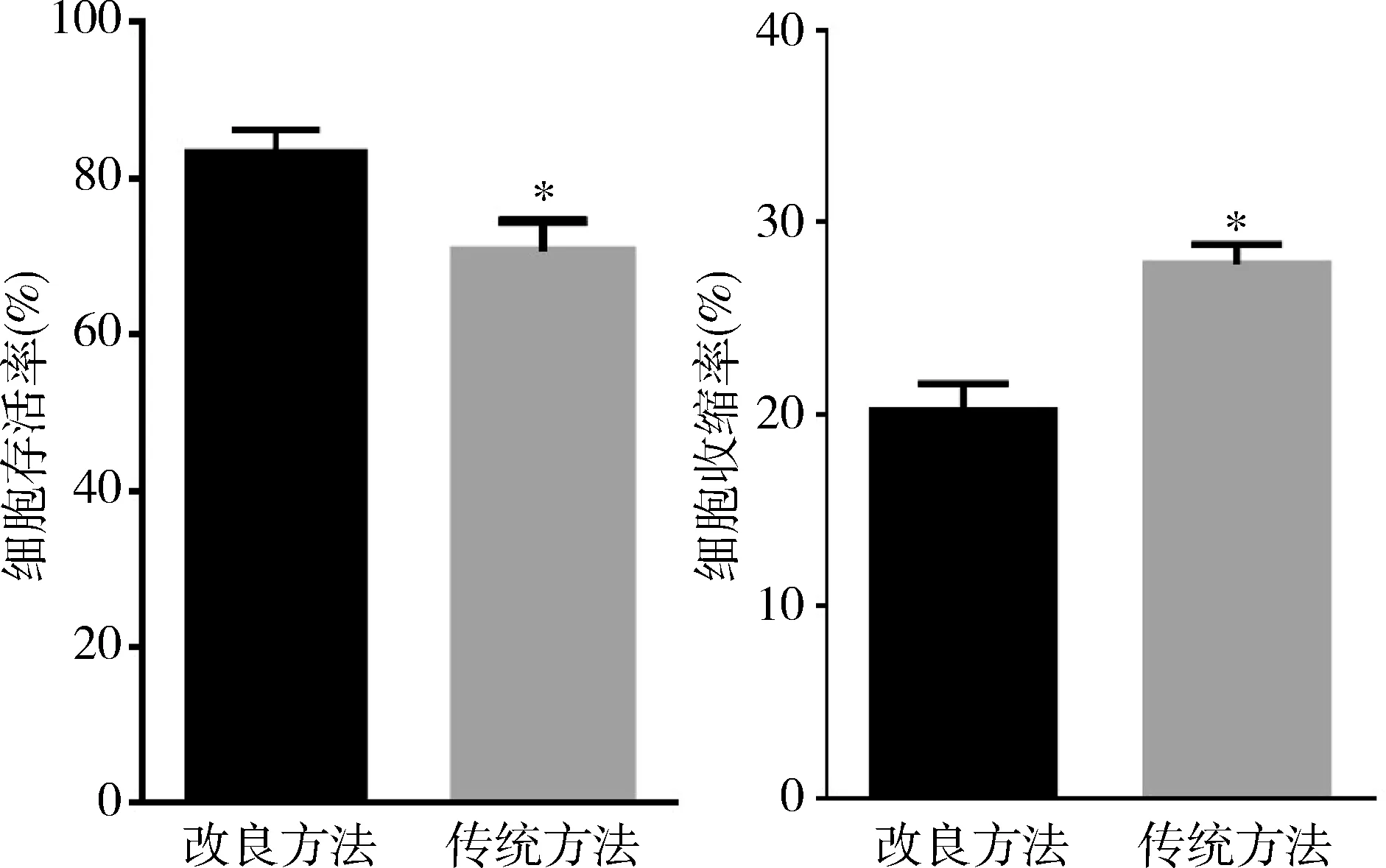
图3 两种方法分离犬心房肌细胞细胞存活与改良方法比较,*P<0.05
3.酶的使用量和酶消化时间:单个细胞分离过程中都需要使用Ⅱ型胶原酶。两种分离方法使用酶的量和酶消化时间是不同的,改良方法酶使用量为55.55±1.33mg,酶消化时间为38.50±2.02min;传统方法酶使用量为72.50±0.99mg,酶消化时间为51.67±1.52min;改良方法使用胶原酶Ⅱ和酶消化时间均显著少于传统方法(P<0.05,图4)。
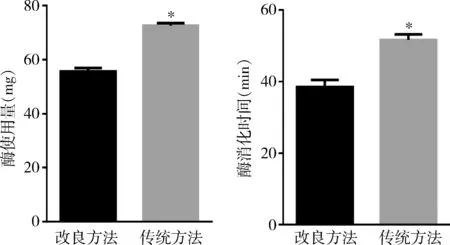
图4 分离犬心房肌细胞细胞酶使用情况与改良方法比较,*P<0.05
4.全细胞模式下记录心肌细胞起搏电流:钳制电位-40mV,给予指令测试电位逐渐降至-140mV,阶跃10mV,钳制时间2000ms。两种方法每次分离的细胞中记录同样多细胞数,成功记录电流的细胞数不同。并经χ2检验得出χ2值为23.69,P=0.000,改良方法中58.33%的细胞记录到起搏电流,传统方法中有32.78%的细胞记录到电流,详见表1。改良方法分离的细胞记录的电流大并稳定,而传统方法分离细胞记录电流相对较小且不稳定(图5)。

表1 两种方法分离细胞和记录电流的比较

图5 两种方法记录到细胞起搏电流A.改良方法记录电流;B.传统方法记录电流
讨 论
离子通道的异常可诱发心房颤动。心脏信号电传导主要利用钾、钠和钙离子通道使得心肌细胞膜两边的电压保持动态平衡,如果失去这种平衡就易发生心律失常疾病。单个心肌细胞在离子通道疾病相关的研究中日益重要[10]。早期报道采用心脏剪切成小组织块后进行消化分离单个心肌细胞,但现在普遍采用Langendorff灌流急性分离大型动物单个心肌细胞的方法[11~15]。为了能够获得高质量的心肌细胞,其分离技术方法非常关键。本研究分离心房肌细胞的方法是在本实验室原有的方法上做了部分改进[8,9]。
两种方法的不同,主要是灌流溶液前心脏的处理方式,灌流溶液顺序、消化酶的选择,详见表2。整个实验过程Langendorff 灌流系统稳定,两种方法在相同的水质、 pH值、温度条件下进行。
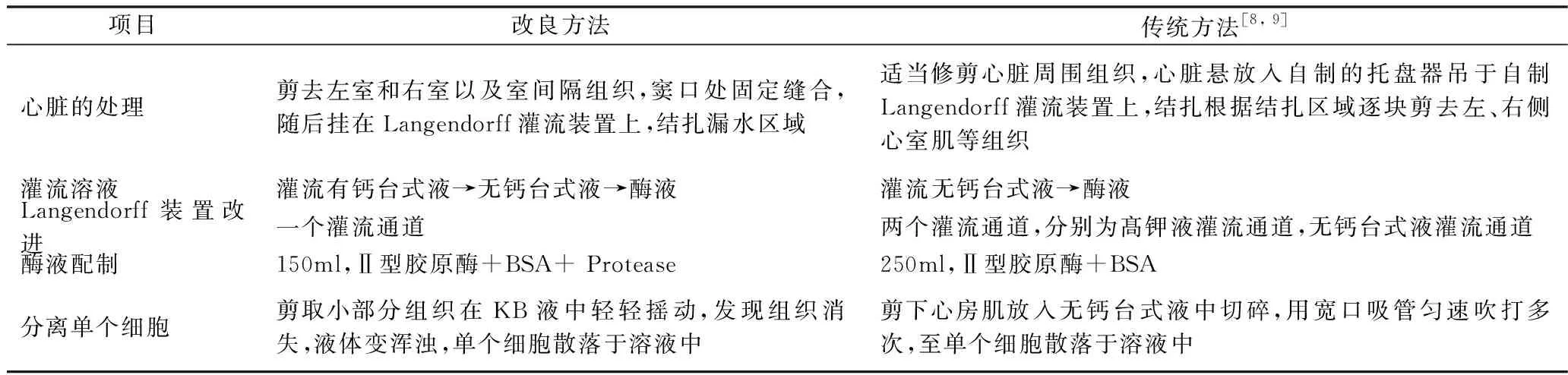
表2 两种方法的比较
取心脏时间到胶原酶灌流之间时间越短,细胞状态越好[8,9]。改良方法先进行组织的修剪,不用自制的托盘器,因组织小而减少试剂(灌流液)的使用、节约灌流的时间及结扎时间,可以缩短前期处理的时间保证细胞处于良好的状态。钙离子可以使心脏跳动,所以用含钙台式液进行灌流有效地去除心腔及血管内积血。而细胞内钙超载,细胞持续收缩,细胞的能量大量消耗而死亡,所以含钙台式液灌流后快速用无钙台式液灌流去除钙离子[16]。温度对于酶消化过程非常重要,尤其心脏表面的温度是心脏灌流是否良好的重要指标。酶消化法分离细胞过程中最佳温度在37℃左右,绝大多数实验室都是在35~37℃条件下进行酶解的[17]。Langendorff 装置的核心是多根多夫线圈,外护套由设置与水浴锅相连从而进行加热。Langendorff装置做了轻微的改变,本实验原有方法需要两个灌流通道,一个灌流高钾溶液,一个灌流酶液,改成一个灌流通道,流通时间变短,可以更好地保持通道内的温度,保证心脏表面的温度。胶原酶消化组织的能力是众所周知的,有研究发现,蛋白酶有助于心肌细胞的分离。分离细胞过程中常加入牛血清白蛋白,主要是维持细胞的渗透压和防止水肿。本实验参考 Pacioretty等[18]应用的方法,酶液使用胶原酶Ⅱ、蛋白酶和牛血清白蛋白。蛋白酶和牛血清白蛋白两种试剂可以保护细胞膜,减轻胶原酶对细胞膜的损伤。剪碎组织获得的细胞中有大量的细胞碎片,影响细胞成活率以及离子电流的记录,经过改进后有效减少细胞碎片,从而获得质量较好的单个心房肌细胞。
综上所述,两种方法分离犬心房肌细胞比较,改良方法对实验过程进行优化和改良,获得高质量、高数量的单个心房肌细胞。该方法操作简便有效,重复性强,总体时间缩短,节约试剂,细胞成活率高,细胞形态完整,进行电流的记录比较完整,更适合于膜片钳实验对离子通道疾病的研究,同时也适合其他大型动物分离心肌细胞。
