多表位丙型肝炎病毒抗原的表达和分析
2020-07-03苏秋东郭敏卓毕胜利贾志远
苏秋东 郭敏卓 伊 瑶 毕胜利 贾志远 邱 丰
丙型肝炎病毒(hepatitis C virus, HCV)属于黄病毒科肝炎病毒属,是一种由脂膜包裹的正链RNA病毒。其基因组RNA长约9600nt,包含一个多蛋白开放阅读框,编码约3000个氨基酸的多聚蛋白,结构蛋白主要有C、E1和E2,非结构蛋白主要有NS2、NS3、NS4A、NS4B、NS5A和NS5B。HCV是慢性肝炎的主要致病因子,预估全球有7110万慢性丙肝患者,约10%~20%慢性肝炎患者在20~30年里将会发展为肝纤维化和肝硬化甚至肝癌[1]。2015年全球HCV感染诊断率仅为20%,其中只有15%确诊丙肝患者得到了有效治疗,HCV的诊断治疗问题亟待解决[2]。在目前直接抗病毒(direct-acting antivirals, DAAs)疗法对HCV有效的情况下,提高诊断及治疗率对于实现世界卫生组织2030年消除病毒性肝炎的目标至关重要。
HCV实验室诊断主要包括核酸和血清学诊断。需要提取病毒核酸、受型别特异性限制、成本高以及需要专业操作是核酸检测的弊端。而血清学检测简单易行,成本低廉,所以一直是HCV临床诊断的主要辅助手段。HCV病毒蛋白 C、NS3、NS4和NS5区拥有保守的免疫显性区域[3]。因此HCV抗体检测用诊断抗原主要围绕这4个区设计。第1代HCV抗体检测使用NS4的一段抗原,第2代为包含C、NS3和NS4免疫显性区的重组抗原,目前使用的第3代检测试剂加入NS5区抗原且优化了NS3区抗原[4]。迄今已经发现HCV存在8个基因型和86个基因亚型[5,6]。因此目前常用的抗体检测试剂都使用3~6种重组抗原或合成肽,大大增加了检测成本和非特异性反应。多表位HCV诊断抗原的设计为解决这些问题提供了一条很好的途径。最早的多表位抗原出现在2006年,随后不同的设计层出不穷[7]。我国HCV主要流行亚型为1b和2a[8]。此研究将这两种主要流行亚型的6个主要免疫区域进行串联,制备新型HCV抗体诊断抗原,并利用阴阳性血清评价其诊断效能。
材料与方法
1.主要材料与试剂:BL21(DE3)感受态细胞购自北京全式金生物技术有限公司。M48载体,为本科室构建,由pET43.1a载体,在Nde Ⅰ和Nco Ⅰ酶切位点之间插入Trx标签改造所得。限制性内切酶NcoⅠ和XhoⅠ以及T4 DNA连接酶购自美国NEB公司。预螯合Ni2+亲和层析介质为美国GE公司产品。山羊抗人IgG H&L(HRP)酶标物为英国Abcam公司产品。50份HCV阳性血清参照WS213-2018丙型肝炎诊断标准:①生化指标异常;②血液抗-HCV阳性;③血液HCV RNA阳性,核酸定量范围为4.97(4.52,6.34)[Log转换,中位数(Q1,Q3)];④来源于科室现存血清库。50份HCV阴性血清:①血液抗-HCV阴性;②血液HCV RNA阴性;③来源于科室现存血清库。HAV、HBV、HDV及HEV阳性血清各20份,由实验室和临床确诊,来源于科室现存血清库。
2.HCV多表位诊断抗原表达质粒的制备:根据参考文献[4,9~13]与相关经验,将HCV NS3(1b)aa 1201-1464、Core(1b)aa 1-34、NS4A(1b)aa 1681-1735、NS4A(2a)aa 1681-1735、NS4B(2a) aa 1929-1935及NS5A(2a)aa 2273-2307等6个抗原区域用(GGGS)3进行串联,5′端添加CCATGG(Nco Ⅰ)酶切位点,3′端添加CTCGAG(Xho Ⅰ)酶切位点,密码子优化后交由日本TaKaRa公司进行基因合成,命名为H65F。利用Nco Ⅰ和Xho Ⅰ限制性内切酶及T4 DNA连接酶将H65F亚克隆到M48表达载体上,转化BL21(DE3)感受态细胞。16h后挑取6个单菌落(1~6号)接种于2ml培养基中(10g/L蛋白胨,5g/L酵母提取液,10g/L NaCl,50μg/ml氨苄霉素)振荡培养,诱导进行小量表达,提取质粒进行测序并双酶切鉴定,验证正确的质粒命名为H65。
3.HCV多表位诊断抗原的制备:选择4号作为菌株进行大量表达(3L),诱导条件为30℃,1mmol/L IPTG,5h。离心(3500r/min, 10min, 4℃)收集沉淀,用溶解缓冲液(20mmol/L 磷酸盐缓冲液,20mmol/L咪唑,0.5mol/L NaCl,pH 7.0)重悬后用超声仪破碎(功率300W,超声时间20s,间歇时间20s,共20个循环),离心(11000r/min, 10min, 4℃)收集上清。将上清加载于预螯合Ni2+亲和层析介质中。分别用0、0.1、0.5mol/L咪唑(溶于溶解缓冲液中)进行梯度洗脱。取样进行SDS-PAGE(恒流35mA,45min)电泳,分析H65蛋白的含量以及分布情况。将H65蛋白蛋白含量最高、纯度最好的洗脱液于PBS (137mmol/L NaCl,2.7mmol/L KCl,10mmol/L Na2HPO4,2mmol/L KH2PO4, pH 7.4)中透析,并于0℃保存备用。
4.HCV多表位诊断抗原抗原性初步分析:H65蛋白抗原性的初步分析利用Western blot法检测。取10μl透析后H65蛋白进行SDS-PAGE电泳(恒流35mA,45min),半干转膜法(恒压15V,35min)至PVDF膜上。室温,封闭液(1% BSA,0.05% 吐温-20,溶于PBS中)振荡孵育PVDF膜1h。室温,1∶10稀释HCV阴阳性血清后分别处理两块PVDF膜1h,而后用PBS洗膜10min。用山羊抗人IgG H&L(HRP)酶标物(1∶5000)室温处理PVDF膜1h后用高盐缓冲液(0.5mol NaCl,0.2% SDS,溶于PBS中)洗膜30min后超纯水洗膜,用DAB显色,清水终止显色。
5.HCV多表位诊断抗原诊断效能评价:利用蛋白H65建立血清HCV-IgG抗体检测间接法ELISA试剂盒,对“金标准”确诊的阴阳性血清样本以及其他肝炎病毒阳性标本进行检测,评价其对阴阳性血清标本的鉴别能力,并与某商品化试剂盒进行比较,评价其优劣。包被缓冲液(50mmol/L碳酸盐缓冲液,pH 9.6)1∶300稀释蛋白H65后加入ELISA板中,37℃孵育2h。37℃,封闭液孵育1h后用PBST洗涤。每孔加PBS和待测血清各50μl,37℃孵育1h后洗涤;加入山羊抗人IgG H&L(HRP)酶标物(1∶6000),37℃孵育1h后洗涤;加新鲜配制TMB液显色,2mol/L H2SO4终止反应。用酶标仪测定450nm处各孔吸收度值(A值)。
利用某商品化HCV-IgG ELISA检测试剂盒检测待测同批血清,具体操作遵循厂家说明书,最后用酶标仪测定450nm处吸收度值(A值)。
6.统计学方法:实验数据采用SPSS 22.0统计学软件进行统计分析,用GraphPad Prism 8.00软件绘制6组血清A值散点图。对HCV阴阳性两组血清A值分布进行Wilcox检验(独立样本Mann-WhitneyU检验),原假设为在两组类别上,A值分布相同。根据经验选取阴性血清A值均值2.1倍作为临界值。用McNemer检验及Kappa一致性检验评价两种检测方法的一致性,以P<0.05为差异有统计学意义。
结 果
1.融合表达层析纯化可获得高纯度蛋白H65:HCV 6个抗原区域用(GGGS)3串联并进行密码子优化后,片段大小为1608bp(图1A),构建好的表达质粒经测序、双酶切鉴定(图1B)及小量表达(图2A)证实构建成功,命名为H65质粒。
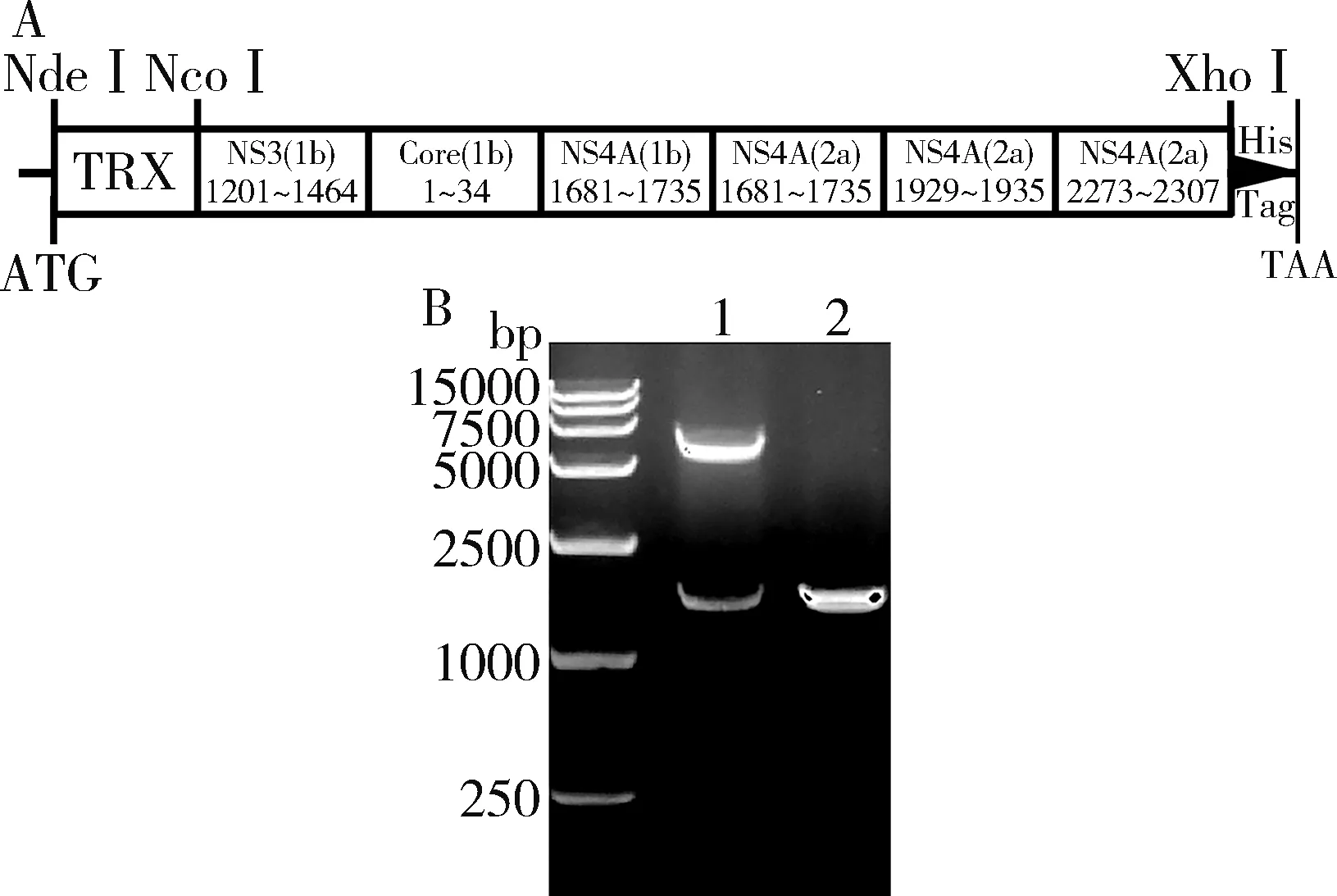
图1 H65表达质粒的构建A.H65表达区段示意图;B.H65表达质粒的鉴定;1.H65表达质粒双酶切鉴定;2.H65基因片段
H65蛋白小量表达SDS-PAGE结果发现,与未诱导菌比较,诱导菌组在约74.2kDa处有明显表达条带(图2A),H65蛋白在大肠杆菌中表达良好。大量表达(3L)发现H65蛋白占菌体总蛋白的39.82%(图2B)。超声处理后发现蛋白H65主要存在上清中(图2B)。经亲和层析纯化后H65蛋白主要存在于0.5mol/L咪唑洗脱液中,浓度为2.991mg/ml,纯度为94.53%(图2B)。
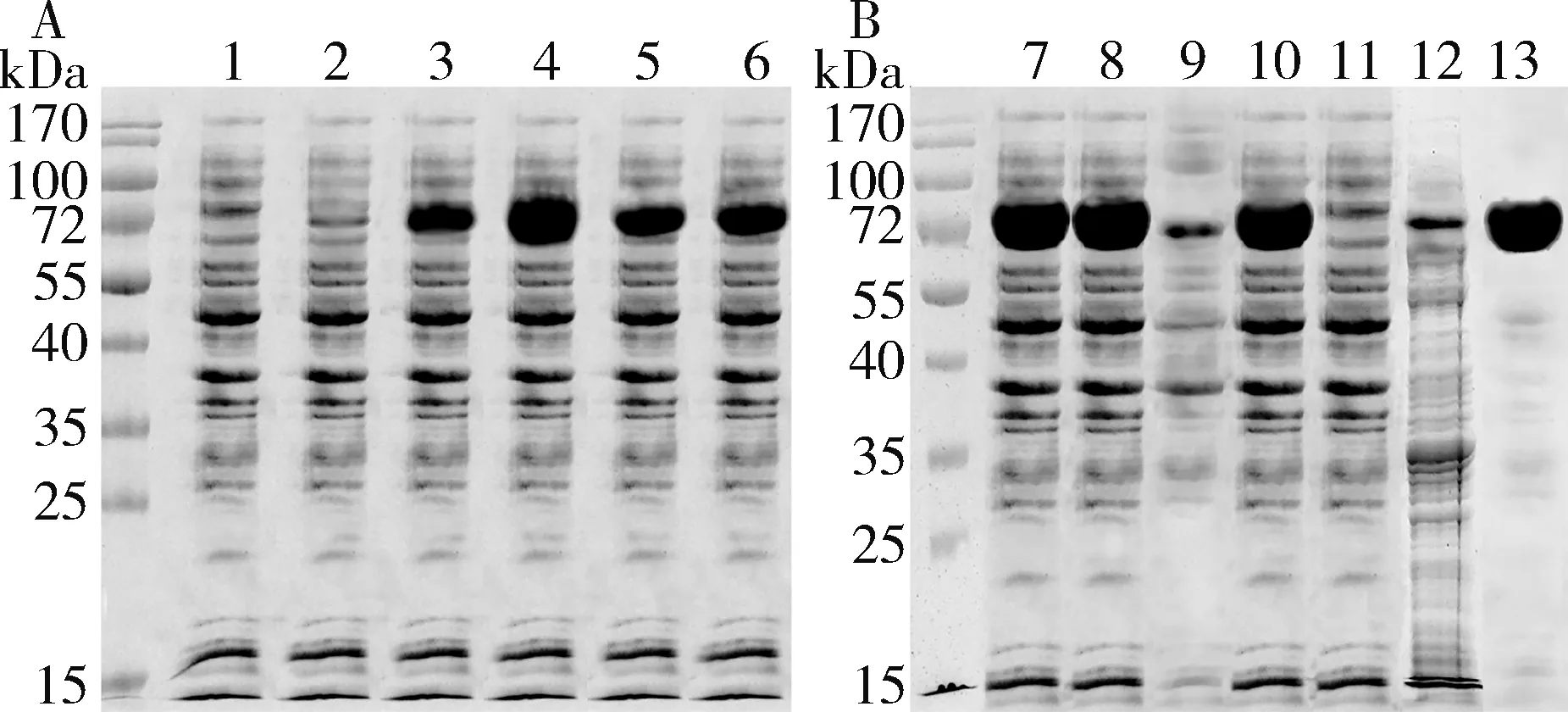
图2 蛋白H65表达及纯化电泳分析A.小量表达;B.大量表达及纯化。1.未诱导菌;2~6.诱导菌;7.超声后总菌体蛋白;8.超声液上清;9.超声液沉淀;10.亲和层析上样;11.穿柱;12.0.1mol/L咪唑洗脱液;13.0.5mol/L咪唑洗脱液
2.蛋白H65可以与HCV-IgG阳性血清发生特异性反应:利用Western blot法,初步鉴定蛋白H65的抗原性。HCV阳性血清作为一抗,山羊抗人IgG H&L(HRP)酶标物作为二抗,在NC膜上相应位置出现了明显条带(图3A);而HCV阴性血清作为一抗,在NC膜上相应位置无条带(图3B)。并且无论是用HCV阴阳性血清,无蛋白H65表达菌(空载体)都未见明显条带(图3)。
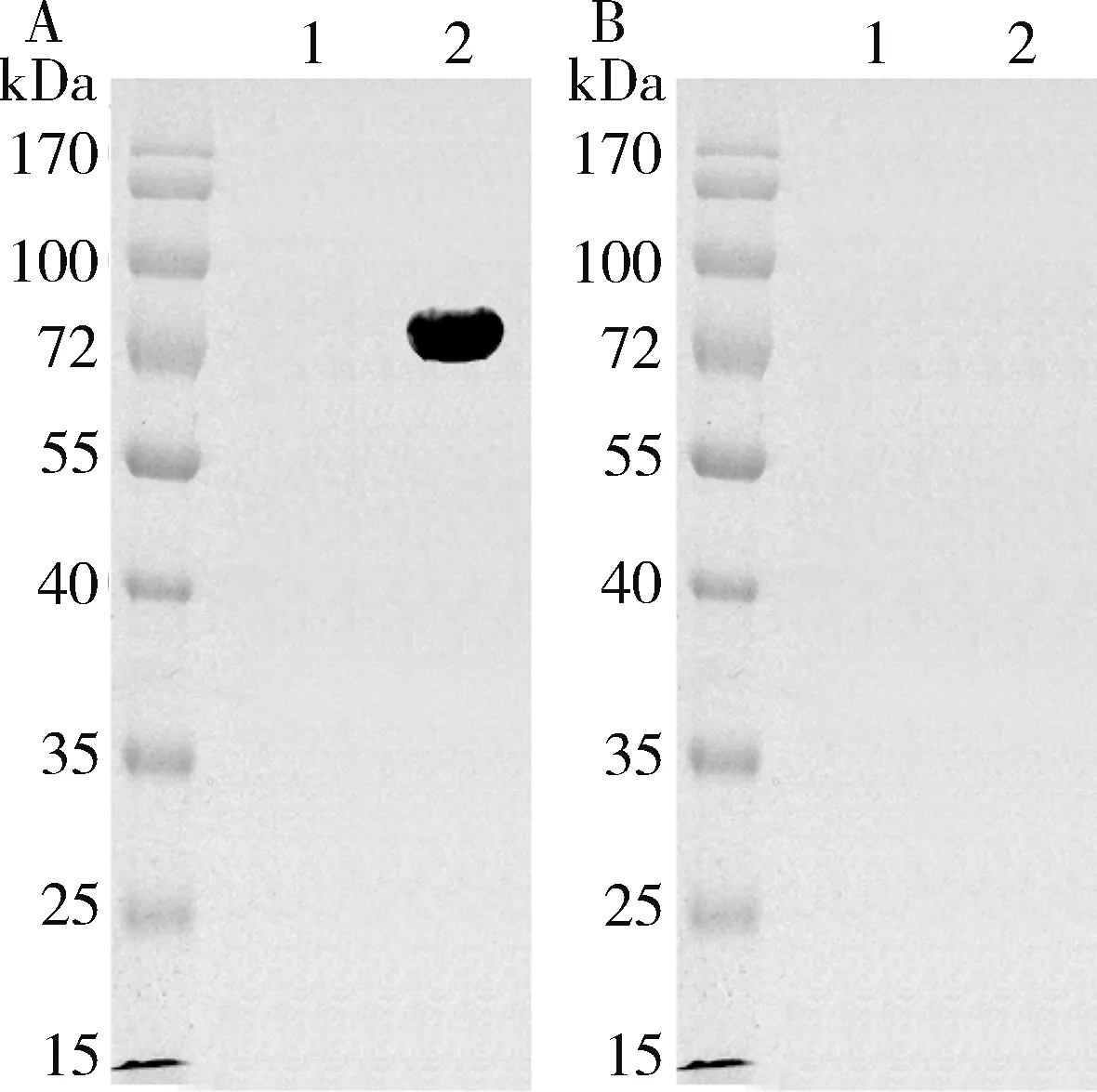
图3 蛋白H65的Western blot法分析A.HCV阳性血清作为第一抗体,羊抗人IgG H&L (HRP)作为第二抗体;B.HCV阴性血清作为第一抗体,羊抗人IgG H&L(HRP)作为第二抗体;1.阴性对照;2.H65蛋白
3.基于蛋白H65的间接法ELISA可以很好地鉴别HCV-IgG阴阳性血清标本:蛋白H65作为包被抗原建立间接法ELISA试剂,分别对50份HCV阳性和阴性血清样本进行检测。阳性样本A值分布为1.487±0.055,阴性血清样本A值分布为0.082±0.007。两组数据分布比较使用Wilcox检验,结果发现两组数据分布明显不同(P<0.01),根据经验阴性血清A值均值2.1倍作为临界值得出临界值为0.171。McNemer检验显示结果,新制备诊断试剂与“金标准”比较,P=1.00,Kappa=0.940,提示诊断结果与“金标准”一致性优异。

图4 蛋白H65在HCV感染血清学诊断效果P.阳性血清;N.阴性血清
应用某商品化试剂盒检测相同的血清(按照说明书判定阴阳性),阳性结果46份(46/50),阴性结果44份(44/50)。与新型试剂盒进行比较,详见表1,进行McNemer检验发现,P=1.00,Kappa=0.900。
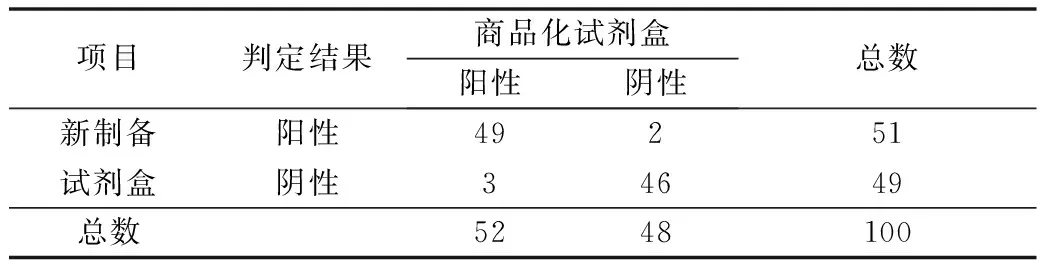
表1 新制备与商品化试剂盒比较(n)
讨 论
多表位抗原区域的选择依赖于4个关键因素:①免疫显性区域;②对HCV抗体特异;③属于线性或连续性表位;④在不同基因型之间进化保守[4]。除了NS3区抗原区段大小达到264个氨基酸外,其他5个抗原区段大小都低于60个氨基酸。Palenzuela等[14]推论NS3蛋白所表现出的高免疫原性很可能是由构象型表位触发的,因此为了促使NS3区构象型表位的形成,在其区域片段的选择上并没有局限于文献所报道的表位区域。同样,其他5个免疫显性区域的选择也在文献报道表位区的基础上上下游延伸部分氨基酸,以尽力确保完整表位的展现[15,16]。考虑到我国HCV的主要流行株为1b和2a,尤其是1b占主导地位[8]。因此在抗原区域的选择上,NS3、C和NS4A选取1b基因亚型,NS4A、NS4B和NS5A选取2a基因亚型。其中NS4A在1b和2a基因亚型中不保守,因此共存了这两个相似表位[17]。
多表位串联表达增加了蛋白高级结构的呈现及表达的难度[18]。首先,表位区域上下游的延伸以及GGGS连接臂的加入大大降低了各抗原区域之间的相互影响。选取的免疫显性区主要为线性表位,加之连接臂的存在,大大降低了错误折叠的发生。其次,Trx标签的融合,大大提高了可溶性表达的概率。再者,密码子的优化并不单单考虑最优密码子的替换,同时还考虑了转录和翻译以及核酸二级结构的动能变化。最后,表达条件的优化让大部分目的蛋白以可溶性形式存在,且表达量占菌体总蛋白的39.82%(图2B)。
基于多表位HCV诊断抗原建立的间接法ELISA敏感度为98.00%(cut-off值为0.171),特异性为96.00%,阳性预测值为96.08%,阴性预测值为97.96%,符合率为97.00%。虽然与某商品化试剂盒比较不能否定一致性检验存在差异(Kappa=0.900),但参考上述指标,新制备检测试剂更加优异。而且包被抗原只使用1个融合蛋白,相对于传统诊断试剂使用3~6个融合蛋白大大降低了诊断试剂的成本以及假阳性结果的出现,为血清学诊断的普遍使用及HCV诊断率的提高奠定基础[19]。
本研究不足之处在于没有评价新制备试剂对不同基因型HCV血清标本的诊断效能。下一步工作将利用不同基因型(对HCV 1b和2a基因型血清标本诊断效能优异,数据未发表)血清对抗原的诊断效能进行全面评价。
总之,多表位HCV诊断抗原能够在原核表达系统中可溶性表达,以这一融合蛋白建立的间接法ELISA能够对HCV阴阳性血清标本鉴别诊断。
