Kv1.3钾通道调节人脐静脉内皮细胞LOX-1受体摄取oxLDL
2020-07-03韩一品
何 军 韩一品 孙 宾 王 浩 杨 震
电压门控性钾通道Kv1.3是维持细胞静息膜电位最重要的离子通道之一,在细胞生理性电活动和心律失常中发挥重要作用。人类的Kv1.3钾通道由位于染色体1P13.3的Kv1.3基因(又称KCNA3基因)编码,含523个氨基酸,其结构由4个相同的α亚基组成,每个亚基包括1个N-末端、6个跨膜片段(S1~S6)和1个C-末端[1]。研究发现,Kv1.3的特异性阻断剂Margatoxin可以显著降低人巨噬细胞内胆固醇含量、抑制泡沫细胞形成[2]。给予动脉粥样硬化大鼠皮下注射Kv1.3的另一种特异性阻断剂海葵神经毒素ShK,可使主动脉内膜增厚和中层平滑肌排列紊乱减轻[3]。这些研究提示Kv1.3 可促进动脉粥样硬化,但详细机制并不十分明了。
血凝素样氧化型低密度脂蛋白受体-1(lectin-like oxidized low density lipoprotein receptor-1,LOX-1)是内皮细胞主要的氧化型低密度脂蛋白(oxidized low density lipoprotein, oxLDL)受体,最早是由牛主动脉内皮细胞克隆所得[4,5]。目前有研究者认为LOX-1也属一种动脉硬化发生前的致炎性细胞因子,可通过多条信号通路促进内皮细胞激活、增殖和凋亡相关基因的表达, 在内皮细胞转变为泡沫细胞的过程中发挥重要作用[6]。近年来研究发现,临床广泛使用的某些他汀类药物不仅可使粥样斑块退缩,还有抗心律失常的作用,提示动脉粥样硬化与心律失常间可能有共同的分子调控机制,也可能二者相互调控。由此笔者设想,Kv1.3通过调节LOX-1摄取oxLDL而促进泡沫细胞形成,进而参与动脉粥样硬化的形成。本研究通过慢病毒介导的细胞感染、全细胞膜片钳技术和Western blot等方法检测发现,上调或下调人脐静脉内皮细胞(human umbilical vein endothelial cells, HUVECs)的Kv1.3蛋白表达水平后,在细胞膜钾电流发生明显变化的同时,还引起细胞LOX-1表达水平、细胞内脂质和胆固醇水平的显著变化。由此,笔者认为Kv1.3通过LOX-1参与调节了HUVECs摄入oxLDL。本研究为阐明LOX-1结合oxLDL的电压依赖性机制增添了新的实验证据,也为阐释Kv1.3参与动脉粥样硬化的相关研究打开了新的视角。
材料与方法
1.细胞培养:HUVECs以含10%胎牛血清的DMEM培养基,置5% CO2、37℃饱和湿度的培养箱中培养。
2.慢病毒载体构建与包装:重组表达质粒(包括shRNA干扰慢病毒表达载体LV3-pGLV-h1-GFP-puro、Kv1.3过表达慢病毒表达载体LV5-EF1a-GFP-Puro)和包装质粒(pGag/Pol、pRev、pVSV-G)由上海吉玛公司构建制备。采用无内毒素质粒抽提试剂盒(德国QIAGEN公司,货号12362)抽提质粒DNA,质粒DNA 溶于除菌的TE 缓冲液中,以紫外光吸收法测定其浓度及纯度,保证所提质粒DNAA260/A280为1.8~2.0。以293T细胞包装载体,获得效价≥1×108TU/ml的慢病毒原液。
3.稳定表达Kv1.3的HUVEC的筛选与鉴定:取病毒原液以适当MOI感染HUVECs细胞,72h后加入Puromycin(终浓度2μg/ml)。之后每2~3天换一次含Puromycin的新鲜培养液。药物筛选约7天后,收集细胞,提取总RNA和总蛋白,行PCR和Western blot法以验证Kv1.3上调和下调的效果。
4.HUVEC膜电位检测:采用手动膜片钳技术,记录Kv1.3基因过表达和下调的HUVECs 膜电位变化。将1ml含HUVECs的外液加入膜片钳小槽中,待细胞沉降至底部,开始钳夹细胞,全细胞记录模式形成后运行Kv1.3(I/V曲线)程序。实验重复3次。将不同去极化电压下记录到的Kv1.3电流密度作纵坐标、以去极化电压为横坐标制作I/V曲线:每10s 脉冲刺激细胞记录Kv1.3钾电流峰值,即先将电压钳制在-80mV,给予细胞持续500ms去极化,刺激电压步阶为10mV。
5.油红O染色:油红O溶液配制:1g油红O干粉加100ml异丙醇,60℃水浴使充分溶解成母液,4℃避光保存。使用前母液与超净水以3∶2混匀并用无菌过滤器过滤,此为工作液。染色:吸去培养液,以PBS洗HUVECs 3次,以4%甲醛室温固定1h,再以PBS洗细胞1次,加入油红O工作液染色30min。富含脂质的细胞被染成红色。染色完毕在显微镜下观察并拍照。
6.HUVECs内胆固醇含量测定:利用比色法检测HUVECs胆固醇水平,试剂盒(货号A111-2)购自南京建成生物工程研究所。实验步骤如下:将Kv1.3过表达和下调表达的HUVECs分别与oxLDL(终浓度60μg/ml)共孵育48h后,收集细胞进行检测。样本中加0.5ml PBS,置冰水中旋转碾磨3min,取样50μl测定。将各管反应物混匀、37℃反应5min,500nm测定各管A值。计算公式如下:TC含量(mmol/g 蛋白质)=[(样本管A-空白管A)÷(校准管A-空白管A)]×标准品浓度(5.17mmol/L)÷5÷待测样本蛋白浓度(mg/ml)。
7.Western blot法检测:应用RIPA Buffer(美国Sigma公司,货号R0278)提取HUVECs总蛋白,简述如下:将各组细胞以冰浴的PBS洗1次,加入适量RIPA Buffer,置冰上5min后,快速刮下细胞并转至EP管,置冰上裂解15min后,8000×g、4℃离心15min,收集上清。采用Bio-Rad DC 蛋白检测试剂盒(英国Bio-Rad Laboratories有限公司, 货号500-0116)测定蛋白浓度。采用12% SDS-PAGE进行凝胶电泳,半干式转移法转至硝酸纤维素膜,5%脱脂奶粉封闭后,用相应的一抗杂交,继之以辣根过氧化酶标记的二抗孵育。应用ECL Select (美国GE Healthcare公司, 货号RPN2235) 使二抗显影,采用Multi Doc-it 图像分析系统(美国UVP有限公司)成像,灰度定量分析采用Image J软件。所用一抗信息如下:anti-Kv1.3 (美国Sigma公司,货号WH0003738M1,1∶500),anti-LOX-1(英国Abcam公司,货号ab60178,1∶300), anti-P38(美国Cell Signaling Technologies公司,货号9212,1∶1000),anti-p-P38(美国Cell Signaling Technologies公司,货号9211, 1∶1000),anti-GAPDH(康成生物,货号KC-5G4, 1∶5000),anti-β-actin(北京博奥森生物技术有限公司,货号bs-0061R,1∶3000)。

结 果
1.Kv1.3干扰效率和过表达效率检测:与病毒对照组比较,shRNA950组和shRNA1646组Kv1.3 mRNA表达水平降低(P均<0.05)。经Western blot法检测,仅shRNA950组Kv1.3蛋白水平降低,与病毒对照组比较,差异有统计学意义(P<0.05),说明利用该干扰病毒可达到下调Kv1.3蛋白表达的目的,故后续下调Kv1.3蛋白表达相关的实验均采用shRNA950干扰载体(图1)。
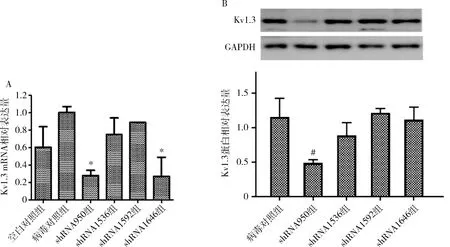
图1 shRNA干扰效率鉴定结果(HUVECs感染7天)A.Kv1.3 mRNA表达水平,与空白对照组比较,*P<0.05;B.Kv1.3 蛋白表达水平,与病毒对照组比较,#P<0.05
Kv1.3过表达载体组Kv1.3 mRNA水平(图2A)和蛋白表达水平(图2B)与空白对照组比较明显升高,差异均有统计学意义(P<0.05),说明载体构建是成功的。

图2 Kv1.3过表达效率鉴定结果(HUVECs感染7天)A.Kv1.3 mRNA表达水平;B.Kv1.3 蛋白表达水平。与空白对照组比较,*P<0.05,**P<0.01
2.HUVEC细胞Kv1.3电流变化:随着去极化电压的增大,Kv1.3过表达组(红线)和对照组(黑线)的钾电流密度均增大,以过表达组更甚,当电压为-10mV和0mV时,电流密度在两组间的差异有统计学意义(P均<0.05)。以钾通道阻滞剂Quinidine(奎尼丁)处理细胞后,钾电流密度呈降低趋势(蓝线),见图3A。以shRNA950干扰载体感染HUVECs使Kv1.3蛋白表达下调后(红线),细胞钾电流密度较对照组(黑线)降低,且在去极化电压为-30mV时二者之间比较,差异有统计学意义(P<0.05),见图3B。
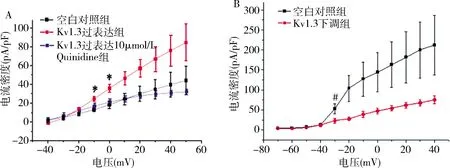
图3 HUVECsKv1.3电流I/V曲线A.与空白对照组比较,*P<0.05;B.与Kv1.3下调组比较,#P<0.05
3.油红O染色结果:油红O染色后HUVECs内的脂肪滴呈红色,细胞核呈蓝色。图中可见,Kv1.3过表达组多数细胞胞质内出现红色脂滴,部分细胞核固缩;空白对照组细胞胞质内可见少量淡红色着色,细胞核呈圆形或卵圆形(图4)。
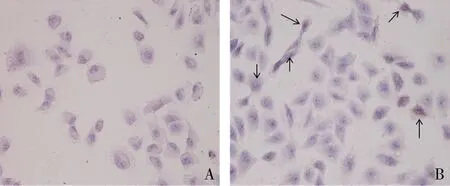
图4 HUVECs油红O染色结果(×200)A.空白对照组;B.过表达组;箭头所示为细胞内红染的脂滴
4.HUVECs内胆固醇相对含量测定结果:以oxLDL孵育细胞后,oxLDL组和(Kv1.3过表达+oxLDL)组(图中标为“过表达”)HUVECs内胆固醇相对含量均高于空白对照组,差异均有统计学意义(P均<0.01)。而且,Kv1.3过表达+oxLDL组的胆固醇相对含量高于oxLDL组,二者之间比较差异有统计学意义(P<0.01)。以shRNA950干扰载体下调HUVECs Kv1.3 蛋白表达,并以oxLDL处理细胞后,shRNA950+oxLDL组胆固醇相对含量较oxLDL组降低,差异有统计学意义(P<0.05,图5)。
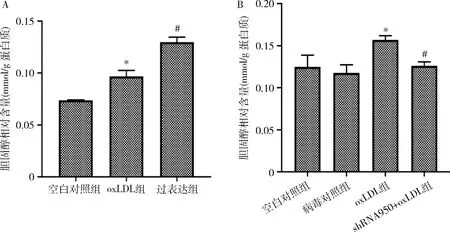
图5 HUVECs内胆固醇相对含量测定结果A.上调Kv1.3表达后HUVECs内胆固醇食量增加;B.下调Kv1.3表达后HUVECs内胆固醇含量减少。与空白对照组比较,*P<0.05;与oxLDL组比较,#P<0.05
5.Kv1.3上调/下调后LOX-1蛋白表达变化:上调Kv1.3蛋白表达后,LOX-1蛋白表达量较对照组升高,差异有统计学意义(P<0.05)。以shRNA950干扰慢病毒下调Kv1.3蛋白表达后,LOX-1蛋白表达水平较空白对照组降低,两组间比较差异有统计学意义(P<0.01,图6)。
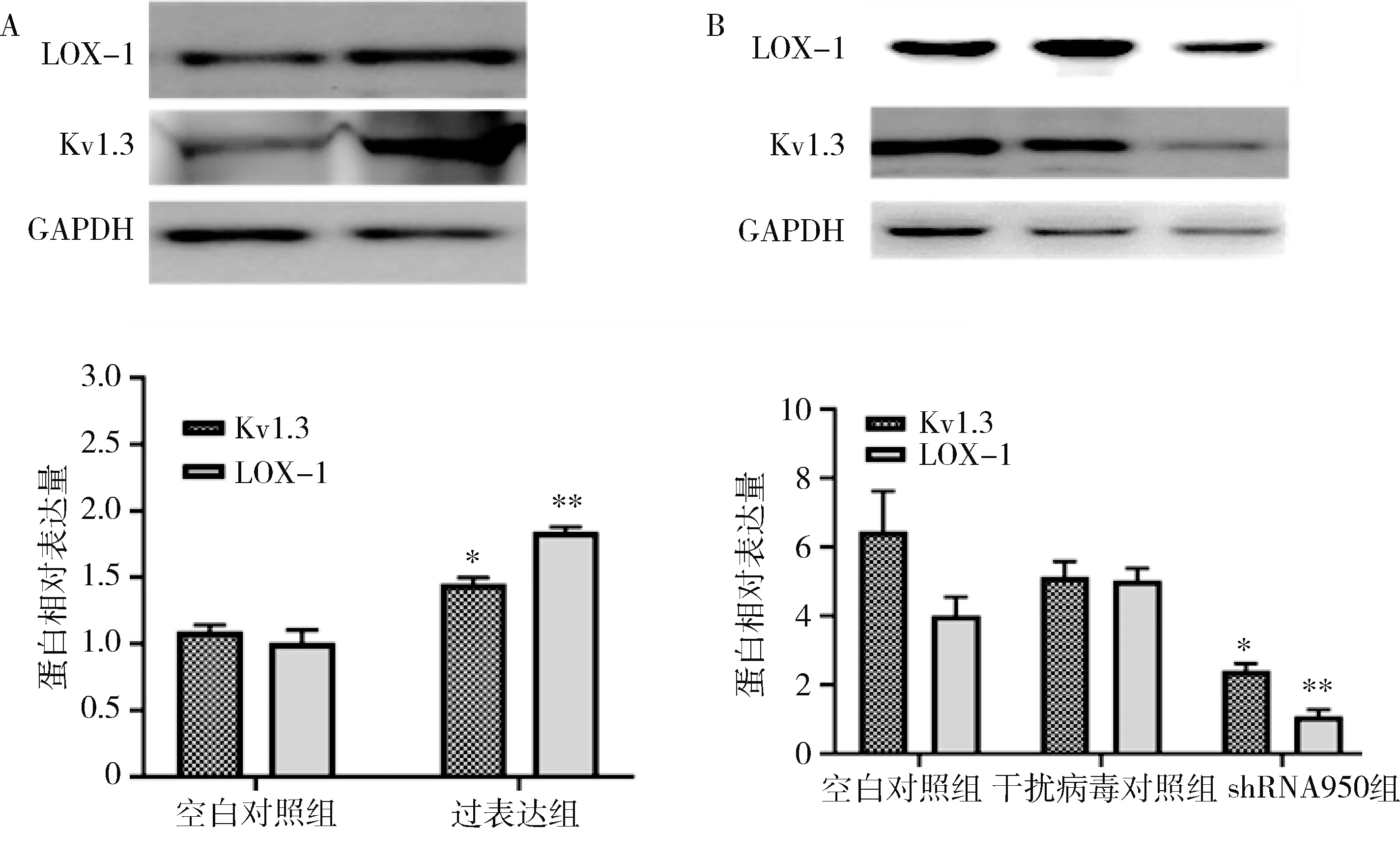
图6 Western blot法测定LOX-1蛋白水平A.上调Kv1.3表达后LOX-1蛋白水平;B.下调Kv1.3表达后LOX-1蛋白水平。与空白对照组比较,*P<0.05,**P<0.01
6.Kv1.3上调/下调后p38和磷酸化p38蛋白表达变化:HUVECs给予oxLDL处理后,Kv1.3过表达组的p-p38/p38比值较对照组二者的比值升高,组间差异有统计学意义(P<0.01)。将HUVECs以oxLDL处理后,Kv1.3敲低组的p-p38/p38比值较空白对照组的比值降低,差异有统计学意义(P<0.01)。Kv1.3蛋白水平变化引起的p38蛋白磷酸化水平的改变呈oxLDL依赖性(图7)。
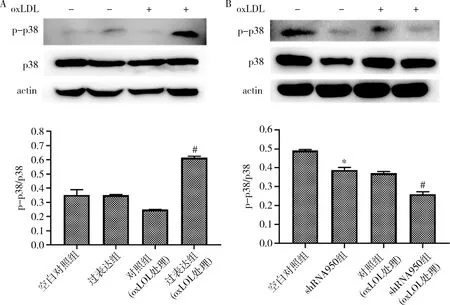
图7 Western blot法检测p38与磷酸化p38蛋白表达水平A.Kv1.3表达上调后p-p38/p38测定结果;B.Kv1.3表达下调后p-p38/p38测定结果。与空白对照组比较,*P<0.05;与对照组(oxLDL处理)比较,#P<0.01
讨 论
LOX-1是一种相对分子质量为50kDa的Ⅱ型膜蛋白,结构上属于C型血凝素家族,是内皮细胞摄取oxLDL最重要的清道夫受体之一,但在结构上与其他类型的清道夫受体无同源性。LOX-1基因位于人第12号染色体上,由4个结构域组成,即胞质结构域、跨膜结构域及胞外的颈结构域和血凝素样结构域[7]。血凝素样功能结构域具有高度保守性,该结构域维持正电荷对LOX-1结合oxLDL极其重要[8]。LOX-1最初被认为是内皮细胞摄入oxLDL的主要受体,后来发现它也是巨噬细胞和血管平滑肌细胞重要的oxLDL受体,因此,在泡沫细胞和粥样斑块形成中扮演重要角色。笔者前期研究发现,oxLDL以时间和剂量依赖的方式促进大鼠腹腔巨噬细胞LOX-1表达[9]。以高脂饲料喂养大鼠18周后,其主动脉LOX-1 mRNA和蛋白表达量增加[10]。近期有研究发现,急性冠状动脉综合征患者粥样硬化斑块处的冠状动脉和梗死心肌LOX-1蛋白表达增加,急性缺血性脑卒中患者脑血栓处LOX-1蛋白表达量升高,同时,患者血清可溶性LOX-1水平升高[11]。细胞LOX-1的表达水平主要受其配体调节,包括各种修饰的LDL、激活的血小板、糖基化终产物、凋亡小体、细菌和C反应蛋白[12]。近年来研究发现,缺血、缺氧、镰刀形红细胞也促进LOX-1蛋白表达[4,13]。随着越来越多LOX-1相关研究的开展,会有新的调节因子被发现,人们对LOX-1的功能与调控的认识也势必会更新。
Kv1.3主要分布于T淋巴细胞、肾细胞和神经细胞膜表面。新疆哈萨克族高血压病患者T淋巴细胞Kv1.3钾电流密度增高,可能与T淋巴细胞的激活有关[14]。Kv1.3的特异性抗体可降低暴露于oxLDL的人单核细胞源性巨噬细胞内胆固醇酯的含量、下调巨噬细胞LOX-1表达水平[15]。本研究中,笔者利用携带Kv1.3基因的慢病毒载体使Kv1.3在HUVECs呈过表达或低表达,观察LOX-1的蛋白表达与功能是否随之改变。
本研究发现,感染了Kv1.3干扰慢病毒和过表达慢病毒的HUVECs,其Kv1.3 mRNA和蛋白表达水平分别显著降低和升高(图1、图2)。膜片钳技术记录到HUVECs外向延迟钾电流的I/V曲线明显下移和上移,同时,上调Kv1.3蛋白表达引起的外向延迟钾电流密度增加可被钾通道阻滞剂奎尼丁所抑制(图3)。这些数据表明,本研究不但使HUVECs的Kv1.3蛋白表达上调和下调,其钾通道功能活性也发生了相应的改变,意味着后续的研究具备了可靠的细胞模型。
LDL被氧化修饰为oxLDL后,不仅加重血管内皮损伤,还经LOX-1及其他清道夫受体进入细胞,先转变为泡沫细胞、再逐渐形成脂质条纹和粥样斑块。为了明确Kv1.3对HUVECs细胞摄取oxLDL的影响,本研究首先将oxLDL与HUVECs共孵育,经油红O染色发现,Kv1.3过表达组多数细胞胞质内出现红色脂滴,部分细胞核固缩;对照组胞质内仅见少量淡红色着色,细胞核呈圆形或卵圆形(图4)。然后经检测发现,Kv1.3表达量上调后,细胞内胆固醇含量明显升高,而下调Kv1.3导致胆固醇含量显著降低(图5)。接着,笔者通过Western blot法检测发现,Kv1.3的上调或下调伴随着LOX-1蛋白表达量的增强或减弱(图6)。以上实验结果表明,HUVECs内胆固醇含量与Kv1.3蛋白表达水平有关,而Kv1.3对LOX-1表达水平的调节可能是其内在原因。
研究表明,LOX-1经p38MAPK信号通路引起内皮细胞损伤、形成泡沫细胞[7,10]。笔者经Western blot 法检测发现,上调Kv1.3后p38蛋白磷酸化水平明显升高,下调Kv1.3引起p38蛋白磷酸化水平显著降低,而且呈oxLDL依赖性(图7)。该结果提示,p38信号通路可被oxLDL激活,并可能参与调控HUVECs膜受体LOX-1摄入oxLDL。
基于以上的研究数据,笔者认为钾通道Kv1.3不仅参与调节HUVECs LOX-1的表达水平,还因此调节HUVECs摄取oxLDL,该效应的实现与p38信号转导通路有关。本研究为Kv1.3参与动脉粥样硬化形成增添了新的实验依据,也令人们更加相信粥样斑块形成与心律失常发生机制密切相关。
