一种基于分子内质子转移发色团的硫化氢荧光探针的合成及其生物成像研究
2020-07-03刘存飞刘梦琴唐斯萍韩路娇唐东晴
阳 茜,刘存飞,刘梦琴,唐斯萍,胡 萌,韩路娇,唐东晴,谷 标
(衡阳师范学院 化学与材料科学学院 功能金属有机化合物湖南省高校重点实验室,湖南 衡阳 421008)
硫化氢是生物体内的重要气体信号分子之一[1]。内源性的硫化氢由某些特定酶,如胱硫醚β-合成酶、胱硫醚γ-裂解酶和3-巯基丙酮酸硫转移酶催化产生[2]。细胞内的硫化氢参与许多生理过程,包括血管扩张、血管生成、细胞生长调节、神经传递调节、胰岛素信号抑制和炎症调剂[3]。研究表明,细胞内的硫化氢水平异常与阿尔茨海默病、唐氏综合征、糖尿病、肝硬化等疾病有关[4]。因此,发展高灵敏、选择性的方法用于细胞内硫化氢的检测和成像在生物医学研究和疾病诊断方面具有重要意义。
传统的硫化氢检测方法主要有比色法、电化学分析、气相色谱法等[5-8],但这些方法需要昂贵的仪器设备和专业的操作,且大多为破坏性检测,很难实现生物体内硫化氢的实时、原位检测。相比之下,荧光探针方法具有操作简单、灵敏性和选择性高等优点。结合荧光显微成像技术,荧光探针可用于生物体内目标分析物的检测和长期示踪[9]。
近些年来,国外知名期刊相继报道了一些用于硫化氢检测的荧光探针[10-12]。这些探针根据硫化氢的特定化学反应设计,通常分为以下3大类:(1)化学还原:利用硫化氢还原叠氮、硝基、羟胺、二硫化物或硒化物;(2)硫化物沉淀:利用硫化氢与有机铜复合物反应形成硫化铜沉淀;(3)亲核反应:利用硫化氢的亲核性与荧光探针发生迈克尔加成或者取代反应等。硫化氢荧光探针的研制已取得了很大进展,但尚有待改进,如:(1)选择性:细胞内含有毫摩尔浓度范围的谷胱甘肽和其他浓度范围的半胱氨酸,这些生物硫醇通常对硫化氢的检测产生干扰;(2)Stokes位移:大部分报道的硫化氢探针Stokes位移小(< 80 nm),作为检测探针时,容易受到内滤效应和自吸收的干扰,降低检测灵敏度;作为成像探针时,易受生物样品背景荧光的干扰,降低成像信噪比。因此,构建一种选择性高、Stokes位移大的硫化氢荧光探针尤为重要,同时也具有一定的挑战性。

图1 探针DHCD检测硫化氢的机理示意图Fig.1 Proposed mechanism for the reaction of DHCD with H2S
具有激发态分子内质子转移(Excited-state intramolecular proton transfer,ESIPT)性质的化合物,由于存在“醇式-酮式”互变异构现象,在构建荧光探针中具有重要作用[13]。相比其他荧光化合物,ESIPT化合物最显著的光学性质是具有大的Stokes位移,可有效消除内滤光作用和荧光自吸收效应,增强目标荧光和背景荧光之间的对比度,提高分子的灵敏度[14]。基于以上考虑,本研究设计并合成了一种基于分子内质子转移(ESIPT)发色团的硫化氢荧光探针(简称DHCD,见图1)。探针DHCD以2-羟基-1-二甲胺基-查耳酮为ESIPT发色团(简称DHOH,图1),以2,4-二硝基苯基醚为硫化氢的特异识别位点。虽然该探针本身没有荧光,但在硫化氢与探针发生亲核取代反应后,识别基团脱落,产生的游离ESIPT发色团可引起荧光信号增强。研究发现探针DHCD在检测硫化氢时展现较大的Stokes位移,高的灵敏度和选择性。更重要的是,该探针具有良好的细胞渗透性和低毒性,能用于活细胞内的硫化氢荧光成像。
1 实验部分
1.1 试剂及设备
2′-羟基苯乙酮、4-二甲氨基苯甲醛、吡咯烷、2,4-二硝基溴苯、硫氢化钠(NaHS,作为硫化氢的供体)购于安耐吉化学有限公司。乙醇、二甲基亚砜(DMSO)、N,N-二甲基甲酰胺(DMF)、碳酸钾等试剂购于国药集团上海化学试剂有限公司。2-羟基-1-二甲胺基-查耳酮根据文献报道方法合成[15]。超纯水(≥ 18 MΩ·cm)由Milli-Q纯化系统制备。
化合物的氢谱和碳谱经Bruker AVANCE-500M型核磁共振仪测得。紫外光谱和荧光光谱分别用UV-2501型紫外可见分光光度计(Shimazu Co,Japan)和RF-5301PC型荧光分光光度计(Shimazu Co,Japan)测定。细胞荧光成像实验在倒置荧光显微镜(NIKON Eclipse Ti-S,Japan)上进行。
1.2 探针DHCD的合成与表征
将2-羟基-1-二甲胺基-查耳酮(133 mg,0.5 mmol),2,4-二硝基溴苯(134 mg,0.55 mmol)和碳酸钾(137 mg,1 mmol)溶解于10 mL DMF,常温下反应2 h后倒入冰水中,收集沉淀物,用甲醇重结晶后得到黄色固体DHCD(145 mg,67%)。1H NMR(500 MHz,DMSO-d6)δ8.82(d,J=2.8,1H),8.40(dd,J=9.3,2.8,1H),7.82(dd,J=7.7,1.5,1H),7.71(td,J=8.1,1.6,1H),7.52(dd,J=17.1,8.2,3H),7.43~7.36(m,2H),7.11(d,J=9.3,1H),7.04(d,J=15.7,1H),6.68(d,J=8.9,2H),2.99(s,6H);13C NMR(126 MHz,DMSO-d6)δ190.27,155.72,152.69,151.02,147.22,141.64,139.17,133.64,133.27,131.27,131.10,130.00,127.41,122.62,122.29,121.66,119.86,119.05,112.15,101.64,40.10。
1.3 样品配制与测试
用分析天平称取一定量的探针DHCD溶解在DMSO中,配成浓度为1.0 mmol/L的DHCD标准液,保存在4 ℃冰箱中待用;分别称取一定量的NaHS和其他分析物质(金属盐、生物硫醇等)溶解在超纯水中,配成浓度为1.0 × 10-2mol/L的标准液,保存在4 ℃冰箱中待用。向测试管(2 mL)中加入探针DHCD储备液(20 μL)和适量的分析物标准液,用磷酸盐(PBS)缓冲液(10 mmol/L,pH 7.45)定容至刻度线处。待混合液孵育75 min后,在荧光分光光度计上测定荧光强度,荧光光谱仪的激发波长设置为382 nm,记录450~675 nm之间的发射光谱。
1.4 细胞培养与成像
将HeLa细胞接种在96孔板中,在细胞培养箱(37 ℃,含5% CO2)中,用10%小牛胚胎血清的DMEM(杜尔贝科改良伊格尔培养基)培养24 h。然后,将细胞转移到含有DHCD(10 μmol/L)的培基中,孵育30 min后用PBS洗涤2~3次,作为空白组。将一部分经DHCD处理的细胞转移到含有NaHS(200 μmol/L)的培基中,孵育75 min后用PBS洗涤2~3次,作为实验组。最后,用倒置荧光显微镜(NIKON Eclipse Ti-S,Japan)观察并拍摄两组细胞的图像。
2 结果与讨论
2.1 可行性研究
在合成探针DHCD后,测试探针与NaHS作用前后的紫外吸收光谱和荧光光谱,证明探针识别硫化氢的可能。如图2A所示,探针在348 nm处有一个最大吸收峰,该峰归因于探针分子结构中的π-π*电子跃迁,而在加入NaHS后,溶液的紫外吸收光谱发生红移,在382 nm处产生最大吸收峰,表明溶液中有新物质产生。图2B为探针与NaHS作用前后的荧光光谱,在382 nm光激发下,探针的荧光较弱(Ф=0.048);而在加入NaHS后,溶液在513 nm处的荧光信号明显增强(Ф=0.375),这可能是因为探针结构中的2,4-二硝基苯在NaHS作用下脱去,导致荧光恢复。此外,探针与硫化氢作用后,Stokes位移高达165 nm,在生物分析中,如此大的Stokes位移可有效减少内滤作用,降低自发荧光的干扰,提高检测的灵敏度和成像的分辨率。
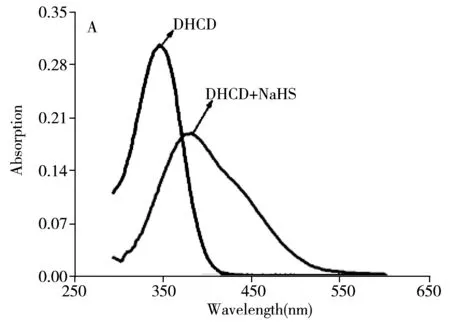

图2 探针DHCD与NaHS作用前后的紫外吸收光谱(A)和荧光光谱(B)Fig.2 Absorption(A) and fluorescence(B) spectra of probe DHCD(10 μmol/L) without and with NaHS(200 μmol/L) in PBS-DMSO buffer(99∶1,by volume,pH 7.45)

图3 探针DHCD与不同浓度NaHS作用后的荧光光谱Fig.3 Fluorescence spectra of DHCD(10 μmol/L) upon addition of different concentrations of NaHS PBS-DMSO buffer(99∶1,by volume,pH 7.45)
2.2 检测机理
为了确定探针与硫化氢的作用机理,测试了探针DHCD与NaHS作用前后的核磁氢谱。在探针与NaHS作用前,2,4-二硝基苯基上的3个质子信号峰位于8.8、8.3、7.7 ppm,而在加入NaHS之后,这3个质子信号峰消失,同时在13.2 ppm处新出现1个归属于酚羟基的特征质子信号峰,表明探针DHCD与硫化氢发生巯解反应,释放出荧光基团。结合相关文献报道[16-17],推测探针DHCD检测硫化氢的可能机理如图1所示。

图4 探针DHCD(10 μmol/L)与不同物质(200 μmol/L)作用前后的荧光强度矩形图Fig.4 Fluorescence responses of DHCD(10 μmol/L) for various analytes(200 μmol/L) black bars represent the addition of a single analyte,red bars represent the subsequent addition of NaHS(200 μmol/L) to the mixture;SCN-,CH3COO-,respectively
2.3 灵敏度
为了探究探针的灵敏度,测试了DHCD(10 μmol/L)与不同浓度NaHS(0~200 μmol/L)在PBS-DMSO缓冲液(99∶1,体积比,pH 7.45)中的荧光光谱。从图3可知,探针的荧光强度随着NaHS浓度的增加而增加。更重要是,探针DHCD在513 nm处的荧光强度与NaHS的浓度在0~10 μmol/L范围内呈现良好的线性关系:Y=0.141 4+0.006 4X,r2=0.997 5(X为NaHS浓度,μmol/L,Y为归一化荧光强度)。根据检出限计算公式(LOD=3σ/k,σ为空白样品连续测定11次的标准偏差,k为标准曲线斜率)[18],求出当前方法对硫化氢的检出限为0.84 μmol/L,该值远低于正常人体内硫化氢的含量[19]。上述结果表明探针DHCD对硫化氢具有较高灵敏度,并能通过荧光光谱定量检测体外硫化氢的含量。
2.4 选择性
除灵敏性外,选择性也是评价探针优劣的一个重要指标。为证明DHCD对硫化氢的专一性,对探针与其他物质(生理相关的阳离子、阴离子、硫醇)的荧光响应情况进行研究。如图4所示,在NaHS存在下,探针产生明显的荧光增强信号,而在其他物质存在下,探针的荧光几乎不变。更重要的是,这些被测试的物质很难干扰探针对NaHS的检测。上述实验结果表明DHCD对硫化氢具有良好的选择性和抗干扰性,满足生物样品中硫化氢的检测要求。
2.5 荧光显微成像
鉴于DHCD在体外实验中对硫化氢优良的识别性能(Stokes位移大、灵敏性和选择性高),利用DHCD对细胞内的硫化氢进行荧光成像。如图5所示,将HeLa细胞与DHCD(10 μmol/L)孵育30 min后,细胞内观察不到荧光信号(图5B)。然而,将细胞放置在含有NaHS(200 μmol/L)的培基中,孵育75 min,可以看到细胞内有明亮的绿色荧光产生(图5D)。从图5A和图5C可以观察到,细胞生长状态良好,这说明DHCD具有较好的生物相容性和低的细胞毒性。上述实验证明本研究中的探针具有较好的细胞膜通透性,适合机体中硫化氢的成像分析。
3 结 论
本研究制备了一种基于分子内质子转移发色团的硫化氢荧光探针(DHCD),该探针与硫化氢作用后展现明显的荧光“关-开”变化,同时伴随大的Stokes位移。光谱分析表明DHCD对硫化氢具有较高的灵敏度和选择性,且不受其他生理相关物质的干扰。更重要的是,该探针具有良好的生物相容性,可用于活细胞中硫化氢的荧光成像。因此,本工作为深入研究机体内硫化氢的生理及病理作用提供了一种强有力的分析方法。

图5 HeLa细胞与DHCD(10 μmol/L)孵育30 min后的明场图(A)及荧光成像图(B),经DHCD处理的HeLa细胞与NaHS(200 μmol/L)继续孵育75 min后的明场图(C)及荧光成像图(D)Fig.5 Bright field image(A)and fluorescence image(B)of HeLa cells after being treated with DHCD(10 μmol/L) for 30 min, and bright field image(C) and fluorescence image(D) of HeLa cells preincubated with DHCD(10 μmol/L) for 30 min and then incubated with NaHS(200 μmol/L) for 75 min
