氮氟共掺杂荧光碳点的制备及其在核黄素检测中的应用
2020-07-03张丽婷李宁波
张丽婷,高 杉,马 榕,李宁波,乔 洁
(1.山西医科大学 基础医学院 生物化学与分子生物学教研室,山西 太原 030001;2.山西医科大学 基础医学院 化学教研室,山西 太原 030001)
碳点(CDs)具有合成简单、生物相容性好、毒性低、荧光明亮且易功能化等优点,是一种很有发展前景的纳米材料[1],已应用于生物成像[2-3]、光电催化[4-5]、光电器件[6-7]、生物传感器[8-10]、染料降解[11]等领域。CDs的合成基本分为自上而下[12-14]和自下而上[15-17]两种方法,其中水热法因简单、高效而备受青睐。近年来,为了拓宽CDs的应用领域,研究者提出了如表面钝化[18]、官能团修饰[19]、金属元素及非金属元素掺杂[20-21]等诸多改进方法;如Xu等[22]采用柠檬酸钠和硫代硫酸钠合成S-CDs用于检测铁离子;Luo等[23]以柠檬酸和尿素为原料采用水热法合成氮掺杂碳量子点(NCQD)检测姜黄素。

图1 核黄素的结构式Fig.1 Chemical structure of riboflavin
核黄素(Vitamin B2,结构式见图1)是人体中一种非常重要的化合物,广泛参与机体各种物质和能量代谢[24-25],核黄素缺乏将会引起皮肤粘膜损伤、疲劳、生长缓慢、尖锐性唇炎和贫血等问题[26-27]。目前用于检测核黄素的方法有高效液相色谱法[28-30]、毛细管电泳法[31]、分光光度法[32]和电化学法[33],但上述方法存在仪器昂贵复杂,需专业技术人员的操作,样品预处理复杂,且灵敏度低、选择性差等缺陷,相比而言,荧光光谱法简单,快速,成本低,灵敏度高。
本研究以柠檬酸、L-赖氨酸和氟化钠为原料采用水热法合成了氮氟共掺杂碳点(NFCDs),采用透射电子显微镜(TEM)、傅立叶变换红外光谱(FT-IR)、X-射线光电子能谱仪(XPS)、紫外-可见吸收光谱(UV-Vis)和荧光光谱对其结构、组成、性质进行了考察,并研究了溶液pH值、NFCDs的浓度、反应时间对核黄素含量检测的影响,探讨了检测机制,为食品中微量核黄素的检测提供了快速、灵敏的分析方法。
1 实验部分
1.1 仪器与试剂
JEM-2100 型透射电子显微镜(日本JEOL公司);Bruker Tensor Ⅱ傅立叶红外光谱仪(德国Bremen公司);AXIS ULTRA DLD型X-射线光电子能谱仪(英国Kratos公司);UV-2910紫外分光光度计、F-4500荧光分光光度计(日本日立公司);pHSJ-3F型酸度计(上海垒固仪器有限公司);FD-1D-50冷冻真空干燥机(北京博医康实验仪器有限公司);Smart-N型超纯水仪(力康生物医疗科技控股有限公司);Olympus FV1000-MPE多光子激光扫描显微镜(日本奥林巴斯光学仪器公司)。
核黄素、柠檬酸、氟化钠、L-赖氨酸、NaH2PO4·2H2O、Na2HPO4·2H2O、Na3PO4·12H2O(上海阿拉丁生化科技股份有限公司);3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴化物(MTT,北京索莱宝科技有限公司);无水乙醇(天津市天新精细化工开发中心);所用试剂均为分析纯;实验用水为去离子水。
1.2 氮氟共掺杂碳点的制备与纯化
精密称取0.197 0 g柠檬酸、0.197 2 g赖氨酸和0.177 4 g氟化钠于50 mL烧杯中,加入20.0 mL蒸馏水搅拌0.5 h至其完全溶解,再将上述溶液倒入50 mL反应釜中,于180 ℃加热10 h,静置冷却至室温,过0.22 μm微孔滤膜,收集滤液用截留分子量为500 D的透析袋透析48 h,得浅黄色溶液,再冷冻干燥得粉末状NFCDs(产率15.3%),备用。
1.3 核黄素的检测
向10 mm的石英比色皿中加入120 μL 0.5 mg/mL的NFCDs溶液,再加入不同体积的1.0 mmol/L 核黄素溶液,用10 mmol/L的PBS(pH 7.8)溶液稀释至2.0 mL,混匀,于室温下反应10 min后,选择激发波长为330 nm,扫描范围350~640 nm,激发和发射的狭缝宽度分别为5 nm和10 nm,测定混合溶液的荧光光谱。
1.4 样品的处理
牛奶来自伊利,奶粉来自雀巢,检测前用0.22 μm微孔滤膜过滤除去杂质,以8 000 r/min离心10 min,取上清液,用10 mmol/L的PBS(pH 7.8)缓冲溶液稀释100倍后使用。
2 结果与讨论
2.1 NFCDs的表征
实验采用柠檬酸、L-赖氨酸、氟化钠合成NFCDs,通过优化获得最佳反应温度和反应时间分别为180 ℃和10 h,制得的NFCDs在水中分散性良好、外观透明,呈现明亮的蓝色荧光,TEM图中可见NFCDs呈球形,且分散性很好,平均尺寸均小于10 nm(图2A);高分辨透射电镜(HRTEM)图中显示NFCDs的晶格间距为0.23 nm(图2A插图),表明NFCDs具有类石墨结构[34],经统计计算得NFCDs的粒径尺寸为1.2~4.8 nm,平均粒径为3.3 nm(图2B)。


图2 NFCDs的TEM图(A)及其粒径分布图(B)Fig.2 TEM(A) and size distribution(B) of the NFCDs insert:HRTEM image of NFCDs
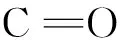




图3 NFCDs的FT-IR图(A)、XPS图(B)、紫外、荧光激发及发射图(C)及其在不同激发波长下的荧光发射谱图(D)Fig.3 FT-IR(A),XPS(B),UV-Vis absorption spectra and fluorescence excitation and emission spectra(C) and fluorescence emission spectra under different excitation wavelength spectra(D) of NFCDsinsert C:photograph of NFCDs aqueous solution under visible light(left) and UV light(365 nm)(right);insert D:corresponding normalized spectra
2.2 NFCDs的荧光稳定性
实验考察了NFCDs在4 ℃下贮存不同时间的荧光强度及其在365 nm处辐射不同时间下的荧光强度。结果发现,贮存时间和紫外辐射对NFCDs的荧光强度几乎无影响,表明NFCDs具有良好的荧光稳定性。
2.3 核黄素检测条件的优化
2.3.1 pH值的影响实验考察了PBS缓冲溶液体系pH值(4.0、5.0、6.0、7.0、7.4、7.8、8.0、9.0、10、11)对核黄素检测的影响。结果显示,无核黄素时,随着体系pH值的增加,NFCDs的荧光强度变化不大。但加入核黄素后,NFCDs的荧光强度显著下降,且在pH值为7.8时,荧光强度比值F0/F425最大,灵敏度最高,因此实验选择pH 7.8的PBS缓冲溶液。
2.3.2 NFCDs质量浓度的影响实验考察了不同质量浓度NFCDs(0.1、0.2、0.3、0.4、0.5 mg/mL)对核黄素检测的影响。结果显示,加入0.3 mg/mL NFCDs时,体系的响应灵敏度最高,因此实验选择NFCDs溶液质量浓度为0.3 mg/mL。
2.3.3 反应时间的影响研究发现,在NFCDs溶液中加入核黄素后,体系的荧光强度迅速降低然后升高,10 min后保持不变,因此选择反应时间为10 min。
2.4 线性方程与检出限
研究了不同浓度(0.0、5.5、8.0、10.5、13.0、15.5、18.0、20.5、23.0、25.5、29.0、31.5、34.0、36.5、39.0、41.5、46.5、51.5、56.5、61.5、66.5、71.5 μmol/L)核黄素对NFCDs荧光强度的影响。结果显示,随着核黄素浓度增大,425 nm处的荧光强度下降,而531 nm处的荧光强度上升(图4A),图4B为F531/F425与核黄素浓度的标准工作曲线,其中F531与F425分别代表加入核黄素后NFCDs在波长为531 nm和425 nm处的荧光强度。由图可见,核黄素浓度(x)在3.0~66.5 μmol/L范围内与F531/F425(y)呈良好的线性关系,回归方程为y=0.046 06x-0.037 17,相关系数(r2)为0.992 3,以3倍信噪比计算得核黄素的检出限为0.26 μmol/L。
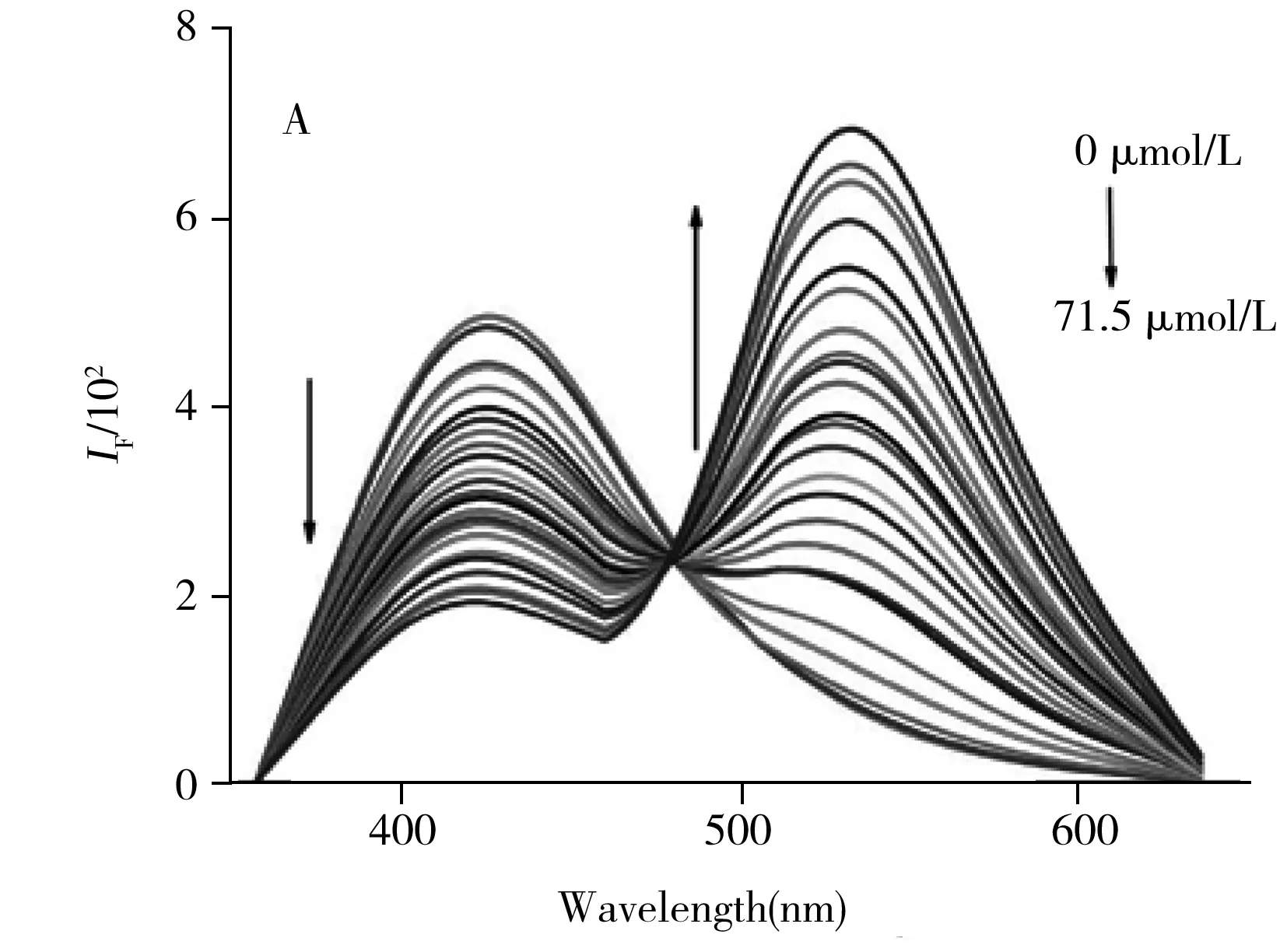
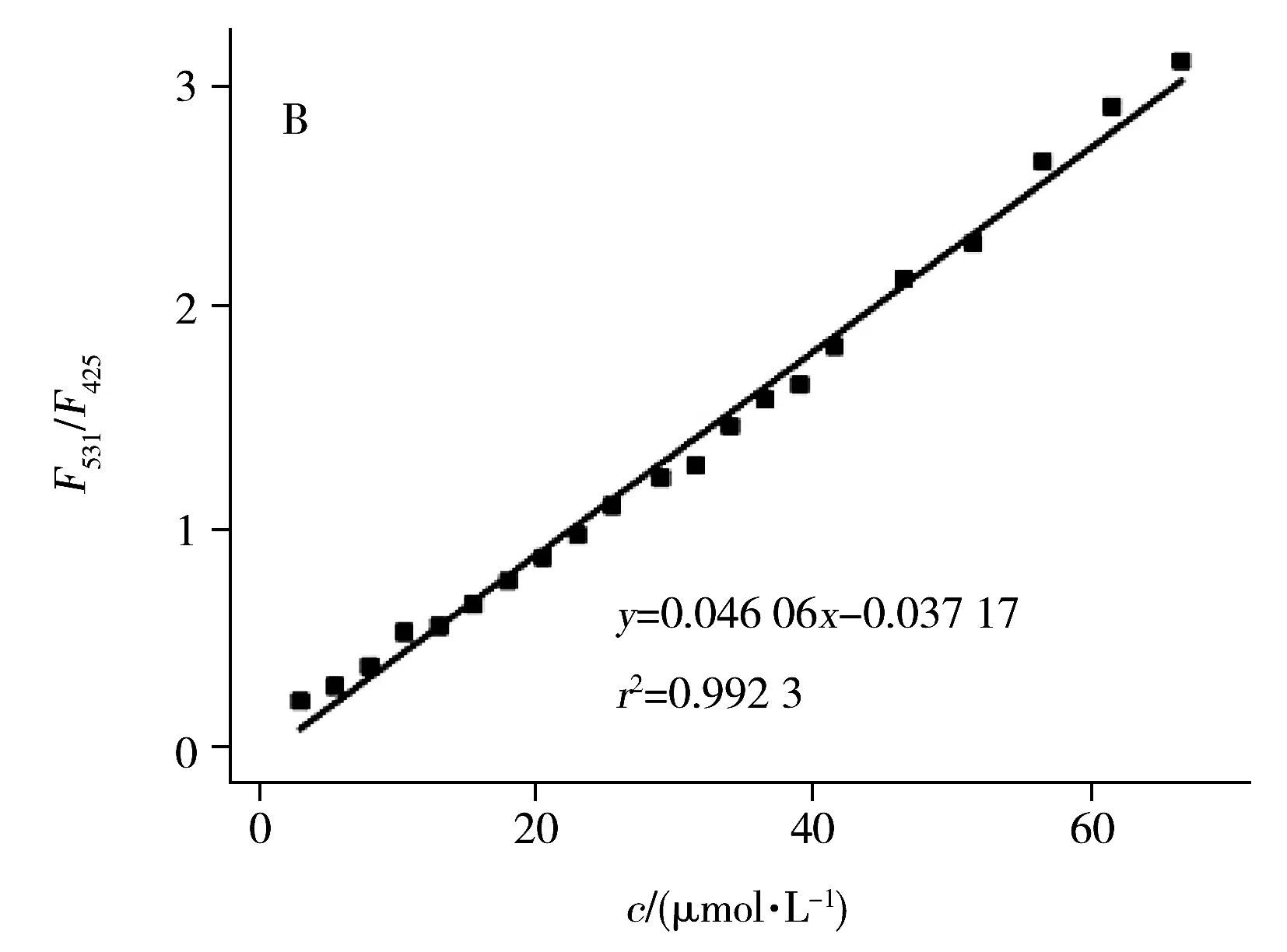
图4 不同浓度的核黄素对NFCDs的荧光光谱(A)及NFCDs相对荧光强度F531/F425与核黄素浓度的线性关系(B)Fig.4 Fluorescence spectra of NFCDs on the different riboflavin concentrations(A) and linear relationship curve between F531/F425 and the concentration of riboflavin(B)
2.5 干扰实验
常见的阳离子、氨基酸、食品添加剂可能会对NFCDs的荧光强度产生影响,因此选择常见的金属盐溶液、氨基酸和食品添加剂(MgCl2、NaCl、MnCl2、CaCl2、AlCl3、BaCl2、ZnCl2、NH4Cl、CoCl2、CdCl2、ZrCl4、Hg(NO3)2、LiNO3、PbCl2、AgNO3、Cr(NO3)3、FeCl2、FeCl3、NiCl2、CuCl2、KCl以及Trp、Thr、Phe、Ile、Lys、Glu、Pro、Gly、His、Ala、Met等)代替核黄素加入待测体系中,考察其对NFCDs荧光强度的影响。结果显示,浓度等于100 μmol/L的上述阳离子、氨基酸及食品添加剂等对检测核黄素(70 μmol/L)基本无影响,表明该荧光探针对核黄素具有良好的选择性。
2.6 机理探讨
本文通过核黄素(受体)的紫外吸收光谱、荧光发射光谱图和NFCDs(供体)的荧光激发、发射光谱图探讨检测机理。结果显示,受体的紫外可见吸收光谱图与供体的激发和发射光谱之间有一定的重叠,这将有利于荧光共振能量转移(FRET)的发生[38]。在此过程,受体也是一种荧光发射体,核黄素对应的荧光发射峰波长为527 nm,由此可推断531 nm处的荧光发射峰是由核黄素引起的(图5A)。通过考察不同浓度(0、6.0、6.5、7.5、8.0 μmol/L)的核黄素对NFCDs紫外吸收光谱的影响(图5B)发现,加入核黄素后,体系的紫外吸收在NFCDs的基础上有所增加,但最大吸收峰的位置和形状未发生变化,表明核黄素与NFCDs之间未生成新物质。故推断核黄素与NFCDs间通过偶极-偶极耦合作用发生荧光共振能量转移[38],其相互作用如图6所示。
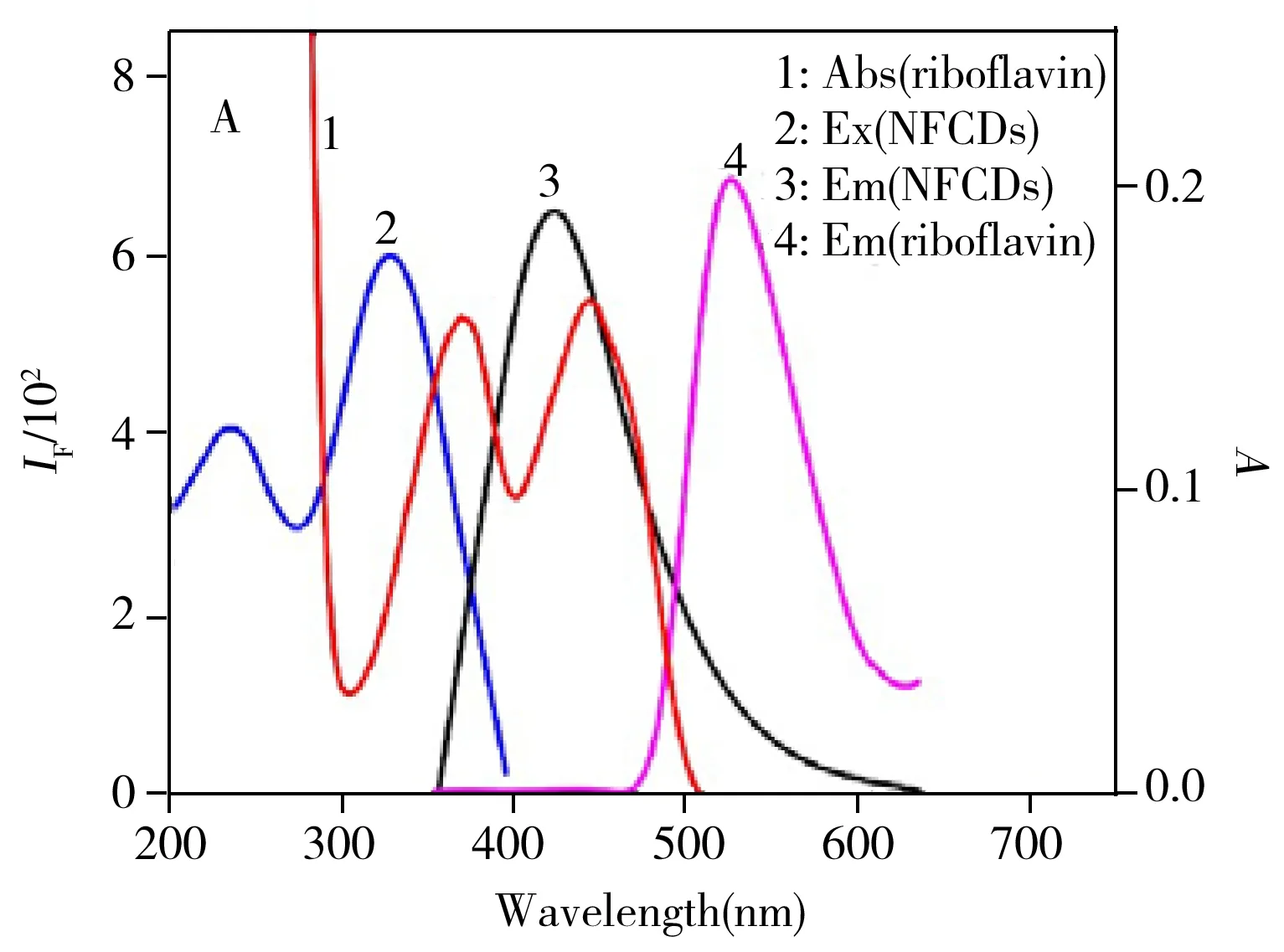

图5 核黄素的紫外吸收、荧光发射光谱图和NFCDs的荧光激发、发射光谱图(A)及不同浓度的核黄素对NFCDs紫外吸收光谱的影响(B)Fig.5 UV-Vis absorption spectra,fluorescence emission spectra of riboflavin and fluorescence excitation,emission spectra of NFCD(A) and UV-Vis absorption spectra of NFCDs solution in the presence of various concentrations of riboflavin(B)

图6 核黄素与NFCDs相互作用示意图
Fig.6 Schematic diagram of NFCDs for the detection of riboflavin
2.7 实际样品检测及加标回收率
采用本文构建的NFCDs荧光探针对实际牛奶和奶粉样品中的核黄素进行测定,结果见表1。将不同浓度的核黄素加入牛奶和奶粉中进行加标回收实验,在优化条件下平行测定3次,核黄素的回收率为96.7%~103%,相对标准偏差(RSD)为1.4%~3.2%,表明本方法可用于牛奶和奶粉中核黄素的检测。

表1 牛奶和奶粉中核黄素的测定结果Table 1 Determination results of riboflavin in milk and milk powder

图7 MTT测定NFCDs的细胞存活率Fig.7 Cell viability of HeLa cells in the presence of different concentrations of the NFCDs
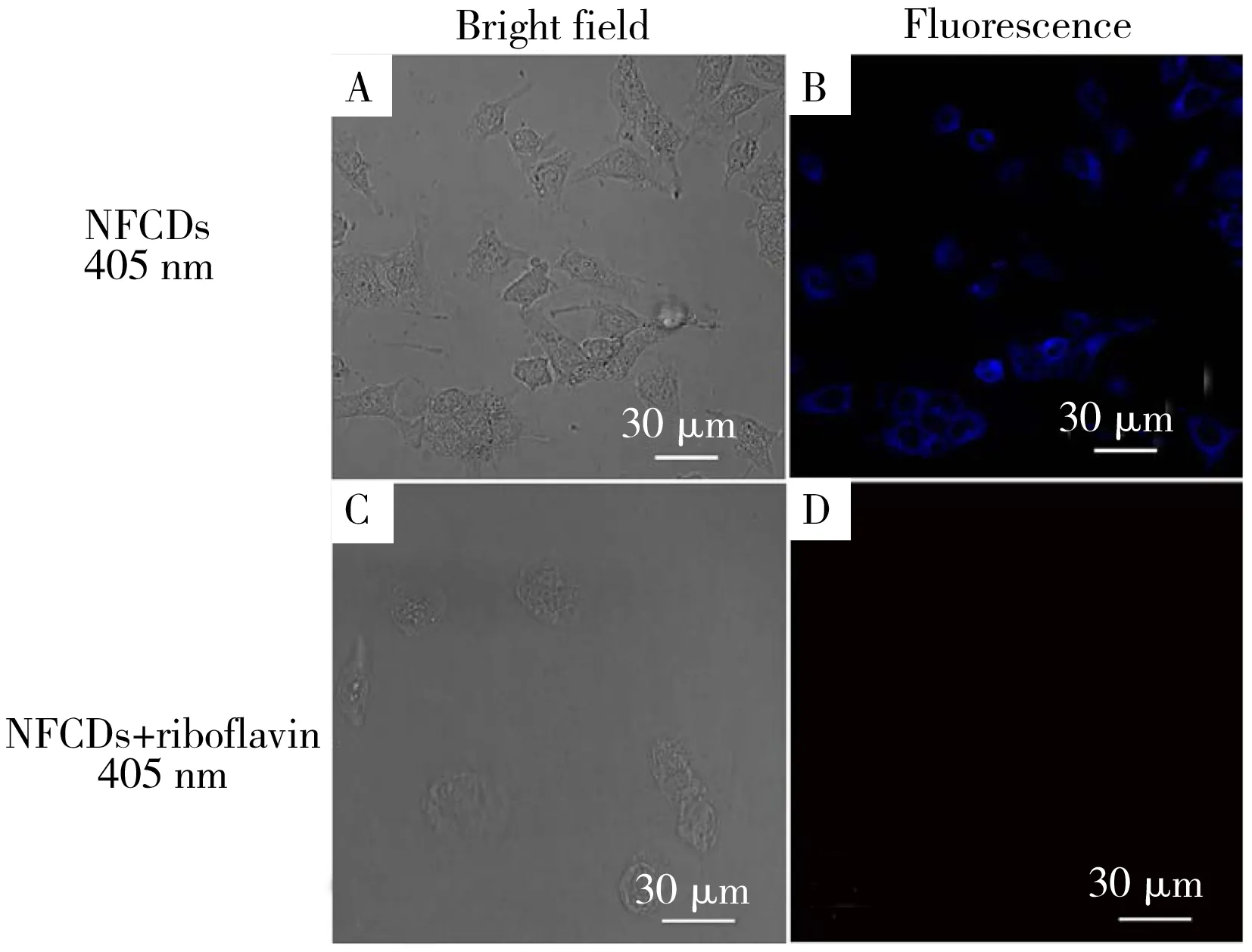
图8 NFCDs在HeLa细胞中的共聚焦荧光图像在明亮的区域(A)、蓝色通道荧光图(B)以及NFCDs和核黄素在HeLa细胞中的共焦荧光图像在明亮的区域(C)、蓝色通道荧光图(D)Fig.8 Confocal fluorescence image of HeLa cells were incubated with NFCDs in bright field(A),fluorescence image of blue channel(B),confocal fluorescence images of NFCDs and riboflavin in HeLa cells were incubated in bright fields (C),fluorescence image of blue channel(D)
2.8 细胞毒性测试
采用MTT法测定不同浓度NFCDs对HeLa细胞的毒性。取HeLa细胞在CO2培养箱中孵育,待细胞铺满瓶壁后,消化后传代至96孔板,使用细胞计数板计录细胞数目。过夜,待细胞贴壁,再加入不同质量浓度的NFCDs(0、10、40、80、200、300、400、500 μg/mL),继续培养24 h。用PBS洗涤3次,之后每孔加入20 μL的MTT溶液(0.5 mg/mL),放置在培养箱中继续孵育4 h。再用PBS洗涤3次,在每孔中加150 μL的DMSO(二甲基亚砜),室温振荡混匀15 min,用酶标仪测定。结果表明,NFCDs的质量浓度为500 μg/mL时,细胞的存活率高于80%(图7),表明NFCDs具有良好的生物相容性、低毒性,在活细胞中核黄素的监测方面具有巨大潜力。
2.9 细胞成像
HeLa细胞被置于35 mm,底部有10 mm孔的Petridish培养皿中,在RPMI-1640培养基中培养24 h。用PBS缓冲液洗涤后,HeLa细胞在37 ℃与0.4 mg/mL NFCDs孵育1.5 h,使细胞摄取。为了监测活细胞中核黄素浓度的变化,将细胞洗涤3次,加入60 μmol/L的核黄素,孵育15 min后进行荧光成像。图8A为NFCDs与HeLa细胞孵育后在明亮区域的共聚焦荧光图像,可见细胞形态正常,说明合成的NFCDs与HeLa细胞孵育后对细胞的毒性很小;HeLa细胞经过NFCDs孵育后呈现出蓝色的荧光(图8B)。经NFCDs孵育后,HeLa表现出强烈的蓝色荧光,表明NFCDs能穿透细胞膜,通过内吞作用进入细胞;图8C为NFCDs、核黄素与HeLa细胞共孵育后在明亮区域的荧光图像。其细胞形态正常,说明合成的NFCDs、核黄素与HeLa细胞孵育后对细胞的毒性很小;当HeLa细胞、NFCDs和核黄素在37 ℃共孵育1.5 h后,采用激光共聚焦显微镜对HeLa细胞进行荧光显微镜观察,未观察到荧光(图8D)。细胞的荧光消失,表明核黄素对NFCDs的荧光有猝灭作用。由此可见,合成的NFCDs既可用于细胞成像,也可用于细胞中核黄素的检测。
3 结 论
通过一步水热法制备得到具有明亮蓝色荧光的NFCDs,量子产率为15.3%,该纳米粒子平均粒径为3.3 nm,生物相容性好,且NFCDs的相对荧光强度与核黄素的浓度呈良好的线性关系,浓度范围3.0~66.5 μmol/L,检出限为0.26 μmol/L。用于牛奶和奶粉实际样品中核黄素的检测,结果令人满意。
