无分散剂微波辅助离子液体分散液液微萃取/胶束电动色谱检测食用油中丙烯酰胺和5-羟甲基糠醛残留
2020-07-03高仕谦吴友谊毛宇成
徐 蕊,高仕谦,吴友谊*,毛宇成
(1.苏州科技大学 环境科学与工程学院,江苏 苏州 215009;2.江苏省环境科学与工程重点实验室,江苏 苏州 215009)
含有糖和蛋白质的食品在高温(>120 ℃)加热期间(例如烘烤、油炸、烧烤等)会发生美拉德反应(褐变反应)[1],其中间产物丙烯酰胺(Acrylamide,AA)和5-羟甲基糠醛(5-Hydroxymethylfurfural,5-HMF)由于在食品中广泛存在且毒理效应显著而倍受关注。据报道[2],AA具有神经、肝和基因毒性作用;5-HMF对人类和动物有染色体致突变性和致癌性。我国食用植物油生产多以含有大量蛋白质和糖类(或称碳水化合物)的油籽为原料。AA和呋喃类有害物质会在高温焙炒(150~180 ℃)油籽的过程中产生[3-4],但目前有关AA和5-HMF的分析研究中,样品基质集中于谷物类(如麦片、面包、薄脆饼干)、奶粉、牛奶、咖啡和马铃薯类等产品,食用油基质中此两种目标物的研究非常缺乏。且现有植物油中对5-HMF进行分析研究[5-7]的实验均需使用大量正己烷等有机溶剂,不环保且操作复杂。已有专利[8]利用油脂受热诱导所产生的物质如丙烯酰胺、糠醛、呋喃类等的含量区分商品植物油、地沟油、煎炸老油,但尚未发现食用油中AA的相关检测研究。因此建立食用油中AA和5-HMF的分析检测方法对食用油质量管控、食用油安全和营养健康等具有非常重要的实际意义。
目前常用的检测AA和5-HMF的方法包括高效液相色谱法、液相色谱-质谱法、气相色谱法、气相色谱-质谱法,但操作均较为复杂、检测成本高,并且难以对复杂样品基质中的微痕量目标物进行快速准确检测[9]。近年来,毛细管电泳(Capillary electrophoresis,CE)因具有分析速度快、分离效率高、环境友好(试剂消耗微量)和检测成本低等优势,被认为是食品科学领域高效的分析工具[10]。食用油基质复杂,需要前处理以富集和净化。常用的AA和5-HMF的前处理技术,如固相萃取[11]、液液萃取[12]、液液微萃取[7]等方法或多或少会使用有机溶剂且耗时,因而开发简捷且环保的方法极为必要。分散液液微萃取(Dispersive liquid-liquid microextraction,DLLME)相比于传统方法具有简单、快速、成本低、回收率高等优点,自2006年被提出后倍受关注[13-14],且已成功应用于各种基质中痕量污染物的分析。然而,DLLME的萃取剂和分散剂大多采用有机溶剂,限制了其发展应用[15]。而离子液体(Ionic liquid,IL)由于低挥发性和低毒性被越来越多地用作DLLME的萃取溶剂[16]。IL-DLLME融合了以上两者的优点,而且IL可有效吸收微波能量,采用微波辅助(Microwave assistant,MA)将更有利于IL萃取分析物[17]。另外,该方法无需分散剂,只需借助微波仪自带的磁力搅拌作用即可达到较好分散效果,且开发免分散剂的DLLME方法也将是未来发展的一种趋势[16,18]。
本研究将结合IL-DLLME、MA以及CE的优势,建立一种基于离子液体和免分散剂的微波辅助萃取结合毛细管胶束电动色谱(MEKC)同时分析检测食用油中AA和5-HMF的简捷、绿色的方法。
1 实验部分
1.1 材料与仪器
AA标准品(纯度>99.8%,阿拉丁公司);5-HMF标准品(纯度>98%,阿法埃莎公司);1-乙基-3-甲基咪唑四氟硼酸盐([C2MIM][BF4])、溴化 1-丁基-3-甲基咪唑([C4MIM]Br)、溴化1-己基-3-甲基咪唑([C6MIM]Br)、溴化1-辛基-3-甲基咪唑([C8MIM]Br)(纯度均为99%,上海成捷化学有限公司);甲醇(色谱纯,美国Sigma公司);氢氧化钠、盐酸、十二烷基硫酸钠(SDS)、四硼酸钠(分析纯,南京化学试剂股份有限公司)。
P/ACETMMDQ毛细管电泳仪配PDA检测器(美国贝克曼公司);UWave-2000 多功能微波合成萃取仪(上海新仪微波化学科技有限公司);KQ-300E 型超声波清洗器(昆山市超声仪器公司);SK-1快速混匀器(金坛市科析仪器有限公司);TGL-16C 台式离心机(上海安亭科学仪器厂);AL204 电子分析天平(梅特勒-托利多仪器上海有限公司);高温鼓风干燥箱(上海姚氏仪器设备厂);PHS-3C台式pH计(上海仪电科学仪器股份有限公司);熔融石英毛细管(河北锐沣色谱器件有限公司)。
1.2 实验方法
1.2.1 标准溶液的配制分别准确称取25 mg AA和5-HMF标准品于25 mL棕色容量瓶中,用甲醇定容后得到1 000 μg/mL的混标储备液,密封储存于-4 ℃下待用。各浓度混标使用液由储备液加甲醇稀释得到。
1.2.2 样品采集芝麻油、金龙鱼大豆油(精炼一级)和菜籽油购自校园周边超市,其中大豆油不含AA和5-HMF,作为样品空白。花椒油来自校园周边餐馆自制,煎炸老油来自校园周边炸串小吃摊,废餐厨油粗制品为苏州某餐厨油脂回收公司回收的废弃餐厨油经分选、湿热分解后得到的油。
1.2.3 样品前处理在2 mL油中,加180 μL的[C8MIM]Br离子液体和一个小磁子,于70 ℃下微波辅助分散液液微萃取12 min,置于-4 ℃冰箱中冷冻5 min,用磁体沿管壁缓慢取出转子,以10 000 r/min高速离心5 min。定量移取160 μL下相后,加硼砂溶液(20 mmol/L,pH 9.7)使溶液总体积为400 μL,涡旋混匀1 min,10 000 r/min高速离心5 min后取下相,经0.22 μm针式PVDF滤头(天津市津腾试验设备有限公司)过滤,进CE分析。加标样品的处理与上述步骤相似,但需先在油样中加入一定量的混标。
1.2.4 胶束电动色谱条件实验使用未涂覆的熔融石英毛细管(内径50 μm,总长度49.2 cm,有效长度38.5 cm)进行电泳分离。所有溶液均经0.22 μm滤头过滤。每天进样前,依次用1 mol/L NaOH、水、运行缓冲液(BGE)冲洗毛细管 8、5、6 min;两次运行间用BGE冲洗2 min。分离电压为12 kV;0.5 psi(3 447.39 Pa)压力下进样6 s;检测波长为202 nm;温度25 ℃;缓冲溶液:含130 mmol/L SDS的20 mmol/L硼砂溶液(pH 9.7)。
2 结果与讨论
2.1 胶束电动色谱条件的优化
毛细管电泳条件的优化因子包括缓冲液pH值和浓度、十二烷基硫酸钠(SDS)的浓度、分离电压、进样时间和毛细管柱温。
2.1.1 缓冲液pH值及浓度考察了硼砂和磷酸盐缓冲液对目标物分离效果的影响,发现磷酸盐的电流相对较大且目标物响应和分离效果欠佳。因此,选择硼砂缓冲液并考察了其pH值的影响,结果显示,在pH 9.2~10.8范围内,随着pH值的增加,目标物迁移时间延长,峰形变宽;当硼砂缓冲液为pH 9.7 时,两目标物的响应和分离效果最好,因此选择pH 9.7进行后续研究。在0~20 mmol/L范围内,硼砂溶液浓度越大,目标物迁移时间越长,目标物峰面积越大,当硼砂浓度大于20 mmol/L后,电导率增加,基线不稳,致使目标物响应重现性变差,因而采用 20 mmol/L硼砂溶液作为缓冲溶液。
2.1.2 SDS浓度在分离过程中,由SDS形成的胶束可通过与目标物之间的疏水和静电相互作用改善目标物的响应和分离情况。本文考察了缓冲液中不同浓度(10~150 mmol/L)的SDS对目标物分离的影响。发现高浓度的SDS可改善目标物的分离情况,但也导致焦耳热增加,使得信噪比和重现性变差,最终选择含有130 mmol/L SDS的20 mmol/L硼砂溶液(pH 9.7)作为最佳缓冲液。
2.1.3 分离电压考察了分离电压在10~20 kV范围内对各组分迁移时间的影响。结果发现,随着电压的增加,迁移时间因电渗流(EOF)的增加而减小。然而,由于较高电压下的焦耳热显著,导致目标物响应不佳以及基线漂移。综合考虑后选择12 kV作为分离电压。
2.1.4 进样时间在进样压力为0.5 psi(3 447.39 Pa)条件下,考察了进样时间在2~10 s范围内的影响。当进样时间为6 s时,得到分析物最佳的峰面积和重现性,当进样时间继续增加时,仅观察到峰高略有增加,且峰宽变宽,峰形尖锐性变差。因此最终选择6 s为进样时间。
2.1.5 毛细管柱温考察了毛细管柱温(15、20、25、30 ℃)对分离效果的影响,发现柱温对目标物的分离效果影响相对较小。随着柱温升高,溶液粘度降低,出峰时间缩短,电渗流加快,影响准确性和重现性,因此选择25 ℃为最佳柱温。
2.2 萃取条件的优化
为了获得最佳的萃取效果,通过单因子优化考察评估了一系列变量,包括离子液体的种类和体积、微波辅助萃取条件和样品油体积,所有实验均重复3次。

图1 离子液体种类对萃取效果的影响Fig.1 Effect of ionic liquid types on extraction recovery
2.2.1 离子液体种类IL通常由相对较大的有机阳离子和单个或复杂的阴离子组成。IL的结构对其理化性质有重要影响,例如密度、粘度、在样品溶液中的溶解度等,这些性质会强烈影响目标分析物的提取效率。本研究对4种咪唑类IL,包括[C2MIM][BF4]、[C4MIM]Br、[C6MIM]Br和[C8MIM]Br进行了考察,发现[C2MIM][BF4]对5-HMF无提取能力。其它3种IL具有相同阴离子但阳离子(主要是烷基链长度)不同。有研究表明,离子液体的疏水性主要取决于其阳离子的性质,即烷基链长度越长疏水性越好[18]。而本实验结果(图1)表明,[C4MIM]Br、[C6MIM]Br和[C8MIM]Br 3种IL对两种目标物的提取能力顺序为C8>C4>C6,提取效率并未随着离子液体中阳离子的烷基链长度增加而增加。Raj[19]和Sankaran[20]等在研究IL的理化特性时也发现了[C6MIM]Br类似的异常结果(亲水性顺序为C6≥C4>C8)。另外,Zhang等[21]为提高IL对丙烯酰胺的选择性制备了含有辛基侧链的IL([OMIM]Br),并发现具有类似结构的[C8MIM]Br对AA有良好的萃取能力,且其萃取原理为[C8MIM]Br能破坏目标物分子间和分子内的氢键并在目标物的羟基质子和IL阴离子之间形成新的氢键[22]。由于本实验需要从油样品基质中提取极性化合物,所以要求萃取剂IL兼溶于水和油,综上,选择[C8MIM]Br进行后续研究。
2.2.2 离子液体体积萃取溶剂的体积直接影响DLLME的萃取效率。本实验考察了[C8MIM]Br体积(60、90、120、150、180、210 μL)对萃取效果的影响。如图2所示,在60~180 μL范围内,AA和5-HMF的萃取回收率分别增大至78.9%和68.9%,这是因为较多的IL可以有效吸收和转移微波能量[17],有利于萃取的传质过程;但当萃取剂体积大于180 μL后,回收率开始降低,这是因为分析物从溶液到微滴的扩散速率与两相之间的界面面积有关[23],随着萃取溶剂总体积增大,溶剂在样品溶液中的扩散性可能会变差,有些溶剂无法很好地分散到样品溶液中,导致萃取回收率降低。另一方面,当离子液体体积为180 μL时萃取达到平衡。根据以上结果,选择180 μL [C8MIM]Br进行后续研究。
2.2.3 微波条件相比于常规DLLME方法,微波辅助可以促使IL和样品充分混合均匀。由于微波能量会显著影响目标化合物与IL之间的分子相互作用,因此需要对微波功率、微波辅助萃取时间和温度进行优化以实现更好的萃取效果。微波功率太低,IL不能很好地分散到样品溶液中,而微波功率过高则可能会导致分析物的降解。适当地提高萃取温度会降低IL的粘度,提高IL在油中的溶解性和分散性,从而有助于更好地形成乳浊液。随着微波功率从200 W增加到300 W,萃取效率迅速增加,当微波功率高于300 W时,萃取效率略有下降。因此,选择300 W的微波功率。通过考察不同的微波辅助萃取时间发现,在2 ~12 min萃取时间内,目标分析物的回收率逐渐增加,当萃取时间超过12 min后回收率降低。因此,选择12 min为最佳萃取时间。
适当的高温有利于IL的分散和萃取传质,通过考察不同温度对萃取效果的影响发现,在25~70 ℃温度范围内,萃取回收率随着微波温度的升高而快速增长,回收率从31.0%增加至85.0%;继续升温后萃取回收率开始下降,可能是因为温度过高会导致样品基质发生变化,目标物热分解等。因此,选择70 ℃为最佳萃取温度。
2.2.4 样品油体积在DLLME过程中,样品体积是影响萃取效果最重要的研究参数之一。在控制加标油浓度不变的条件下,考察了不同大豆油体积(0.5、1、2、3、4 mL)对萃取效果的影响,发现萃取回收率随着油样体积从0.5 mL 到2 mL逐渐增加,当样品体积为2 mL时,AA和5-HMF的萃取回收率分别为95.8%和89.6%;当样品体积大于2 mL后,随着样品体积的增长,萃取回收率开始略微下降,这可能由于,一方面受样品中复杂基质的影响,另一方面,萃取已逐渐达到平衡,因此选择2 mL为最佳样品体积。
2.3 方法评估
通过在空白大豆油中加入不同浓度的混标,制成一系列浓度梯度的加标油,然后在优化条件下以峰面积(y)对加标油的质量浓度(x,μg/mL)制作工作曲线。所建方法的工作曲线、检出限、定量下限、相关系数和相对标准偏差见表1。两种目标物在线性范围0.5~50 μg/mL内呈现良好的线性关系(r2≥0.997 1),AA和5-HMF的检出限(LOD,S/N=3)分别为0.11、0.70 μg/mL,定量下限(LOQ,S/N=10)分别为0.33、2.33 μg/mL。对样品进行5、10、 20 μg/mL 3个水平的加标回收实验,每个水平平行6次,两种目标物的日内、日间相对标准偏差(RSD)均不大于4.3%,表明方法精密度良好,满足分析测定要求。

表1 方法的线性回归方程、检出限、定量下限、相关系数和相对标准偏差Table 1 Linear equations,LODs,LOQs,correlation coefficients and relative standard deviations(RSDs) of the proposed method
2.4 方法对比
将本方法与近年报道的食品中AA和5-HMF的分析方法进行了对比,见表2。与本方法类似的使用毛细管电泳检测AA的3种方法[12,24-25]中,均或多或少地使用了有机溶剂(如正己烷、甲醇、乙腈),且前处理包括研磨、液液萃取、脱脂除蛋白和旋蒸浓缩等复杂步骤,不仅前处理时间长,而且液液萃取-毛细管电泳(LLE-CE)[12]和基质固相分散-毛细管电泳(MSPD-CE)[25]两方法的LOD分别大致高出本方法2倍和5倍;虽然同时测定蜂蜜和植物油中呋喃化合物的胶束电动色谱法[7]的回收率较高,但其在液液萃取过程中也使用了正己烷。相比之下,本方法首次使用无分散剂微波辅助离子液体萃取食用油中AA和5-HMF,且使用了更环保的IL作为萃取剂,未使用有机溶剂,同时各种溶液和试剂的消耗更少,从而更绿色环保,大大降低了实验成本;本实验目标物AA的分析速度比冯军等[12]的快一倍,且更简单易操作,样品前处理仅需30 min,两个目标物在12 min内即可完全分离。

表2 本方法与其他方法的比较Table 2 Comparison of the proposed method with other methods
2.5 实际样品分析
为评估本方法的实用性,在最佳条件下测试了4种商品食用香油、1种餐馆自制花椒油、1种小吃摊煎炸老油、1份废弃餐厨油粗制品共7个实际样品中的AA和5-HMF。结果(表3)表明:在3个品牌芝麻香油和餐馆自制花椒油中检出5-HMF,质量浓度分别为3.3、2.2、1.1、1.5 μg/mL,且是首次在花椒油中检出5-HMF。其他油样未检出目标分析物。通过测定3个浓度水平(5、10、20 μg/mL)的加标大豆油,得到AA和5-HMF的加标回收率分别为82.5%~96.2%和77.9%~95.9%,RSD分别为1.3%~5.2%和1.7%~4.9%。图3为两种实际样品及其在10 μg/mL加标水平下的电泳图。
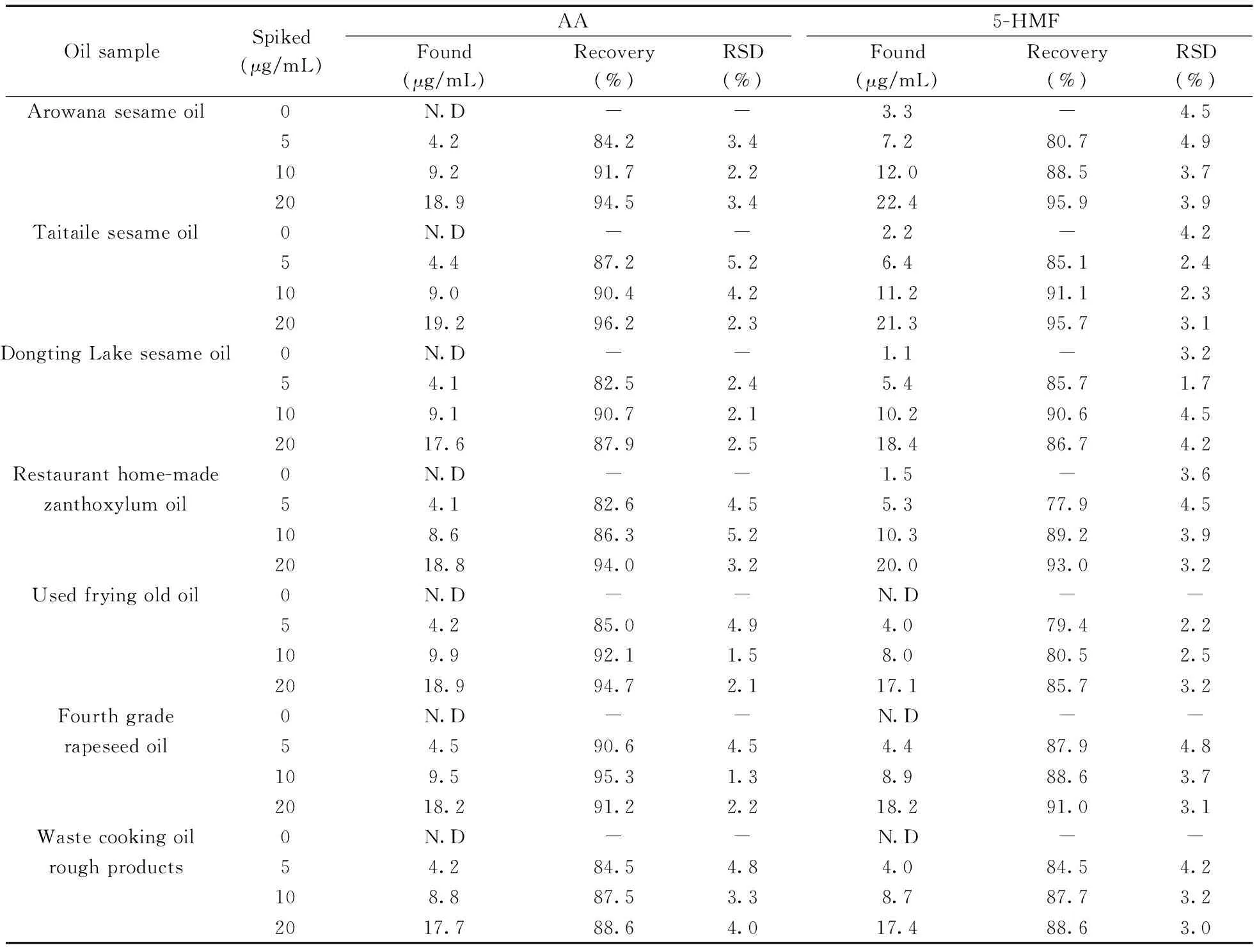
表3 两种目标物在实际样品中的含量、加标回收率和相对标准偏差(n=3)Table 3 Concentrations,spiked recoveries and RSDs of the two analytes in the actual samples(n=3)
“N.D” :not detected or below limit of detection
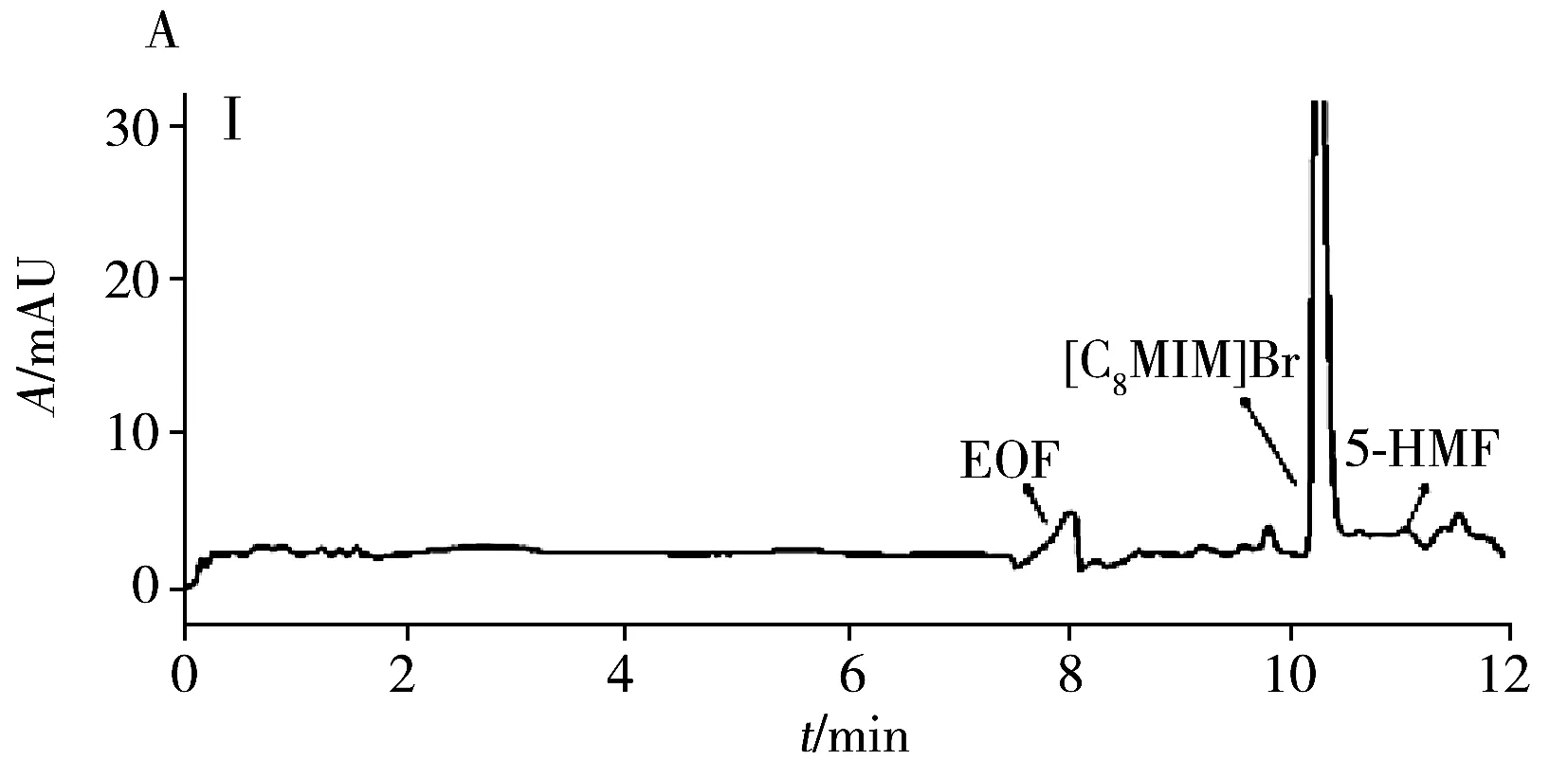
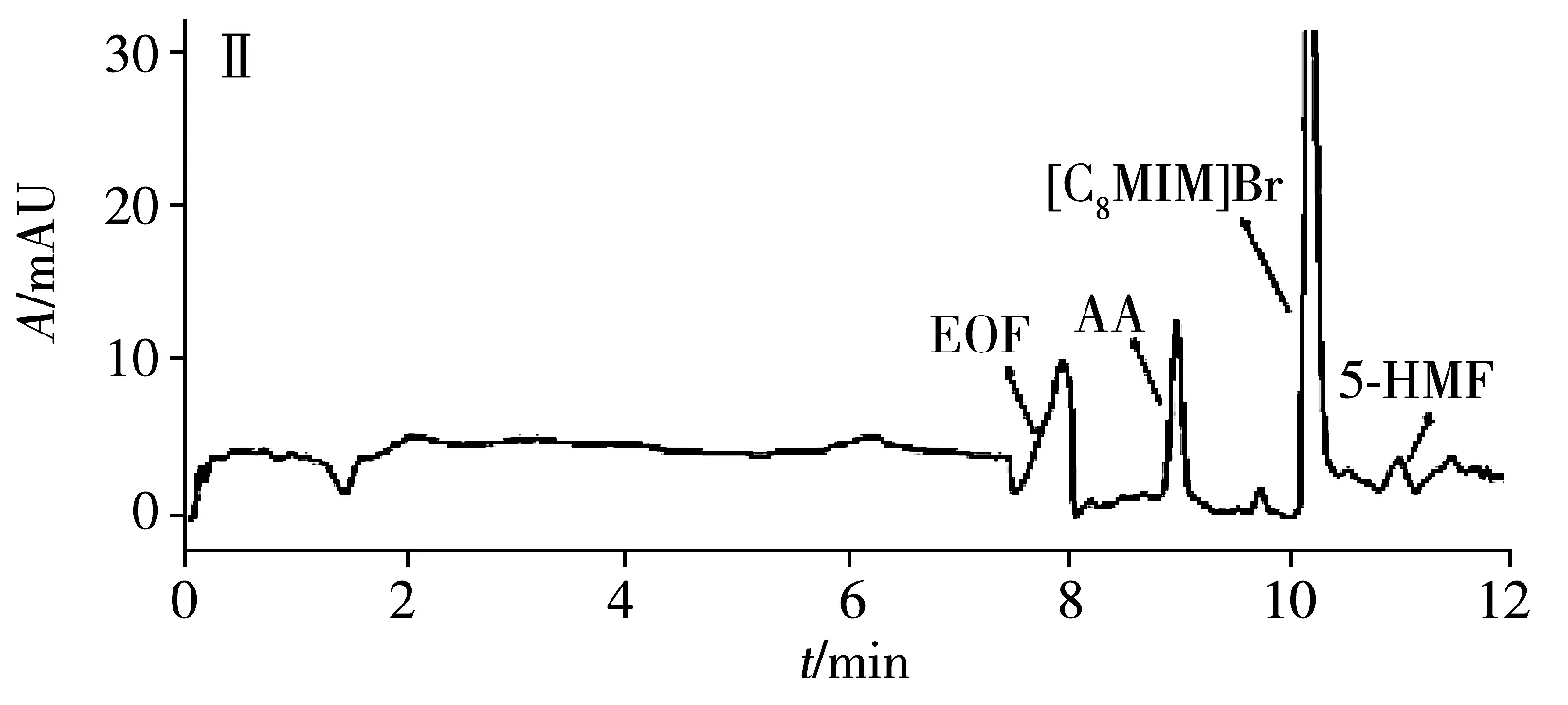
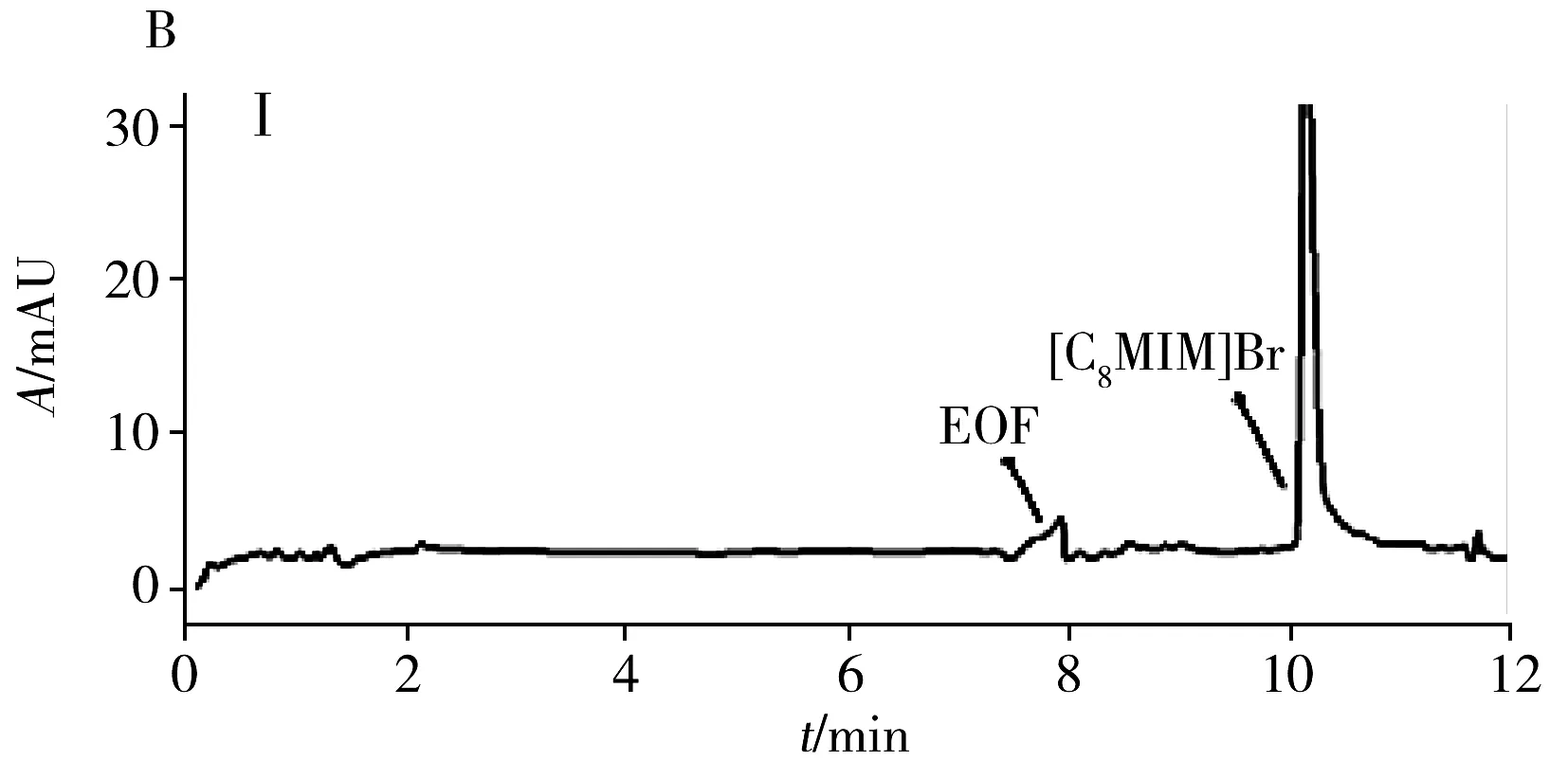

图3 两种实际样品及其加标样品电泳图Fig.3 Electropherograms of two actual samples and spiked samplesA:arowana sesame oil;B:used frying old oil;Ⅰ:unspiked sample;Ⅱ:sample spiked with 10 μg/mL
3 结 论
本研究结合IL、无分散溶剂的DLLME、MA以及CE的优势,开发了一种无需分散剂的微波辅助离子液体分散液液微萃取结合胶束电动色谱分析食用油中AA和5-HMF的方法。方法的加标回收率和相对标准偏差分别为77.9%~96.2% 和1.3%~5.2%,准确性和重现性良好,而且更简单、快速、高效、低成本和绿色环保。利用此方法在实际样品芝麻香油和花椒油中检出5-HMF,含量范围为1.1~3.3 μg/mL,说明本方法适用于食用油中AA和5-HMF的分析测定。本研究对于食用油质量管控、食用油安全和营养健康等有重要的实际意义。
