三维超声造影预测肝癌射频消融术后残留风险的价值
2020-07-02徐书陈子亮
徐书 陈子亮
射频消融术是治疗肝癌的常用手段,这种方式能促进瘤体消亡,改善患者生存情况[1]。然而,仍有部分患者经治疗后存在病灶残留。既往采用传统超声评估术后病灶残留情况,虽然具有一定价值,但其对微血管显示效果欠佳,敏感性差[2]。近年来,三维超声造影(3D-CEUS)在恶性肿瘤病情评估中发挥着越来越重要的作用,其对微血管显示良好,能及时发现残余病灶[3]。本研究旨在分析3D-CEUS对肝癌射频消融术后残留风险的预测价值,现报道如下。
资料与方法
一、一般资料
将南京医科大学附属淮安市第一人民医院2016年6月—2019年6月收治的肝癌行射频消融术的102例患者纳入研究对象。男、女各54、48例,年龄40~75岁,平均(61.24±10.93)岁;病灶直径:1~4 cm,平均(2.56±0.51)cm;病灶数量:单发、多发分别为83、19例;Child-pugh分级:A、B级分别为43、59例。
二、纳入与排除标准
(一)纳入标准 ①经病理穿刺证实为肝癌;②符合射频消融术适应证,病灶数目不超过3个,单发病灶最大径低于5 cm,单个病灶最大径低于3 cm;③邻近器官未见累及;④未见脉管癌栓;⑤肝功能分级Child-pugh分级为A、B级;⑥术后接受三维超声造影检查;⑦知情同意。
(二) 排除标准 ①晚期肝癌,伴有广泛转移;②其他脏器损害(如脑、心等);③合并肝癌外其他类型恶性肿瘤;④根治手术干预;⑤既往有新辅助放疗、化疗史。
三、方法
射频仪器为射频消融系统(SMARTABLATE),输出功率=1~90 W,工作主频=4.6 MHz,术中组织凝固程度、人体阻抗大小等均可通过系统自行调节。在术后3 d行3D-CEUS检查,仪器为彩色超声仪(LOGIQ P6),具备2D、3D成像功能,探头频率分别为1.0~5.0 MHz、1.0~6.0 MHz,机械指数=0.05~0.09。首先行常规超声探查,明确肿瘤最大切面、最佳扫描位置,然后行2D-CEUS扫描,取2.0 Sono Vue悬浊液于肘浅静脉注入,取0.9% 氯化钠注射液5 mL推注,记录造影结果。在2D-CEUS扫描后15 min,将设备调试成3D-CEUS扫描模式,再次取2.0 Sono Vue悬浊液注射,采集图像,叮嘱患者屏气,造影数据采集时间为30 s,分析造影数据并存盘。根据活检结果分析肿瘤残留情况,分为残留、无残留组。比较两组超声相关定量参数,如峰值强度(IMAX)、峰值强度上升时间(RT)、达峰时间(TTP)。绘制ROC曲线分析各指标对肝癌射频消融术后残留的预测价值,获得曲线下面积等ROC曲线数据。
四、图像处理
通过图像处理技术对消融区域进行三维重建,并对阈值、透明度、旋转角度、亮度等予以调整,提高图像清晰度与立体感。由2名具有十年工作经验的检测医师阅片,并据此作出判断。当二者意见不一致时,经商讨后得出最终结果。病灶灭活评估:消融灶各期均未见增强,门脉期至延迟期,未见增强范围扩大,病灶微血管彻底消失为完全灭活;动脉期消融区域或周围可见强化区域,呈团状、结节状、乳头状或不规则状,延迟相/门脉相廓清,表现为低回声,提示病灶残留。
五、统计学方法
结 果
一、102例肝癌患者的活检结果分析
在102例患者中,有81例无病灶残留,占79.41%,有21例存在病灶残留,占20.59%。据此将其分成残留组(n=21)、无残留组(n=81)。
二、 两组IMAX、RT、TTP比较
残留组IMAX、RT、TTP分别为(213.65±20.43)%、(23.74±7.13)s、(26.81±8.72)s,无残留组分别为(115.72±31.56)%、(45.51±9.34)s、(54.71±8.52)s。残留组的IMAX显著高于无残留组(t=26.308,P=0.000)。残留组RT、TTP均显著小于无残留组(t=18.711、23.113,P=0.000、0.000)。
三、IMAX、RT、TTP对病灶残留的预测价值
IMAX、RT、TTP预测病灶残留的曲线下面积分别为0.792、0.724、0.779,三项联合预测的曲线下面积为0.899。以IMAX>178.385%、RT≤34.185 s、TTP≤31.950 s时,病灶残留风险越高,见表1。ROC曲线见图1。
讨 论
本研究针对102例肝癌射频消融术患者行三维超声造影检查,发现完全灭活率为79.41%,病灶残留率为20.59%,与既往研究[4]结论基本吻合。术后病灶残留是引起复发、影响患者预后的直接原因,临床必须及时发现残留病灶,并采取措施进一步治疗,改善生存质量。超声以安全、重复性好、廉价等特点,在众多疾病的诊断中均表现出满意效果,其中常规二维超声提供的信息较为有限,如仅能对消融病灶部位、形态、大小等进行观察,无法更好的显示局部微血流灌注情况[5]。因此,利用常规超声评估肝癌病灶残留的效果欠佳。3D-CEUS能将超声造影剂与三维成像技术结合,可获取局部组织血流灌注图像,并生成时间-强度曲线,为肿瘤治疗效果的评估提供更多信息[6]。本研究针对肝癌患者于术后3d行超声造影,笔者认为术后1个月可能出现复发性病灶,因此,术后3d行超声造影非常有必要。
笔者发现病灶残留患者的IMAX较无残留者显著增高,RT、TTP较无残留者显著下降,且经ROC曲线证实三者对于判断肝癌射频消融术后病灶残留均具有良好的可靠性,且三者联合可获得更为满意的结果。超声造影能明确病灶新生血管分支、管径大小、分布等情况,便于分析病灶血流灌注状态[7]。在注入造影剂后,可绘制时间-强度曲线,观察微循环血流灌注情况,这种检查方式能对造影强度及动态过程进行观察,明确局部血流与血管特点,评价血流动力学变化[8]。IMAX、RT、TTP是评价病灶血供的重要指标,其中IMAX能明确病灶整体血供变化,RT、TTP可明确真实时间参数[9]。通过分析IMAX、RT、TTP的变化,有利于了解消融区域的血供情况,分析治疗效果。笔者绘制了ROC曲线,获得了各指标预测病灶残留的最佳截断值,能为日后临床评估提供依据。

表1 IMAX、RT、TTP对病灶残留的预测价值
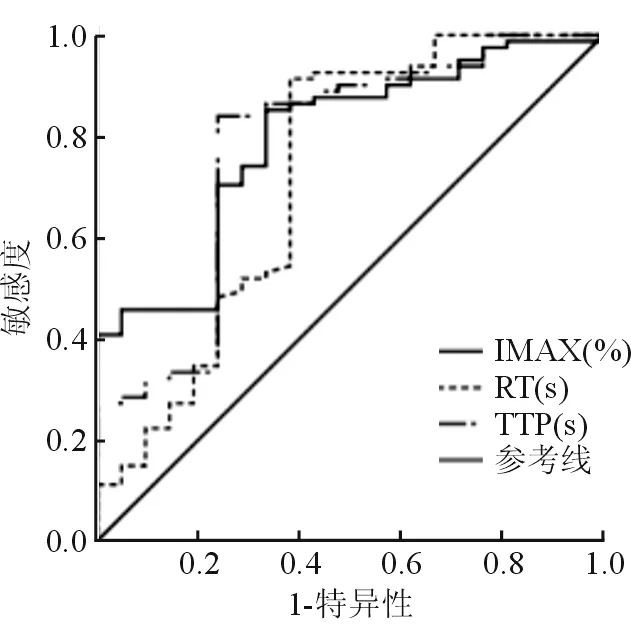
图1 IMAX、RT、TTP预测病灶残留的ROC曲线
综上,肝癌射频消融术患者于术后行三维超声造影,能明确IMAX、RT、TTP值,评估病灶残留风险,效果满意。此外本研究也有待后期继续完善,如仅选取102例患者,样本量少,未来将增加样本量对此予以分析。
