银白杨不定芽诱导与增殖分化研究
2020-07-02侯潇棐李永霞徐阿生杨小林
沈 霞 侯潇棐 李永霞 徐阿生 杨小林
(西藏农牧学院 资源与环境学院,西藏 林芝 860000)
杨树(Populusspp.)是三大速生树种之一,广泛投入于工业造纸,家具制作等市场应用中,但是,杨属中有些树种,例如白杨派树种,属于难生根树种,常规的繁育手段不能满足其大量的繁殖。随着科学技术的发展,植物组织培养成为解决苗木大量繁育的主要手段,杨树的离体再生也受到极大地关注和应用[1-5]
植物组织培养获得完整植株有两种途径:一是采用离体器官,如,带腋芽的茎段或植物叶片直接分化培养获得的不定芽,进而培养成完整植株的过程;二是由愈伤组织再分化产生不定芽,再获得完整植株。
银白杨(Populusalba),落叶乔木,树形高大,树叶银白且背面密被绒毛,喜光,耐寒耐旱、不耐荫[6],广泛分布于我国东北、华北、西南、西北等地,也是青藏高原和黄土高原用以防风固沙的主要造林树种之一[7]。银白杨在西藏主要分布于拉萨、林芝、山南等地,是西藏“一江两河”流域的主要栽培树种。银白杨应用广泛,但传统的繁育方式,如扦插等,难以使其生根成活[8],不能满足市场的大量需求,也限制了这一优良树种的推广和应用。为解决银白杨难以大量繁殖及市场供不应求的问题,发展银白杨的组织培养技术已是大势所趋。李慧等[9]利用银白杨的叶片作为外植体诱导不定芽的再生;李颖[10]曾利用银白杨的休眠芽作为实验材料进行离体再生研究;张绮纹等[11]做了银白杨杂交树种的组织培养。本文就银白杨组织培养中诱导不定芽再生与增殖分化做了初步研究,希望能为西藏地区银白杨的组培快繁的推广提供重要的科学依据和技术支撑。
1 银白杨不定芽诱导材料筛选
1.1 试验材料
银白杨供试材料取自于西藏农牧学院林学实验基地,长势优良,且带有多个饱满腋芽的1a生嫩枝。
1.2 试验方法
1.2.1银白杨培养材料筛选
1) 茎段不定芽诱导分化
以银白杨当年生嫩枝上带一个腋芽的茎段为外植体,以MS培养基为基本培养基;添加不同种类及不同浓度激素6-苄氨基嘌呤(6-BA):0.1,0.3,0.5mg/L 等3个水平;萘乙酸(NAA):0.1,0.3,0.5mg/L 等3个水平,共9组试验,将处理好的茎段接种在不同激素浓度的培养基上,每种处理接种30个外植体,3次重复,每5d观察1次,30d后统计茎段不定芽诱导率。浓度配比如表1所示。
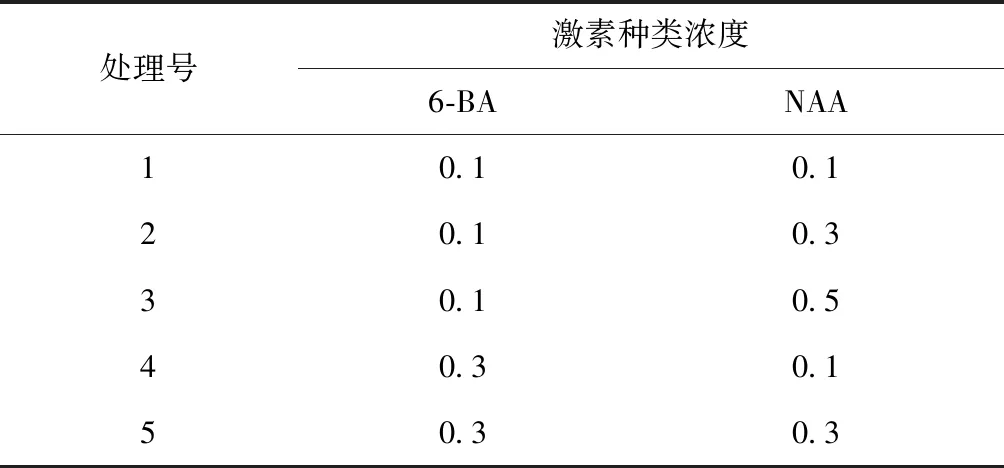
表1 茎段诱导不定芽激素浓度配比Tab.1 Stem segment induced adventitious bud hormone concentration ratio mg/L
(续表)
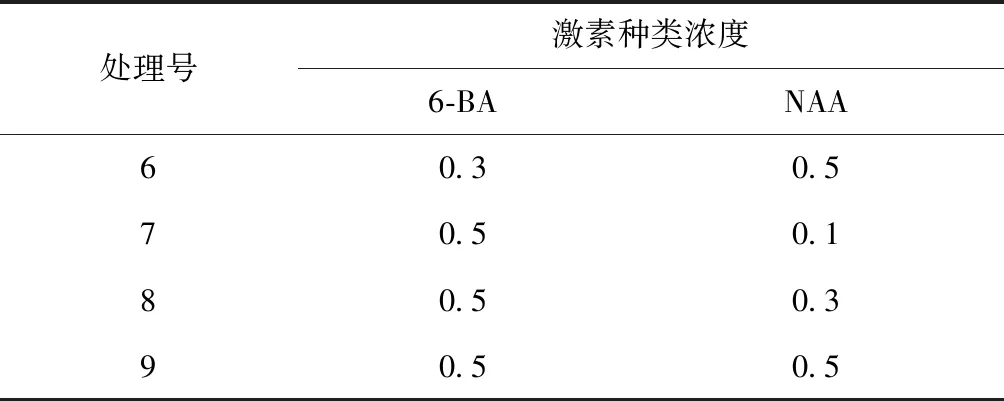
处理号激素种类浓度6-BANAA60.30.570.50.180.50.390.50.5
2) 叶片不定芽再生诱导
分别选择银白杨成熟母树上的叶片和经茎段,诱导不定芽获得的组培苗叶片。在无菌条件下,将叶片切成0.5cm2大小,在叶脉上划2~3刀,叶面向上平放于培养基上。叶片诱导不定芽,以MS为基本培养基,添加不同激素浓度,6-BA分别设置:0.5,1.0,1.5 mg/L 等3个水平;NAA分别设置:0.05,0.1,0.2mg/L 等3个水平,利用正交实验设计,共9组,每1处理接种30个外植体,3次重复。接种后,每5d观察1次,30d后统计出芽数,计算分化率。
1.2.2愈伤组织不定芽诱导
在茎段和叶片诱导不定芽过程中,会产生大量的愈伤组织。为获得大量的不定芽,在无菌条件下,将分化出的愈伤组织切块后接种在MS培养基中,添加不同浓度的植物生长调节剂6-BA:0.5mg/L,NAA:0.1,0.2mg/L,激动素(KT):0.1,0.2,0.3mg/L对其不定芽进行诱导。利用正交实验设计L9(34),共9个处理,每1处理接种30个外植体,3次重复。接种后,每5d观察一次,30d后统计不定芽诱导情况。
1.2.3银白杨不定芽继代增殖培养
1) 不定芽增殖激素筛选
将诱导获得的丛生芽从基部剪下,按2~3芽为一簇,接种在不定芽增殖的培养基上。以MS为基本培养基,选择添加不同浓度植物生长调节剂6-BA:0.5,1.0,1.5,2.0mg/L;NAA:0.05,0.1,0.2,0.3mg/L;KT:0.05,0.1,0.2,0.3 mg/L;吲哚丁酸(IBA):0.1,0.2,0.3,0.4 mg/L,采用正交实验设计L16(43),如表2所示,共16种处理,每种处理接种30簇丛生芽,3次重复,每5d观察并统计1次,30d后观察不定芽的增殖系数及不定芽生长情况。
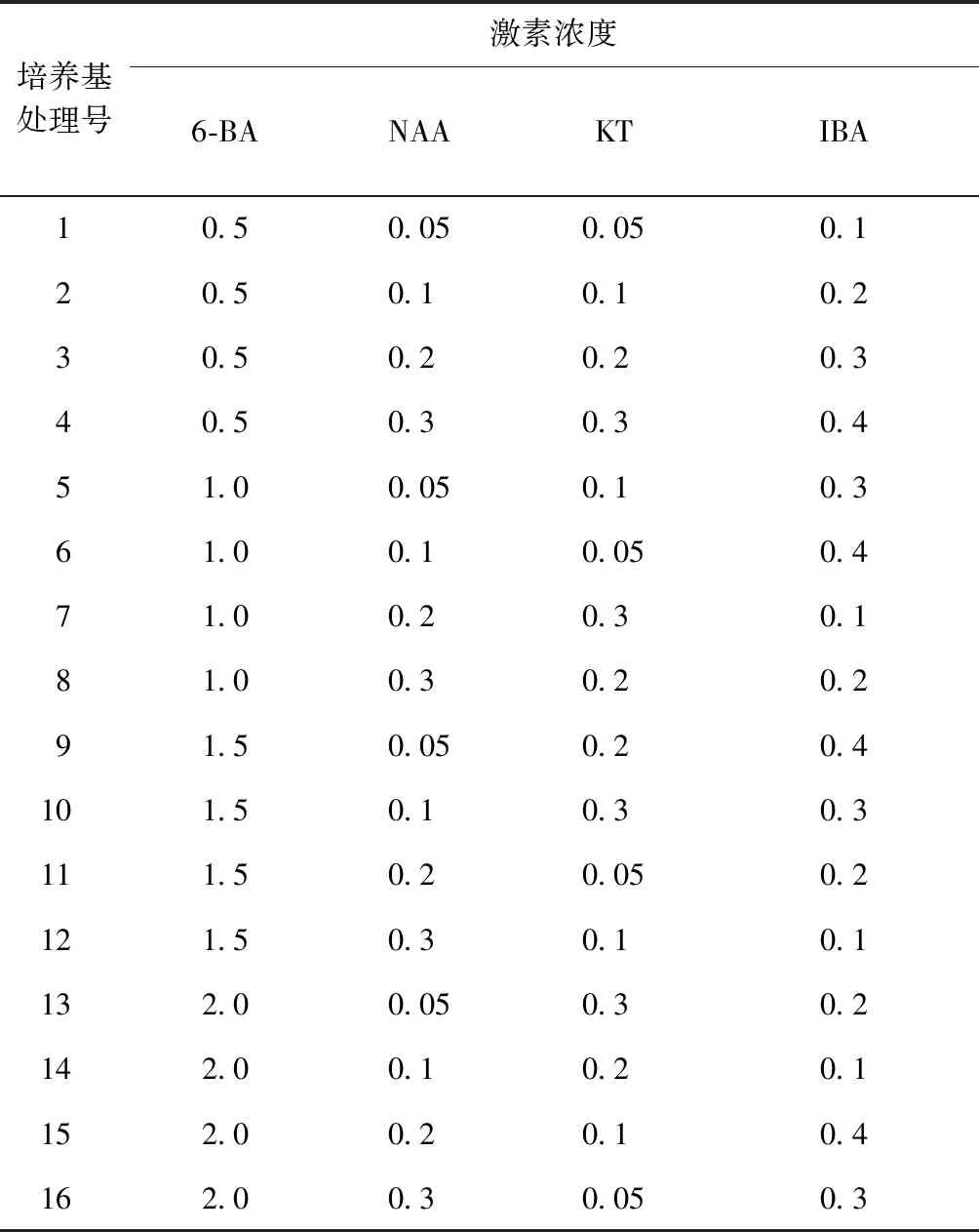
表2 不定芽增殖正交试验表Tab.2 The medium for adventition bud proliforation mg/L
2) 不定芽增殖pH筛选
将切割好的不定芽接种在筛选好的培养基上,pH值分别设置为5.4,5.8,6.2,6.6,6.8,记录观察芽的增殖情况。
2 结果与分析
2.1 银白杨茎段不定芽诱导结果分析
如图1(a)所示,茎段接入培养基7d后,7号处理腋芽开始萌动;如图1(b)所示,10d后,腋芽开始长出,叶嫩绿细长;如图1(c)所示,15d后,所有处理的腋芽都开始萌发,茎段长出新的侧枝,叶舒展,茎粗壮,由于带腋芽茎段的腋芽处于萌动阶段,所以,分化时间快。对不同激素种类及浓度处理的茎段不定芽诱导情况统计如表3所示。

图1 茎段诱导不定芽Fig.1 Adventitious buds induced by stem segments
表3 茎段诱导不定芽数据统计结果
Tab.3 Stem segment induced adventitious bud data statistical results
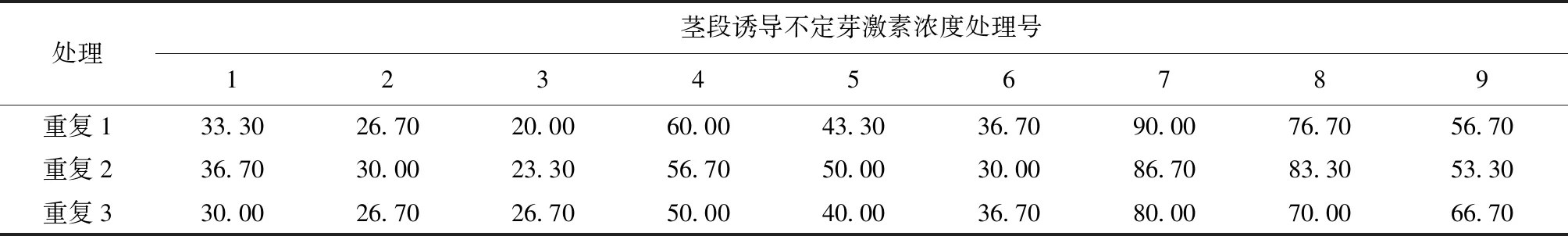
处理茎段诱导不定芽激素浓度处理号123456789重复133.3026.7020.0060.0043.3036.7090.0076.7056.70重复236.7030.0023.3056.7050.0030.0086.7083.3053.30重复330.0026.7026.7050.0040.0036.7080.0070.0066.70
对表3茎段不定芽的诱导结果进行方差分析,结果如表4所示,整个模型的F值为61.06,概率水平为0.00,其中,6-BA与NAA浓度的概率水平都为0.00,小于0.05,说明这两种激素浓度对不定芽的诱导率影响差异显著。
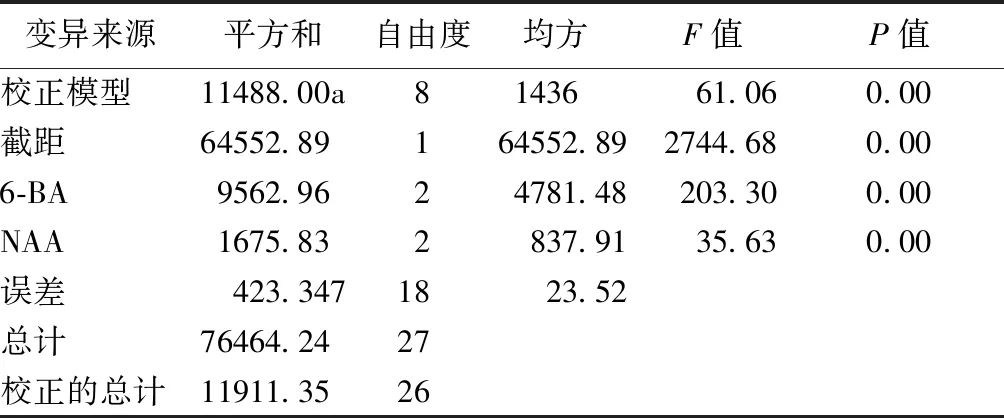
表4 茎段诱导不定芽方差分析Tab.4 Analysis of variance of induced shoot buds in stem segments
注:aR2=0.964(调整R2=0.949)。
为筛选出茎段不定芽诱导的最优激素浓度,对6-BA 与NAA各浓度阶段进行多重比较,分析结果如图2、图3所示。
由图2、图3可以看出,6-BA浓度为0.5mg/L时,茎段不定芽平均分化率达到最大,且与其他浓度处理差异显著;NAA浓度为0.1mg/L时,不定芽分化率最高。结合统计结果来看,6-BA与NAA两种激素浓度混合使用时,6-BA(0.5mg/L)+NAA(0.1mg/L)为银白杨茎段诱导不定芽的最优激素浓度组合。
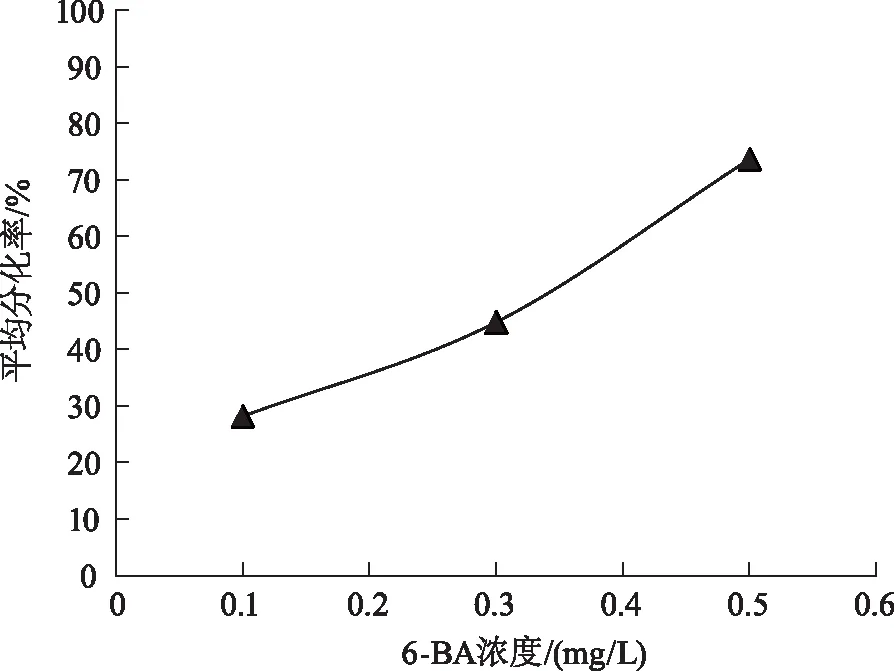
图2 6-BA各浓度茎段不定芽分化Fig.2 Adventitious bud differentiation of stem segments
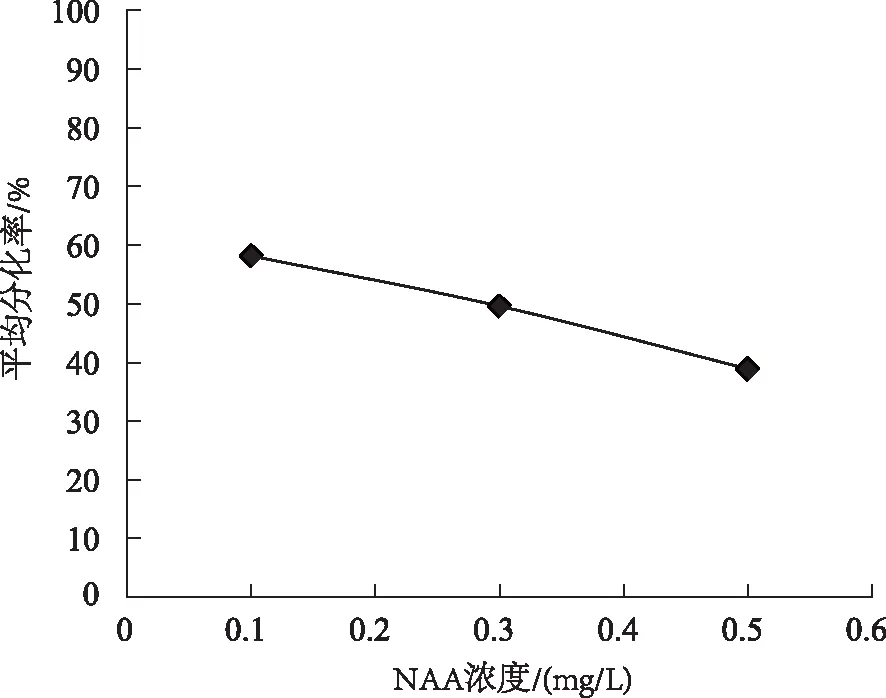
图3 NAA各浓度茎段不定芽分化Fig.3 Adventitious bud differentiation of stem segments atvarious concentrationsof 6-BA at various concentrations of NAA
2.2 银白杨叶片分化再生结果分析
在对银白杨初代叶片和继代叶片的不定芽过程中发现:初代叶片在接种后,生长初期随培养时间的延长,叶片切口处有明显的凸起和膨大增厚,切口边缘蜷曲;10d后切口处有愈伤组织产生(图4);如图5所示,20d后开始直接产生不定根,但未见不定芽产生;30d后基本停止生长。
继代叶片不定芽诱导培养中,7d左右就有愈伤组织产生,15d左右开始有不定芽(图6)和不定根,不同生长激素及含量对银白杨叶片不定芽诱导统计分析如表5所示。

图4 叶片分化愈伤组织Fig.4 Leaf differentiated callus

图5 叶片直接生根Fig.5 Direct rooting of leaves

图6 叶片诱导不定芽Fig.6 Adventitious buds induced by leaves
由表5可以看出,初代叶片培养中只有不定根产生,在继代叶片不定芽诱导中,不定芽与不定根同时出现,对于在不定芽诱导中出现的不定根这一结论,与陈彩霞等[12]曾在对110杨的再生研究中得出,杨树不定芽的诱导相较不定根的诱导更难的结论相符合。
由表5可知,叶片分化率最高的激素浓度比例为6-BA∶NAA为5∶1,不论是在初代叶片出现的生根情况还是继代叶片不定芽的诱导率,6-BA∶NAA=5∶1都是理想的激素比例。这与沈周高等[13-14]在对其它杨树的研究中发现的6-BA与NAA的激素比例在10∶1~4∶1之间,有利于杨树的不定芽产生的结果一致。诱导率最低的为9号处理,6-BA浓度为1.5mg/L,这说明在组织培养中,激素的使用既要考虑其浓度,也要考虑其浓度之间的比例。
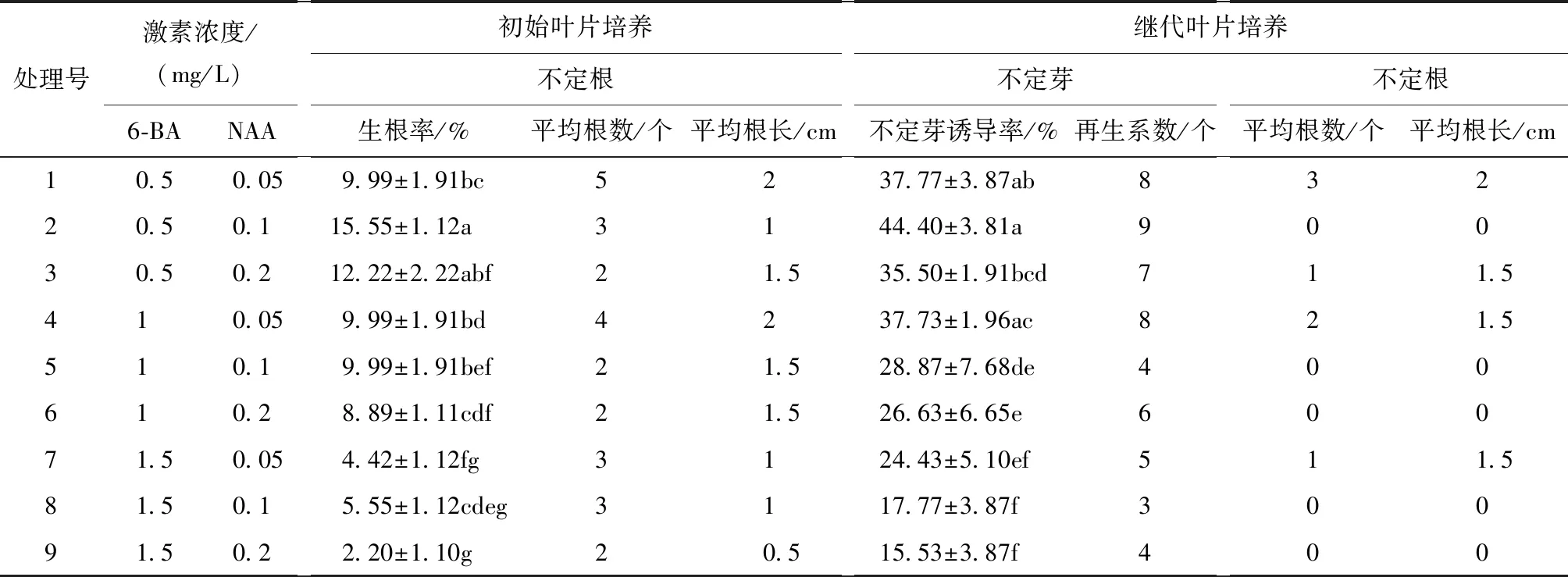
表5 不同生长激素及含量对银白杨叶片不定芽诱导的比较Tab.5 Effect of basic medium on the uncertain bud induction
注:表中同列不同字母表示差异显著(P<0.05),相同字母表示差异不显著(P>0.05)。下同。
银白杨初代叶片和继代叶片在培养中出现的不同现象,与朱淑新[15]在成熟的毛白杨叶片培养中得出的,成熟的毛白杨叶片诱导不定芽中,只见不定根的产生,未见分化出不定芽的结果一致。这可能与成熟的组织材料中含有较高的IAA有关,较高的IAA可以抑制芽的分化,对生根有促进作用[16]。
2.3 愈伤组织诱导不定芽结果分析
为获得大量的不定芽,对分化的愈伤组织进行不定芽的诱导。如图7(a)—(c)所示,愈伤组织接种在诱导芽分化的培养基上,前期体积开始不断增大,并未见不定芽产生,在培养14d左右以后,开始陆续有不定芽产生;培养30d后,愈伤组织诱导出大量不定芽,芽高2~3cm。对诱导率及不定芽再生系数进行统计,不同激素浓度对愈伤组织诱导不定芽分析结果如表6所示。

图7 愈伤组织诱导的不定芽Fig.7 Adventitious buds induced by callus
表6 不同激素种类浓度对愈伤组织诱导不定芽的影响
Tab.6 Effect of different hormone concentrations on callus induced adventitious bud
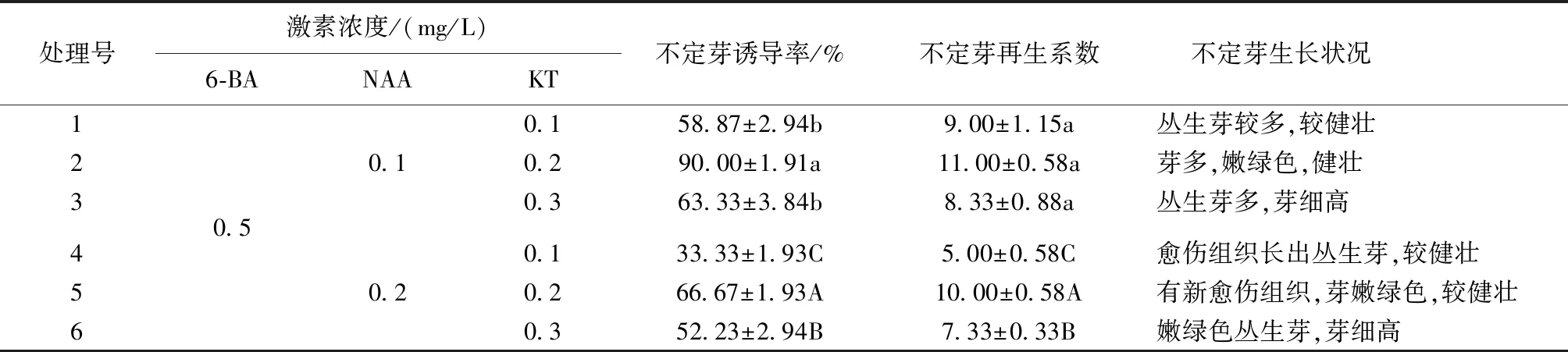
处理号激素浓度/(mg/L)6-BANAAKT不定芽诱导率/%不定芽再生系数不定芽生长状况1234560.50.10.20.158.87±2.94b9.00±1.15a丛生芽较多,较健壮0.290.00±1.91a11.00±0.58a芽多,嫩绿色,健壮0.363.33±3.84b8.33±0.88a丛生芽多,芽细高0.133.33±1.93C5.00±0.58C愈伤组织长出丛生芽,较健壮0.266.67±1.93A10.00±0.58A有新愈伤组织,芽嫩绿色,较健壮0.352.23±2.94B7.33±0.33B嫩绿色丛生芽,芽细高
注:表中小(大)写字母表示在NAA0.1(0.2)情况下KT不同浓度对不定芽诱导影响的显著性;同列相同字母表示差异不显著(P>0.05),不同字母表示差异显著(P<0.05)。
由表6可以看出,在利用愈伤组织诱导不定芽的过程中,6-BA与NAA的单独浓度比例为5∶1时,最有利于芽的分化。在加入KT的培养基中,不定芽的平均诱导率较可观,在6-BA与NAA不同比例的培养基中,KT的浓度为0.2mg/L时,不定芽的诱导率与不定芽的再生系数都明显高于其他浓度处理,在6-BA∶NAA∶KT的比例为5∶1∶2时,不定芽的诱导率为最高,达到90%,且不定芽的再生系数也为6种处理中最高的。综合各种因素得出MS+6-BA(0.5mg/L)+NAA(0.1mg/L)+KT(0.2mg/L)为愈伤组织不定芽诱导最适宜的培养基。
2.4 不定芽增殖结果分析
2.4.1不同激素种类及浓度对不定芽增殖的影响
将增殖培养的丛状苗接种在增殖培养基中,培养7d后,少有幼芽产生,增殖芽苗开始长高;培养15d左右,开始有新的不定芽产生;30d后基本停止增殖。统计结果如表7所示。
对不定芽增殖系数(表7)进行方差分析,结果如表8所示,不同激素对不定芽的增殖系数都存在显著差异的影响。
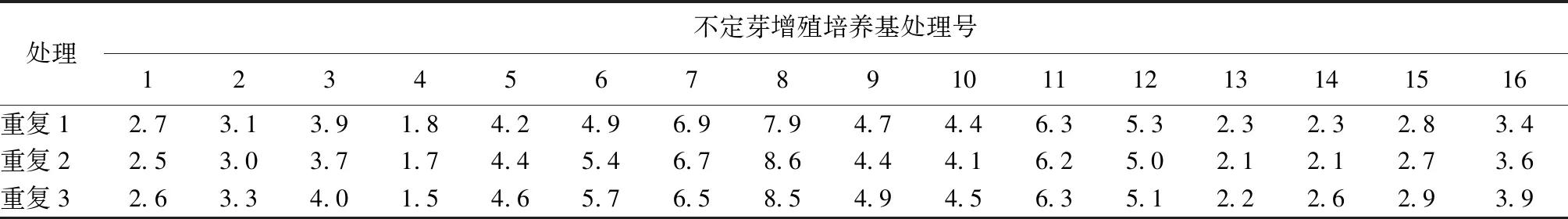
表7 不定芽增殖系数数据统计结果Tab.7 Statistical results of adventitious bud multiplication coefficient data
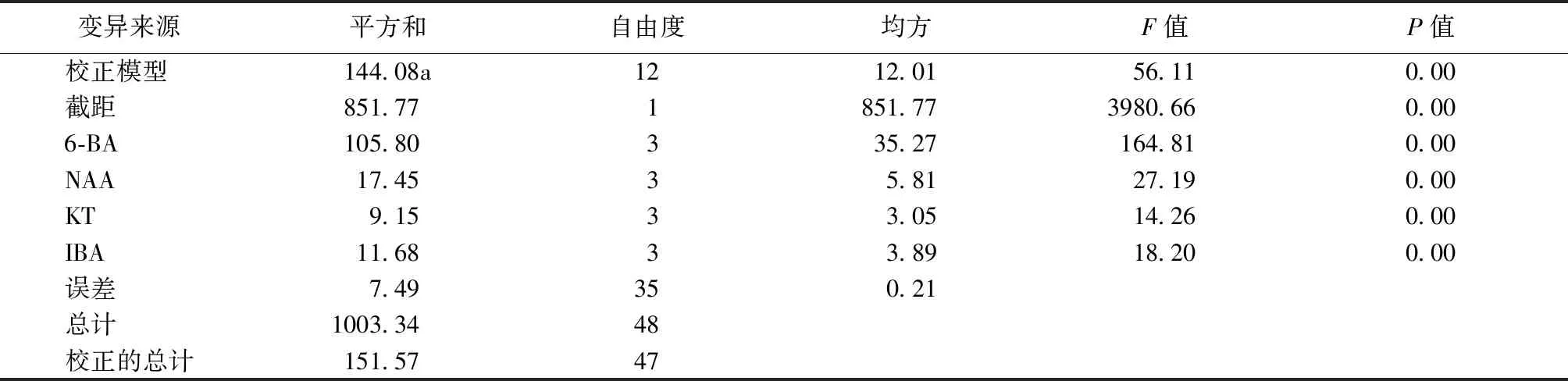
表8 不定芽增殖系数的方差分析Tab.8 Analysis of variance of adventitious bud proliferation coefficient
注:aR2=0.990(调整R2=0.986)。
由表8看出,不同激素对不定芽增殖影响差异显著,要筛选出最佳的激素浓度,需要对不同激素的不同水平进行多重比较,分析结果如表9所示。
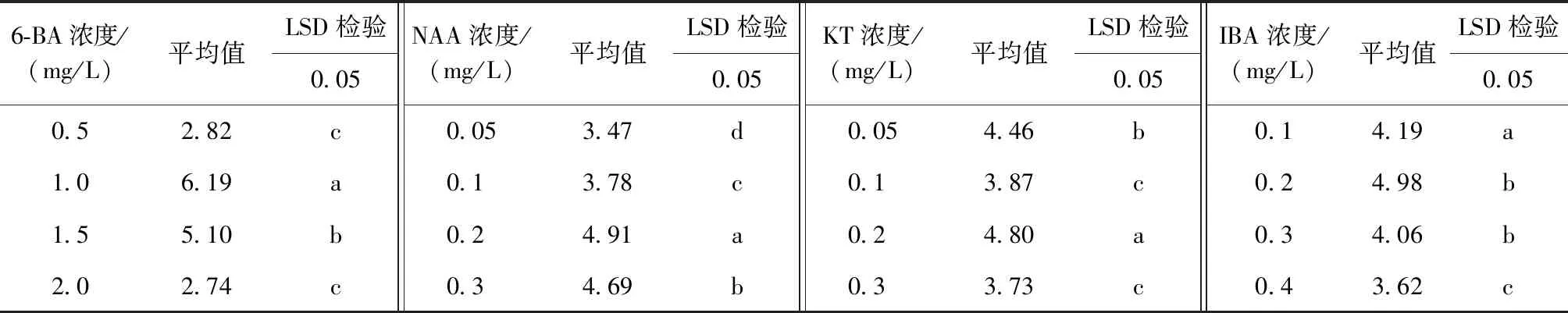
表9 不定芽增殖系数多重比较Tab.9 Multiple comparisons of adventitious bud multiplication coefficients
注:表中同列不同小写字母表示在(P<0.05)水平上差异显著,相同字母表示在(P<0.05)水平上差异不显著。
由表9可以看出,6-BA各浓度水平中,1.0mg/L与其他浓度差异显著,且平均增殖系数最高,为6.19,明显高于其他水平,因此,在不定芽增殖中,6-BA的最佳浓度为1.0mg/L。 NAA各水平之间的差异均显著,根据平均值的大小,0.2mg/L为不定芽增殖的最佳NAA浓度。 KT各浓度之间的差异水平为0.2mg/L与其他浓度的平均值都有显著差异,且不定芽增殖系数最高,为4.80,所以,在不定芽的增殖试验中,KT的最佳浓度为0.2mg/L。IBA不同浓度之间的差异水平为0.2mg/L与0.3mg/L之间的差异不显著,但均与0.1mg/L,0.4mg/L差异显著,0.1mg/L与0.4mg/L之间差异显著,根据增殖系数的平均值大小来看0.2mg/L的不定芽平均增殖系数最大,因此,认为不定芽增殖中IBA的最佳浓度为0.2mg/L。综合所有因素考虑,银白杨不定芽增殖的最佳培养基为MS+6-BA(1.0mg/L)+NAA(0.2mg/L)+KT(0.2mg/L)+IBA(0.2mg/L)。
2.4.2pH值对不定芽增殖的影响
由图8可以看出,pH对不定芽的增殖也有一定的影响,pH在5.8时,增殖系数达到最高,且与其他pH值的平均增殖系数都有显著差异。pH在5.4和6.8时,平均增殖系数较低,无显著差异,均与pH5.8,6.2,6.6平均增殖系数差异显著。因此,认为在银白杨不定芽增殖中,pH值调至5.8左右即可。
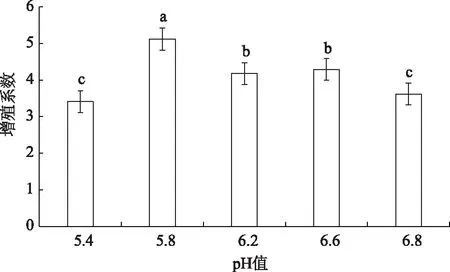
注:图中不同小写字母表示在(P<0.05)水平上差异显著,相同字母表示在(P<0.05)水平上差异不显著。
图8 pH值对不定芽增殖系数的影响
Fig.8 Effect of pH value on adventitious bud proliferation coefficient
3 讨论与结论
1) 在对两种不同离体材料的不定芽诱导中,MS+6-BA(0.5mg/L)+NAA(0.1mg/L)为不定芽诱导的最佳培养基。试验表明:由于带腋芽茎段,其腋芽处于萌动阶段,且茎段中含有的营养物质较高;相对其他培养材料,不定芽分化所需时间短,诱导率较高,且利用带腋芽茎段诱导不定芽程序简单,属于不定芽直接萌发,没有育苗风险,有基于此,茎段为不定芽诱导的最佳材料。
2) 对愈伤组织进行不定芽的诱导,结果显示:在6-BA(0.5mg/L)+NAA(0.1mg/L)加入激动素KT愈伤组织不定芽诱导率可观,在KT的浓度为0.2mg/L时,愈伤组织不定芽诱导率最高。
3) 继代增殖是植物组织培养中获得大量培养材料的重要手段,也是组培快繁获得大量苗木的关键,本试验银白杨不定芽增殖分化的最佳培养基为MS+6-BA(1.0mg/L)+NAA(0.2mg/L)+KT(0.2mg/L)+IBA(0.2mg/L),且分化出的芽体颜色健康,茎粗壮。培养基的pH值对不定芽的增殖也有显著的影响,一般认为木本植物的pH值在5.6~6.0之间,本试验得出,pH5.8为银白杨不定芽增殖的最适宜的pH值。
4) 影响银白杨不定芽诱导的因素不是单一的,是多因素交互影响产生的结果,带腋芽茎段为银白杨不定芽直接诱导的最佳外植体,这与大多数杨树研究结果一致[17]。这种情况可能与植物体内不同部位内源激素的分布有关[18-19]。在对不同幼化程度的银白杨的叶片进行不定芽诱导的过程得出,经继代培养的银白杨叶片的分化率高于初代培养的银白杨叶片。有研究表明,幼化的培养材料中所含的内源激素的浓度发生变化,对再分化率有影响[20]。
培养基中的激素种类及浓度的不同,影响外植体的分化和生长的能力[21-22],配合使用激素,使其之间的生物学效应互补[23]。在植物组织培养中,对芽的分化与增殖,多采用高浓度的细胞分裂素6-BA[24-26],试验证明,过高的细胞分裂素会抑制不定芽的分化。所以,在考虑植物生长调节剂对植物分化的影响时,要同时考虑激素浓度与浓度比例对植物分化的影响[27]。
本文在对银白杨不定芽的诱导与增值研究中,仅针对不同材料的不定芽诱导,不同激素种类浓度对不定芽诱导与增殖,pH值对不定芽增殖的影响。在试验过程中的蔗糖固定为30g/L、琼脂固定为6g/L,没有对培养条件进行对比筛选,后期会进行更深层次的探究。
