LINC00176下调miR-761对胃癌细胞增殖、凋亡、迁移、侵袭的影响
2020-07-02宋志韬郑丹陈志涛甘洪颖吴凡周婷婷张姮
宋志韬 郑丹 陈志涛 甘洪颖 吴凡 周婷婷 张姮
(华中科技大学同济医学院附属武汉中心医院消化内科,湖北 武汉 430014)
胃癌是一种常见的消化系统恶性肿瘤〔1〕,晚期胃癌的治疗方式是以全身化疗为主的综合治疗,尽管化疗能够延长肿瘤患者的生存期,但副作用较明显〔2〕。而针对肿瘤特定靶点的小分子靶向药物因其不良反应较轻、耐药率低等优点受到关注,肿瘤进展中的相关信号通路及异常表达的相关基因均可作为潜在的作用靶点〔3〕。研究发现长链非编码RNA(lncRNA)在胃癌的发生发展中发挥重要作用,影响胃癌细胞的增殖、凋亡、转移和预后等〔4〕。微小RNAs(miRNAs)是一种非编码RNAs,调控与胃癌进程密切相关的基因表达水平,影响胃癌的发生发展〔5〕。lncRNA可以结合miRNA参与调控胃癌进程,了解miRNA及lncRNA在胃癌中的具体作用机制,可以为胃癌的诊治提供新思路〔6〕。本文旨在研究lncRNA LINC00176与miR-761的调控关系及其对胃癌细胞增殖、凋亡、迁移、侵袭的影响。
1 材料与方法
1.1材料 胃癌细胞MGC-803、SGC-7901和正常胃黏膜细胞GES-1购自上海冠导生物工程有限公司;胎牛血清、RPMI-1640培养基、胰蛋白酶购自上海圻明生物科技有限公司;LipofectamineTM2000转染试剂购自上海伯易生物科技有限公司;四甲基偶氮唑蓝(MTT)试剂盒购自上海泽叶生物科技有限公司;二喹啉甲酸(BCA)试剂盒、聚偏氟乙烯(PVDF)膜、电化学发光法(ECL)发光液、RIPA蛋白裂解液购自北京凯瑞基生物科技有限公司;磷酸盐缓冲液(PBS)购自上海北诺生物科技有限公司;双荧光素酶报告基因检测试剂盒购自北京Solarbio公司;Trizol试剂、荧光定量试剂盒购自北京百奥莱博科技有限公司;Transwell小室、基质胶购于美国BD公司;膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)和碘化丙啶(PI)试剂盒购自上海恒斐生物科技有限公司。
1.2细胞培养 RPMI-1640培养基添加10%胎牛血清,将胃癌细胞MGC-803、SGC-7901和正常胃黏膜细胞GES-1置于上述培养液中,然后置于37℃、含5% CO2的培养箱中培养,每天换一次新鲜培养液,待细胞融和至70%左右时,加入0.25%胰蛋白酶进行消化传代。取对数生长期细胞进行实验。
1.3细胞转染与分组 对数生长期细胞SGC-7901用无血清培养基同步化12 h,随后进行转染。转染分为miR-NC组(转染miR-NC)、miR-761组(转染miR-761 mimics)、pcDNA3.1组(转染pcDNA3.1)、pcDNA3.1-LINC00176组(转染pcDNA3.1-LINC00176)、si-NC组(转染si-NC)、si-LINC00176组(转染si-LINC00176)、anti-miR-NC组(转染anti-miR-NC)、anti-miR-761组(转染anti-miR-761)、miR-NC+WT-LINC00176组(共转染miR-NC和WT-LINC00176)、miR-NC+MUT-LINC00176组(共转染miR-NC和MUT-LINC00176)、miR-761+LINC00176组(共转染miR-761和WT-LINC00176)、miR-761+MUT-LINC00176组(共转染miR-761和MUT-LINC00176)、pcDNA3.1-LINC00176+anti-miR-NC组(共转染pcDNA3.1-LINC00176和anti-miR-NC)、pcDNA3.1-LINC00176+ anti-miR-761组(共转染pcDNA3.1-LINC00176和anti-miR-761),转染按照LipofectamineTM2000试剂盒进行操作。
1.4MTT检测细胞增殖 取培养24、48、72 h时间点的各组细胞,然后每孔加入20 μl MTT溶液,孵育4 h后加入150 μl二甲基亚砜(DMSO),振荡充分反应10 min后用酶标仪检测波长为490 nm的各孔吸光度(OD)值。细胞增殖抑制率(%)=(1-实验组OD值/空白对照组OD值)×100%。
1.5Transwell检测细胞迁移和侵袭 对数生长期细胞调整浓度为2×104个/ml。细胞迁移实验:分别在Transwell小室的上室和下室计入200 μl细胞悬液和500 μl培养液,37℃培养24 h,然后用4%多聚甲醛固定,再用0.1%结晶紫染色,显微镜观察迁移细胞数并拍照。细胞侵袭实验:基质胶用6倍体积的RPMI1640培养液稀释后,添加在Transwell小室的上室,凝固后,按照细胞迁移实验步骤操作。
1.6流式细胞术检测细胞凋亡 收集各组培养48 h的细胞,漂洗后先后加入Annexin V-FITC和PI,避光孵育20 min,然后上机检测。实验重复3次。
1.7qRT-PCR检测miR-761和LINC00176表达 各组培养48 h的细胞提取总RNA,反转录成cDNA,按照荧光定量试剂盒说明书进行操作,循环条件为95℃变性30 s,60℃退火30 s,72℃延伸30 s,共40个循环;最后60℃再延伸5 min。以β-actin为内参进行PCR扩增,相对表达量用2-△△Ct法计算。
1.8Western印迹检测细胞周期蛋白(Cyclin)D1、P21、Bcl-2、Bax、基质金属蛋白酶(MMP)-2、E-钙黏蛋白(cadherin)蛋白表达 提取各组细胞总蛋白,BCA试剂盒定量后进行十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳,然后转至PVDF膜上,封闭液室温封闭1 h,加入一抗(1∶1 000),4℃孵育过夜,加入二抗(1∶2 000)室温孵育2 h,显影、定影、成像,测定蛋白条带的灰度值,以目的条带和GAPDH条带的比值作为蛋白相对表达水平。
1.9荧光素酶报告基因实验检测LINC00176和miR-761的靶向关系 使用PCR扩增包含miR-761结合位点的LINC00176序列片段,并构建至荧光素酶表达载体中,获得LINC00176野生型载体(WT-LINC00176),将LINC00176序列 CAACCTGCTG突变为CAAAGCACTG,获得LINC00176突变型载体(MUT-LINC00176),将WT-LINC00176、MUT-LINC00176分别与miR-NC、miR-761共转染至SGC-7901细胞中,转染48 h后,根据双荧光素酶报告基因检测试剂盒说明书检测荧光素酶活性。
1.10统计学分析 采用SPSS20.0软件t检验、方差分析。
2 结 果
2.1LINC00176在胃癌细胞和正常胃黏膜细胞中的表达 与正常胃黏膜细胞GES-1(1.33±0.12)相比,胃癌细胞MGC-803、SGC-7901中LINC00176的表达水平(0.67±0.04、0.35±0.02)显著降低(F=137.049,P=0.000)。
2.2过表达LINC00176对胃癌细胞增殖、凋亡的影响 与pcDNA3.1组相比,pcDNA3.1-LINC00176组胃癌SGC-7901细胞的抑制率显著升高(P<0.05)。Western印迹检测结果显示,与pcDNA3.1组相比,pcDNA3.1-LINC00176组胃癌SGC-7901细胞中Cyclin D1、Bcl-2蛋白表达显著降低,P21、Bax蛋白表达显著升高(P<0.05)。流式细胞仪检测结果显示,与pcDNA3.1组相比,pcDNA3.1-LINC00176组胃癌SGC-7901细胞的凋亡率显著升高(P<0.05)。见图1,图2,表1。
2.3过表达LINC00176对胃癌细胞迁移、侵袭的影响 pcDNA3.1-LINC00176组LINC00176水平(0.82±0.06)显著高于pcDNA3.1组(0.36±0.03,t=11.877,P=0.000)。与pcDNA3.1组相比,pcDNA3.1-LINC00176组MPP-2蛋白表达水平显著降低,E-cadherin蛋白表达水平显著升高(P<0.05)。Transwell 法检测结果显示,与pcDNA3.1组相比,pcDNA3.1-LINC00176组胃癌SGC-7901细胞迁移和侵袭数量显著降低(P<0.05)。见图3,图4,表2。
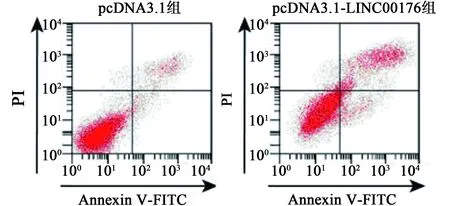
图1 过表达LINC00176对细胞SGC-7901凋亡的影响
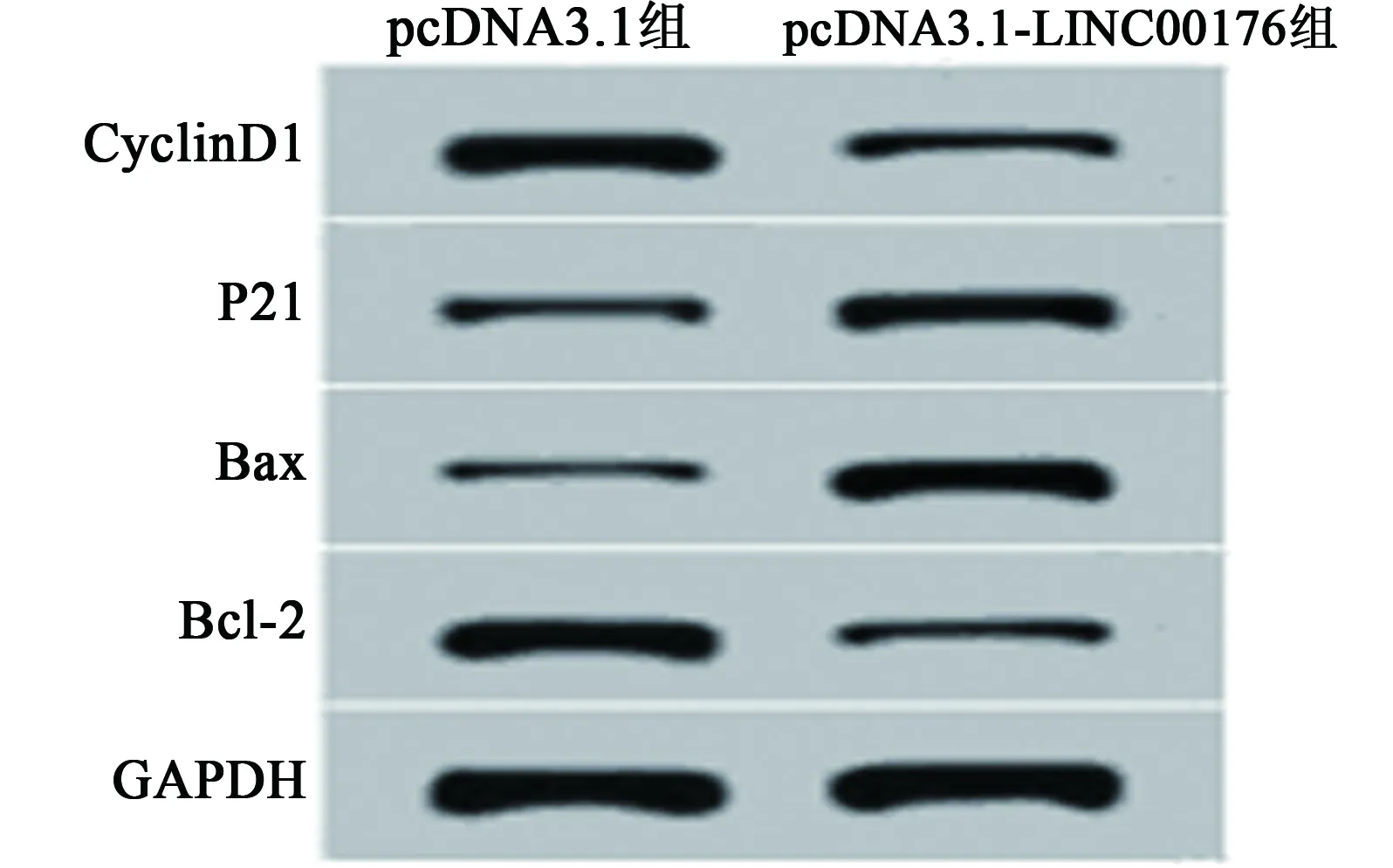
图2 过表达LINC00176对细胞SGC-7901增殖、凋亡蛋白表达的影响
表1 过表达miR-761对胃癌细胞SGC-7901增殖、凋亡的作用
与pcDNA3.1组比较:1)P<0.05;与pcDNA3.1-LINC00176+miR-NC组比较:2)P<0.05;同表2

图3 过表达LINC00176对胃癌细胞SGC-7901迁移、侵袭的影响(×200)
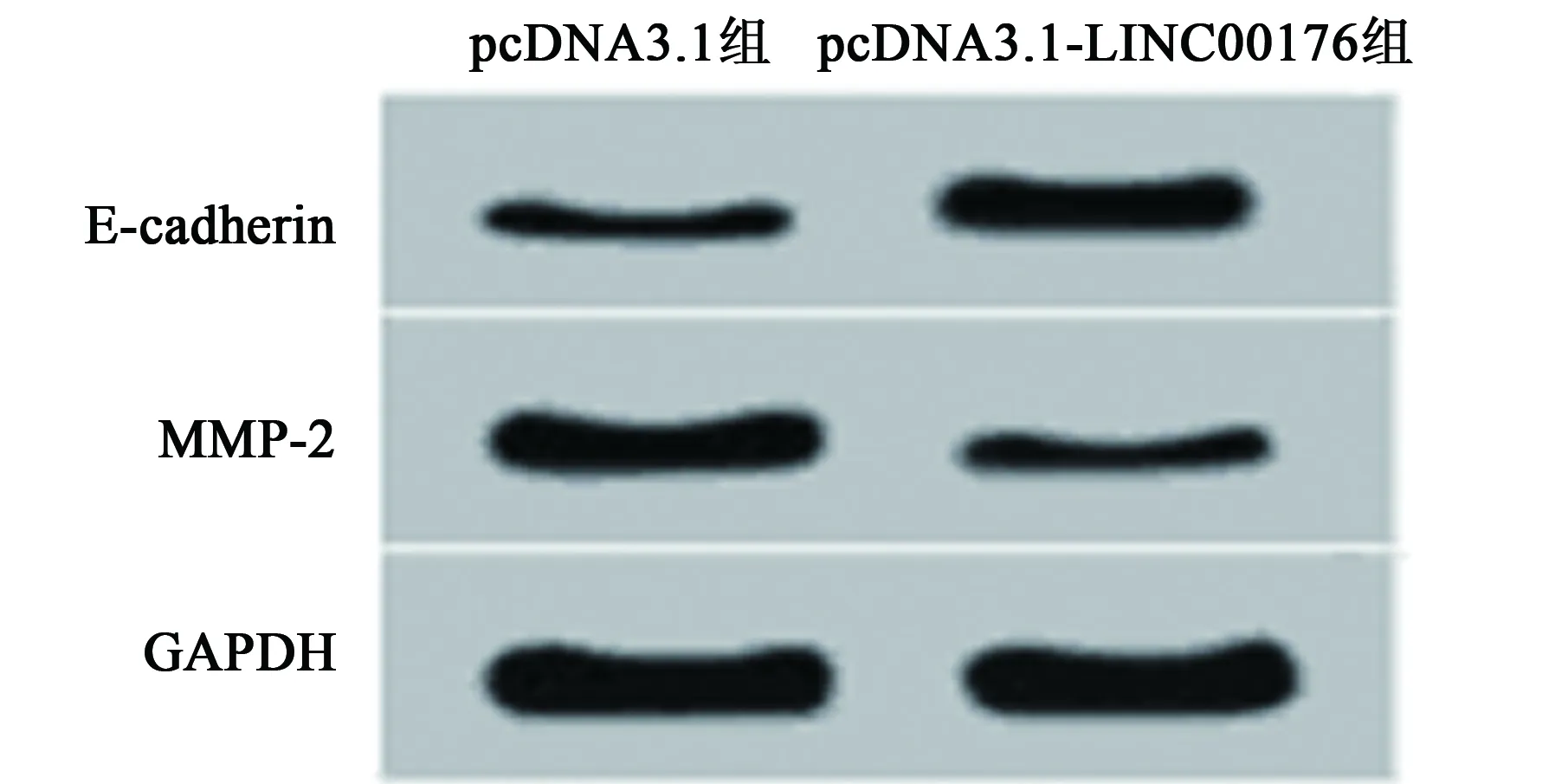
图4 过表达LINC00176对胃癌细胞SGC-7901迁移、侵袭蛋白表达的影响
2.4LINC00176靶向、调控miR-761 TargetScan数据库预测显示LINC00176与miR-761部分序列有结合位点(图5)。荧光素酶报告基因实验结果显示,相较于miR-NC组(1.03±0.08),miR-761组转染WT-LINC00176细胞的荧光素酶活性(0.22±0.02)显著降低(t=55.029,P=0.000);而转染MUT-LINC00176细胞的荧光素酶活性(1.01±0.09 vs 0.99±0.10)差异无统计学意义(t=0.364,P=0.723)。相较于pcDNA3.1组(0.77±0.06),pcDNA3.1-LINC00176组miR-761表达水平(0.16±0.01)显著降低;相较于si-NC组(0.74±0.06),si-LINC00176组miR-761表达水平(1.23±0.11)显著升高(P<0.05)。
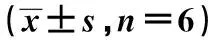
表2 过表达miR-761对胃癌细胞SGC-7901迁移、侵袭的作用
2.5抑制miR-761表达对胃癌细胞增殖、凋亡、迁移、侵袭的影响 与anti-miR-NC组相比,anti-miR-761组CyclinD1、Bcl-2、MPP-2蛋白表达水平显著降低,P21、Bax、E-cadherin蛋白表达水平显著升高(P<0.05)。MTT法检测结果显示,与anti-miR-NC组相比,anti-miR-761组胃癌SGC-7901细胞抑制率显著升高(P<0.05)。流式细胞仪检测结果显示,与anti-miR-NC组相比,anti-miR-761组胃癌SGC-7901细胞的凋亡率显著升高(P<0.05)。Transwell 法检测结果显示,与anti-miR-NC组相比,anti-miR-761组胃癌SGC-7901细胞迁移和侵袭数量显著降低(P<0.05)。见表3,图6。
图5 LINC00176靶向miR-761
表3 抑制miR-761表达对胃癌细胞SGC-7901增殖、凋亡、迁移、侵袭的影响
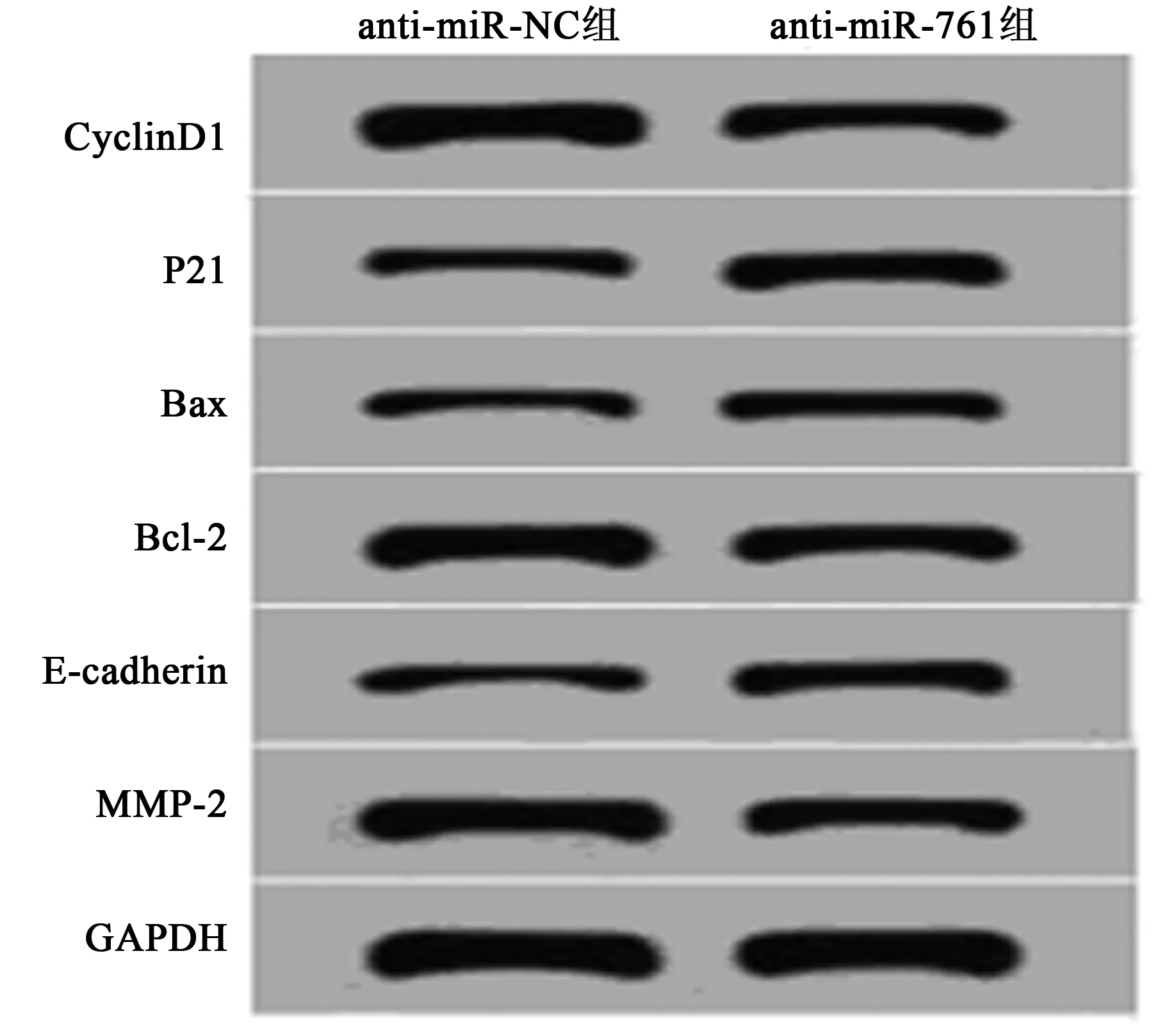
图6 抑制miR-761表达对细胞SGC-7901增殖、凋亡、迁移、侵袭蛋白表达的影响
2.6过表达miR-761能逆转LINC00176对胃癌细胞SGC-7901增殖、凋亡、迁移和侵袭的影响 Western印迹检测结果显示,与pcDNA3.1-LINC00176+miR-NC组相比,pcDNA3.1-LINC00176+miR-761组胃癌SGC-7901细胞中Cyclin D1、Bcl-2、MPP-2蛋白表达水平显著升高,P21、Bax、E-cadherin蛋白表达水平显著降低(P<0.05)。MTT法检测结果显示,与pcDNA3.1-LINC00176+miR-NC组相比,pcDNA3.1-LINC00176 +miR-761组胃癌SGC-7901细胞抑制率显著降低(P<0.05)。流式细胞仪检测结果显示,与pcDNA3.1-LINC00176+miR-NC组相比,pcDNA3.1-LINC00176+miR-761组胃癌SGC-7901细胞凋亡率显著降低(P<0.05)。Transwell 法检测结果显示,与pcDNA3.1-LINC00176+miR-NC组相比,pcDNA3.1-LINC00176+miR-761组胃癌SGC-7901细胞迁移和侵袭数量显著升高(P<0.05)。见表1,表2,图7。
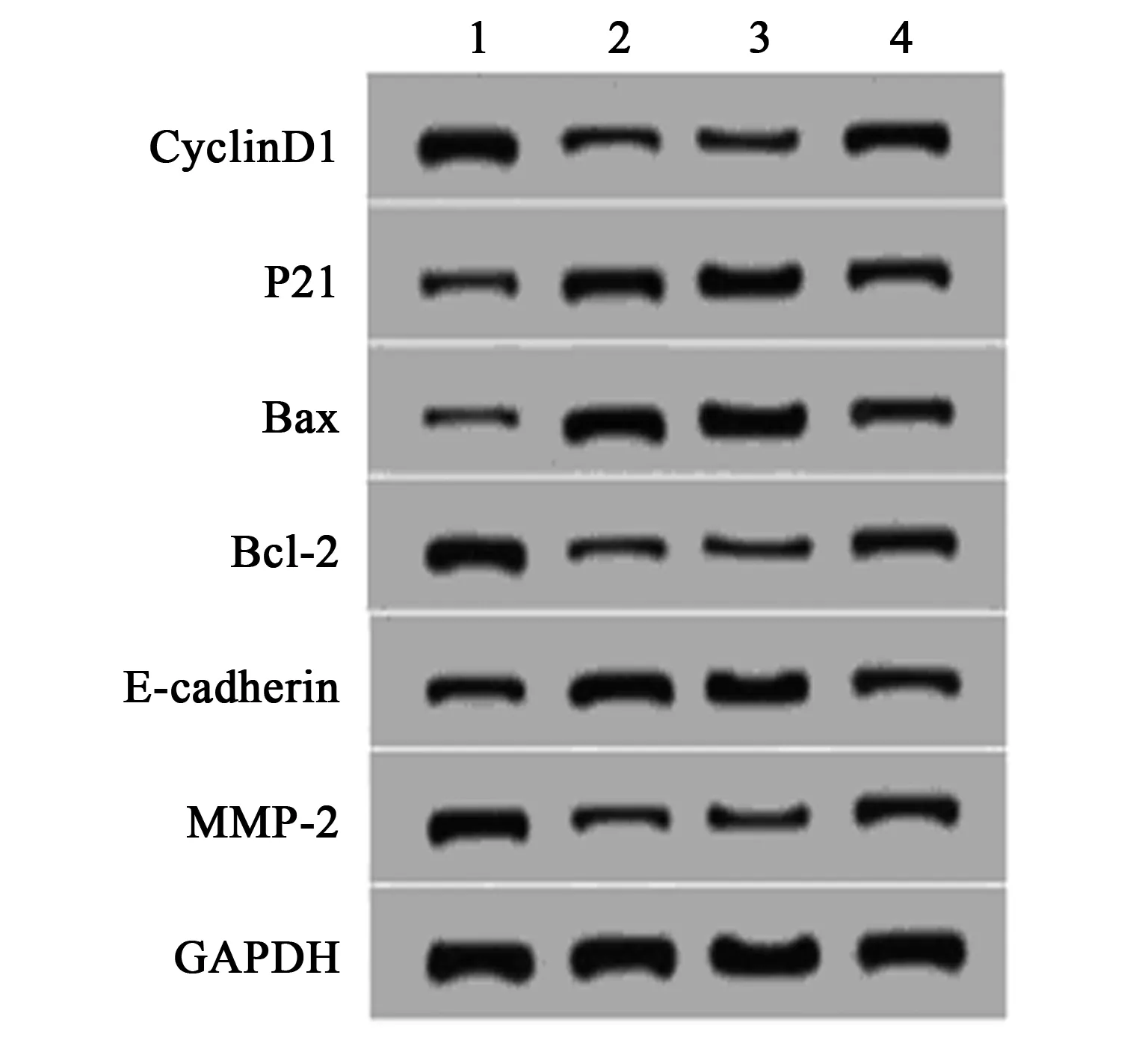
1~4:pcDNA3.1组、pcDNA3.1-LINC00176组、pcDNA3.1-LINC00176+miR-NC组、pcDNA3.1-LINC00176+miR-761组图7 增殖、凋亡、迁移、侵袭蛋白的表达
3 讨 论
胃癌发病率及死亡率在我国均居第二位,严重威胁人民生命健康〔7〕。研究发现胃癌的进展涉及一系列分子水平的变化,因此分子水平上的靶向治疗成为肿瘤治疗新的研究方向〔8〕。lncRNA是肿瘤生物学的重要组成部分,可用于胃癌的早期诊断,具有高灵敏度、高特异度等优点〔9〕。有研究通过生物信息学方法,筛选得到胃癌组织中差异表达的lncRNA,证明LINC00176在胃癌组织中下调表达〔10〕。Ddh等〔11〕发现LINC00176在肝细胞癌中高表达,LINC00176缺失通过释放肿瘤抑制miRNA破坏细胞周期并诱导肝细胞癌中的坏死性凋亡。食管癌中筛选的lncRNA中LINC00176在Cox回归分析中是负系数,说明其是保护性lncRNA,lncRNA高表达比低表达的患者总体存活期更长〔12〕。本研究结果显示,LINC00176在胃癌细胞中下调表达,过表达LINC00176可抑制胃癌SGC-7901细胞增殖、迁移和侵袭,促进细胞凋亡;且LINC00176靶向调控miR-761的表达。
研究表明miRNA参与胃癌发生、发展等过程,可作为胃癌诊断的生物标志物及治疗的潜在靶标〔13〕。研究报道miR-761通过靶向下调CRKL抑制了卵巢癌SKOV3细胞增殖〔14〕;miR-761在乳腺癌中高表达,通过靶向抑制TRIM29促进乳腺癌生长和转移〔15,16〕。miR-761在肝癌组织中高表达,通过抑制MFN2损伤线粒体功能且抑制肝癌细胞的生长和侵袭〔17〕。miR-761在非小细胞肺癌中显著上调表达,通过靶向ING4和TIMP2促进非小细胞肺癌的进展和转移〔18〕。而miR-761在结直肠癌中下调,过表达miR-761抑制结直肠癌细胞增殖和侵袭,增加对5-氟尿嘧啶的敏感性〔19〕。Hsa-circ-0007534可以通过调节miR-761调节胶质瘤细胞的增殖和迁移〔20〕。miR-761在胃癌组织和细胞中上调表达,miR-761过表达促进胃癌细胞增殖、细胞集落形成,miR-761可能是胃癌患者新的治疗靶位点〔21〕。本研究结果显示,抑制表达miR-761可抑制胃癌SGC-7901细胞增殖、迁移和侵袭,促进细胞凋亡;过表达miR-761能逆转LINC00176对胃癌细胞SGC-7901增殖、迁移、侵袭的抑制和凋亡的促进作用。
综上,lncRNA LINC00176可抑制胃癌细胞增殖、迁移和侵袭,促进其凋亡,其机制可能与靶向miR-761基因有关,将可为胃癌的预防和治疗提供新靶点和新思路。
