抑制MMP-9表达与大鼠氧糖剥夺后星形胶质细胞AQP4的表达变化
2020-07-02李燕华韦俊杰周礼圆范秉林陈志韦旋欧阳列锋
李燕华 韦俊杰 周礼圆 范秉林 陈志 韦旋 欧阳列锋
(广西壮族自治区人民医院神经内科,广西 南宁 530021)
在脑缺血早期,基质金属蛋白酶(MMP)-9的表达及其活性会受到血流动力学改变、损伤、炎症及氧化应激等因素影响而升高〔1〕,升高后MMP-9与脑缺血和脑水肿的发展呈平行关系〔2〕。水通道蛋白(AQP)4在星形胶质细胞上表达最为丰富,在脑组织水的运输和调节中起关键作用〔3〕,AQP4表达上调可能是脑水肿形成的一个重要致病环节。MMP-9的过度表达和激活在心血管疾病的病理生理过程中起重要作用〔4〕,但其在缺血性脑血管病继发性脑水肿中的机制尚不清楚。本研究旨在观察抑制MMP-9表达及氧糖剥夺后星形胶质细胞AQP4表达的变化。
1 材料和方法
1.1实验动物和主要试剂 2 d 新生SD大鼠(广西医科大学实验动物中心提供)。小牛血清、DMEM(Hyclone公司),兔抗AQP4抗体(Abcam公司),兔抗MMP-9抗体购自Proteintech公司,相应的二抗和鼠抗GAPDH抗体购自Santa Cruz公司。MMP-9、AQP4和β-actin的RT-PCR引物合成由上海吉凯生物公司提供。
1.2星形胶质细胞培养 取2 d新生SD大鼠,75%酒精浸泡消毒后,断头取皮层组织,入冰冷D-hanks液中仔细剥除软脑膜和皮层血管,反复轻柔吹打制成细胞悬液,过滤,收集滤液,然后转入70 ml培养瓶中,37℃、5% CO2培养箱中静置培养,细胞培养1 w左右进行缺糖缺氧处理。取传代2次的细胞进行星形胶质细胞特异性蛋白神经脑质纤维酸性蛋白(GFAP)免疫细胞化学染色,证实为星形胶质细胞。本实验均使用培养第2代的星形胶质细胞。
1.3缺血细胞模型的制备 将细胞培养板置于特制有机玻璃通气槽内,加入无糖培养基,持续通入不含氧的混合气体(5%CO2+95%N2)来模拟缺糖缺氧环境,密封,置于37℃温箱内,并调节气流量的流速,要求气体流速为5 L/min。经缺糖缺氧处理至少12 h后,可转移到正常氧浓度和含糖培养基条件下继续培养2 h,模拟细胞缺血损伤的病理生理学过程。
1.4慢病毒转染 星形胶质细胞及实验分组按照上海吉凯生物公司的慢病毒手册,按照不同的复感染指数(MOI),在星形胶质细胞培养第2天时,进行慢病毒转染,24 h后,更换为完全培养基培养,培养72 h 后,通过倒置荧光显微镜来观察细胞内绿色荧光蛋白(GFP)的表达。实验分为3组,正常组不制成缺血细胞模型;阴性对照组:加入阴性对照siRNA后,再制成缺血细胞模型;MMP-9抑制组:经慢病毒转染细胞后,再制成缺血细胞模型。
1.5四甲基偶氮唑蓝(MTT)比色测定法检测细胞活力 分别取各组细胞,每组孔数为6孔,每孔加入15 μl/ml MTT(5 mg/ml)置于37℃ 5 % CO2培养箱孵育4 h后,吸出孔内液体,然后加150 μl二甲基亚砜至MTT反应结晶产物完全溶解,在全自动酶标仪上,测定波长为570 nm,检测每孔光密度(OD)值。
1.6免疫印迹法检测AQP4蛋白表达 收集各组细胞,细胞加入组织裂解液后离心提取总蛋白,采用Bradford法蛋白定量,在十二烷基硫酸钠(SDS)聚丙烯酰胺凝胶每个点样孔中加入5 μg蛋白进行电泳,待确定片段大小后,免疫印迹转染到聚偏二氟乙烯膜,加封闭液室温封闭1 h,继之用目的蛋白AQP4和GAPDH的一抗4℃过夜孵育,再用结合辣根过氧化物酶的二抗孵育。化学发光法显现蛋白带并照相,用 Lab4.3对条带进行密度分析。
1.7实时荧光定量RT-PCR法检测MMP-9和AQP4 mRNA表达 直接提取细胞RNA,将适量RNA进行逆转录成cDNA,根据以往研究〔5〕方法,MMP-9上游引物序列:5′-GTCCAGACCAAGGGTACAG-3′,下游引物序列:5′-TTAGAGCCACGACCATACAG-3′,扩增片段为:181 bp;AQP4上游引物序列:5′-GAGGCGGTGGGGTAAGTGT-3′,下游引物序列:5′-TCCAAAGCAGAGGGAGATG-3′,扩增片段为214 bp;β-actin上游引物序列:5′-TTCAACGGCACAGTCAAGG-3′,下游引物序列:5′-CTCAGCACCAGCATCACC-3′,扩增片段114 bp。用SYBR green荧光定量检测法进行实时荧光定量PCR检测mRNA表达。
1.8统计学分析 采用SPSS16.0软件进行SNK-q检验、单因素方差分析。
2 结 果
2.1MTT法检测细胞活性 细胞经氧糖剥夺和慢病毒转染MMP-9处理后,正常组OD值为 0.25±0.01,阴性对照组为 0.16±0.001,MMP-9抑制组为0.15±0.003,MMP-9抑制组和阴性对照组OD值明显低于正常组(P<0.01);MMP-9抑制组与阴性对照组比较差异无统计学意义(P>0.05)。
2.2各组MMP-9表达水平比较 阴性对照组和MMP-9抑制组转染后72 h,和阴性对照组(1.105±0.236)相比,MMP-9抑制组MMP-9 mRNA表达水平(0.515±0.197)明显下降(P<0.05),MMP-9抑制组与正常组(0.352±0.086)相比,差异无统计学意义(P>0.05)。
2.3各组AQP4 mRNA表达 与阴性对照组(1.122±0.175)比较,MMP-9抑制组AQP4 mRNA(0.702±0.082)显著下降,差异有统计学意义(P<0.05);MMP-9抑制组与正常组(0.585±0.046)差异无统计学意义(P>0.05)。
2.4各组AQP4 蛋白表达比较 正常组细胞AQP4蛋白表达灰度值为0.655±0.086,阴性对照组为1.007±0.175,MMP-9抑制组为0.745±0.107,MMP-9抑制组明显低于阴性对照组(P<0.05),见图1。
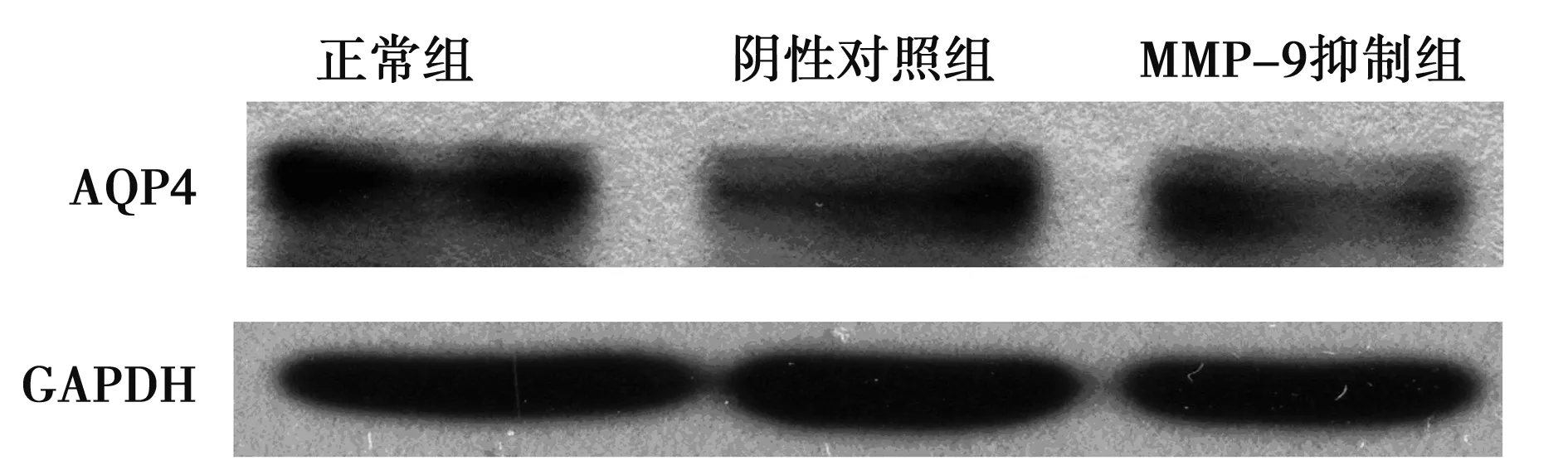
图1 免疫印迹检测各组细胞AQP4蛋白表达
3 讨 论
星形胶质细胞是中枢神经系统内数量最多和分布广泛的细胞群体,也是中枢神经系统的主要胶质细胞,在神经系统的修复和再生、物质代谢和神经病理过程中具有重要作用。已有研究显示,无论是细胞毒性脑水肿还是血管源性脑水肿,星形胶质细胞均是脑创伤和脑缺血后肿胀细胞的主要类型,其肿胀均发生在脑水肿的早期,为脑水肿发展过程中的一个重要表现。星形胶质细胞肿胀及随后的应激反应可能是脑损伤后主要的早期病理现象〔3〕。脑缺血时星形胶质细胞可通过调节细胞外环境、产生和释放生长因子,提供代谢底物支持神经元的存活,同时参与炎症反应加重脑水肿的形成。脑细胞的水转运主要通过AQP来完成,其中AQP4是脑内表达最丰富、转运效率最高、主要表达于星形胶质细胞的AQP〔3,5〕。已有研究显示,AQP4作为介导水分子运输的主要调节因子,其表达上调可能是脑水肿形成的一个关键致病因素,已证实对中枢神经系统的代谢和大脑水平衡的调节起至关重要的作用〔6〕。目前主要观点认为,脑缺血早期AQP4的增多会导致水入量增多,加重脑水肿形成,而后期的AQP4则促进细胞内过多水的流出〔7〕,在脑缺血早期短暂抑制AQP4的升高能减轻脑水肿的形成〔4〕。已有研究发现,MMP-9的过度表达和激活在心血管疾病的病理生理过程中起重要作用〔4〕,但在缺血性脑水肿中的作用机制尚不清楚。脑缺血后损伤主要表现为缺氧和缺糖,脑细胞损害的本质主要是脑组织氧、糖缺乏而导致的结果,大多患者主要选择性去除具有至关重要作用的葡萄糖和氧以代表缺血所致的低营养条件。目前氧糖剥离是一种公认的离体缺血缺氧模型,因此本研究采用体外缺氧缺糖处理模拟星形胶质细胞的缺血性损伤,观察细胞在缺血缺氧早期抑制MMP-9表达对氧糖剥夺后星形胶质细胞AQP4表达的影响,以期为临床急性脑缺血的早期干预治疗提供理论基础。细胞培养使脑细胞基本保持了体内生长、发育和分化过程中的理化特点,且能在较长时间内直接观察细胞在生长和分化过程中形态及功能的改变,也可方便使用各种方法进行研究,而且不受体内多种因素的影响。MTT检测法能比较客观地反映细胞的活性,活细胞线粒体内琥珀酸脱氢酶活性决定OD值的大小,能间接反映活细胞的数目,OD值越大,活细胞越多。本研究结果提示,细胞在氧糖剥夺后,不仅不能良好生存,而且星形胶质细胞受损必然会影响神经系统其他细胞的正常功能和内环境的稳定。缺血性脑水肿是导致脑缺血严重并发症甚至死亡的关键病理因素,目前其发生和发展的分子机制尚未阐明〔8〕。本研究结果表明,抑制细胞MMP-9的表达在转录和翻译水平均可诱导AQP4表达下调,进而参与影响脑水肿的进展,提示在脑缺血的早期,MMP-9可能通过调节星形胶质细胞AQP4的表达水平来参与缺血性脑水肿的病理生理过程,该作用可发生于基因转录和蛋白水平。
综上,星形胶质细胞缺氧缺糖损伤后,抑制MMP-9表达可介导AQP4表达下调,提示MMP-9和AQP4可能共同参与缺血性脑水肿的形成。
