血清前白蛋白总胆红素比值在肝脏TACE术患者预后评估中的应用价值
2020-07-02程序周英发贾萌萌刘芳马艳萍黄琳凯丁小丹
程序 周英发 贾萌萌 刘芳 马艳萍 黄琳凯 丁小丹
统计表明,肝癌的新发病例和死亡病例超过半数发生在我国,按照国内癌症登记注册地域的最新数据显示所有恶性肿瘤中肝癌发生率排第四位,病死率排第三位[1]。随着现代医学技术的进步,肝癌的治疗取得了较大进展,但由于早期肝癌的临床症状不明显,70%~80%的患者发现时已处于中晚期,总体预后不满意。目前对中晚期原发性肝癌及术后出现复发病灶的肝癌患者,最常用的手术方式为超选择性动脉插管栓塞化疗法,虽能减少副作用,但该手术会引起肝功能损伤。在我国大多数原发性肝癌(primary carcinoma of liver,PLC)合并肝硬化且病程较长,故确诊时已出现肝功能损伤,介入手术虽然可以延缓肿瘤进展,但同时可能造成肝脏被进一步破坏。因此合理评估患者肝脏损伤程度及储备功能,能为预测患者术后生存状况提供依据。
前白蛋白(prealbumin,PA)因电泳时位于白蛋白前方而得名,其含量与人体的生理、病理状态有很大关系,半衰期很短,来源于肝脏细胞特异性合成,外源性补充不能改变其含量,以上特点决定了PA可视做早期肝损伤的灵敏指标,较转氨酶更具特异性,较白蛋白更具敏感性。有数据表明,多数肝病患者血清PA水平下降到不足50%,肝衰竭时甚至难以测得,随病情好转其含量逐步升高,持续衰退的患者预后差,其数值能敏感及时地反映肝细胞的合成功能,诊断肝细胞损伤,观察疗效及判断患者预后[2],故用该指标评估肝脏储备及代偿功能。本研究旨在探讨血清前白蛋白总胆红素比值对预测肝癌患者TACE术后生存状况的应用价值。
1 材料与方法
1.1 临床资料收集2012年5月~2017年5月于我院消化科、普外科以及肿瘤科住院接受TACE术的患者资料,严格筛选后最终纳入133例患者,汇总分析研究。纳入标准:①临床或病理确诊为肝细胞癌(HCC)者;②临床及随访资料完整者。排除标准:①临床及随访资料缺失者;②合并多脏器功能衰竭或发生肝外转移者。根据术后前白蛋白总胆红素比值的高低且以最佳截断值为界值将患者分为前白蛋白总胆红素水平高组(高组,n=66)和前白蛋白总胆红素水平低组(低组,n=67)。再根据术前和术后3d 前白蛋白总胆红素水平高低将患者分为术前和术后3d比值均高组(A组)、术前或术后3d比值高组(B组)及术前和术后3d比值均低组(C组)。
1.2 随访患者术前签署医患沟通文件。每3~4个月入院或门诊随访1次,由检查结果决定继续随访或行相关对症治疗;如未在规定时间来院接受检查,则电话随访,随访频率为3~4个月/次,直至患者死亡。随访内容包括患者生存状态、近期一般情况、检查及治疗结果。随访时间截止到2019年5月1日,患者死亡或最后一次随访视为随访结束。末次随访仍存活的患者视为截尾数据,失访患者按照删失数据处理。
1.3 生存分析总生存期从治疗之日算起,患者失访、去世或随访至结束均视为截止,分别对各组患者6、12、24个月生存率及3组患者中位生存时间进行统计分析。
1.4 统计学方法采用Excel整理数据资料,并用SPSS 23.0 软件进行统计学分析。根据前白蛋白及总胆红素比值及术后生存时间绘制受试者的工作特征曲线(ROC曲线),确定预测患者2年生存的前白蛋白总胆红素比值的最佳截断值(敏感性和特异性之和最大)。单因素Cox 分析计算影响预后的要素,多因素Cox 分析获得独立预后要素。生存曲线评估患者生存状况。
2 结果
2.1 ROC曲线分析前白蛋白总胆红素比值术前中位值为6.85,术后3d 下降为3.92。术前预测患者2年生存最佳截断值为6.877[敏感性为71.2%,特异性为64.2%,曲线下面积为0.704,95%CI(0.616,0.793),P<0.001],见图1a。术后预测患者2年生存最佳截断值为3.955[敏感性为83%,特异性为72.5%,曲线下面积为0.853,95%CI(0.789,0.916),P<0.001],见图1b。通过对比,术后的前白蛋白总胆红素比值诊断预后敏感性和特异性更好。
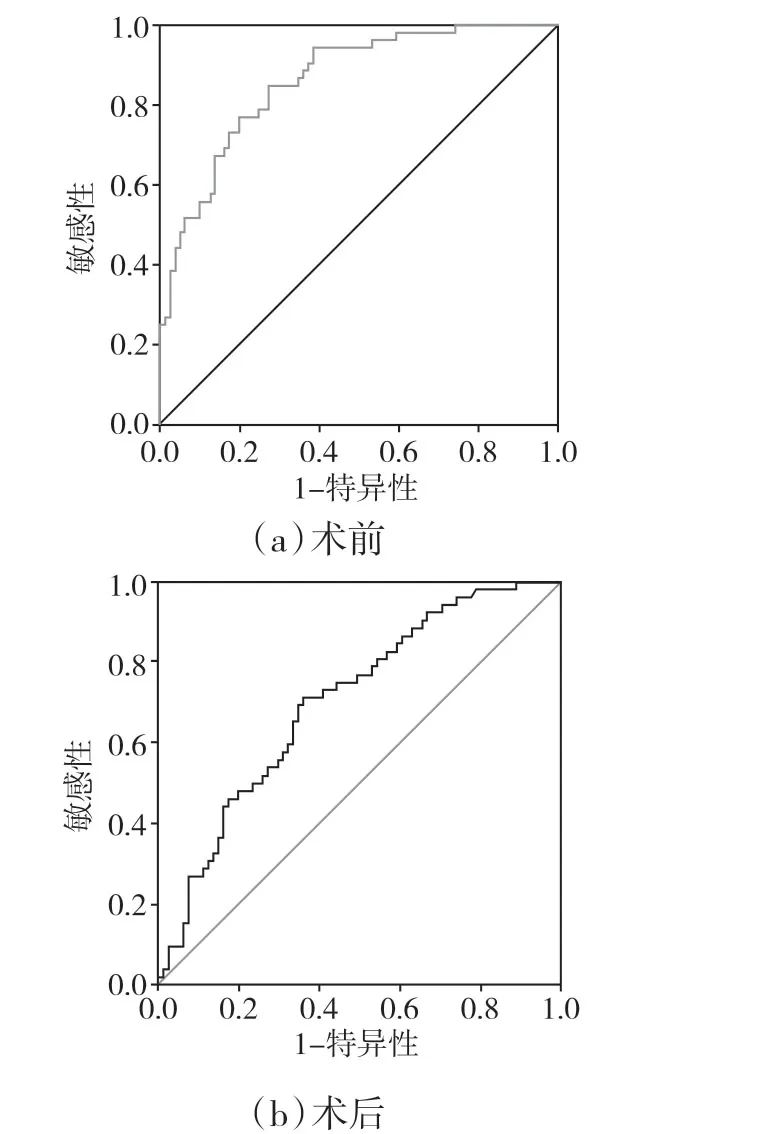
图1 前白蛋白总胆红素比值与生存时间的ROC曲线
2.2 前白蛋白总胆红素比值与临床病理特征的关系133例患者中男107例,女26例;乙型肝炎129例,丙型肝炎4例;影像学检查证实:门静脉主干或左右支癌栓者41例,淋巴结转移者31例,肝内转移者28例。统计结果显示,术后高组与低组在肿瘤大小、Child-Pugh 分级、直接胆红素、白蛋白方面差异有统计学意义(P<0.05),患者年龄、性别、癌栓、淋巴结转移、肝内转移、门静脉转移、肿瘤数目和甲胎蛋白(AFP)在两组间差异无统计学意义(P>0.05)。
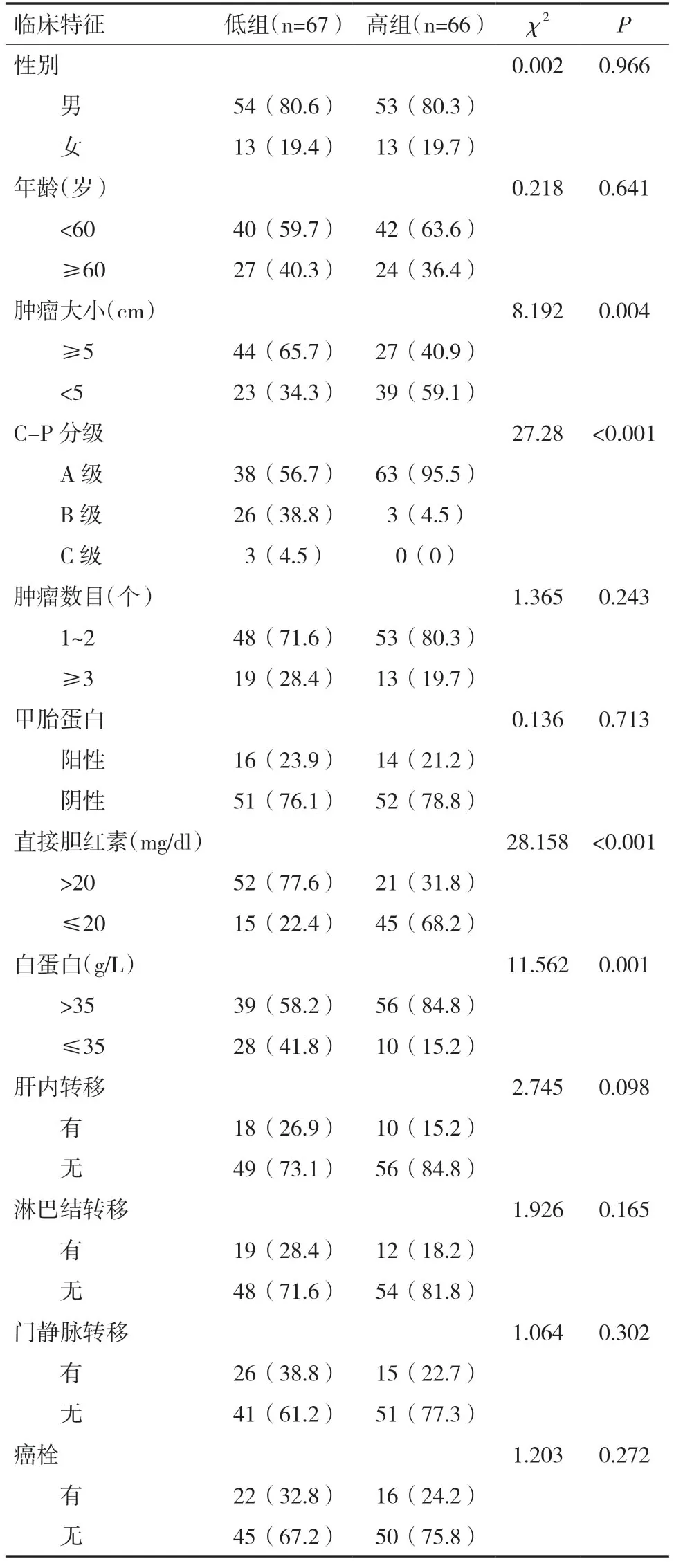
表1 两组HCC 患者临床资料情况[n(%)]
2.3 生存分析本次随访期间,81例死亡,术后最长生存时间为45个月;6、12、24个月总生存率依次为91.7%、72.2%和40.1%。术前低组生存时间中位数为6个月,6、12、24个月生存率依次为35.3%、29.4%和11.8%;高组患者生存时间中位数为22个月,6、12、24个月生存率依次为97.4%、78.4%和43.1%,两组比较差异具有统计学意义(χ2=24.966,P<0.001)(图2a)。术后低组患者生存时间中位数为13个月,6、12、24个月生存率依次为85.1%、50.7%和14.3%;高组患者生存时间中位数为26.5个月,6、12、24个月生存率依次为98.5%、95.5%和66.7%,两组比较差异具有统计学意义(χ2=53.969P<0.001)(图2b),综上K-M 生存曲线分析揭示前白蛋白总胆红素比值高的患者总体生存时间明显延长。
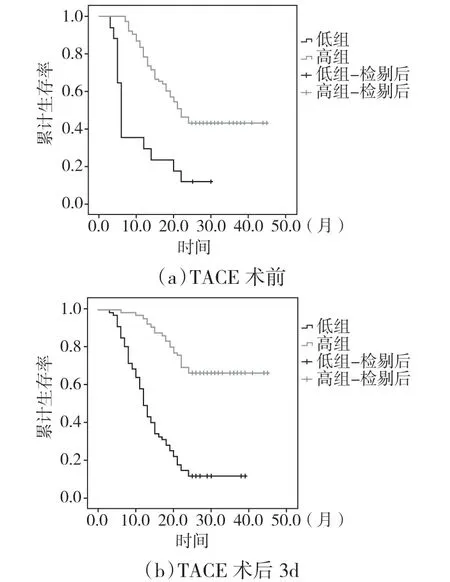
图2 两组TACE术前和术后的生存曲线分析
术前和术后3d比值均高组、术前或术后3d比值高组、术前和术后3d比值均低组的中位生存时间分别为27个月[95%CI(24.9,29.4)]、14个月[95%CI(11.5,16.4)]和6个月[95%CI(5.256,6.744)],3组差异有统计学意义(χ2=81.725,P<0.001),见图3。
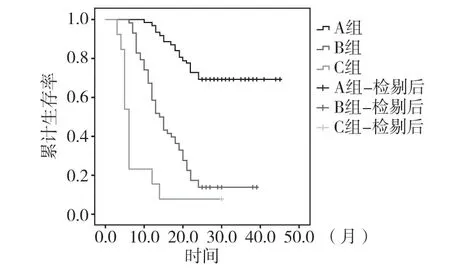
图3 各组患者术后生存曲线分析
2.4 总体生存时间单因素和多因素分析单因素分析显示:白蛋白、直接胆红素、肿瘤直径、肿瘤数目、Child-Pugh 分级及前白蛋白总胆红素比值可能是影响患者术后总体生存时间的预测指标。多因素分析显示:肿瘤直径、肿瘤数目、白蛋白及前白蛋白总胆红素比值是影响患者术后总体生存时间的独立危险因素,见表2。

表2 患者总体生存时间相关因素分析
3 讨论
肝癌起病隐匿、进展较快,我国多数肝癌患者确诊时已不符合根除指征,所以只能选择综合治疗[2]。近年来随着技术的不断创新,以介入、射频、微波为代表的微创治疗手段在进展期肝癌的治疗中愈加重要[3]。两项随机对照试验(RCT)研究[4,5]及随后的Meta 分析结果显示:较有限支持治疗方法,经肝动脉化疗栓塞术(TACE)在延长不可切除肝癌患者生存期上有较大优势[6]。美国肝病学会(AASLD)、欧洲肝病学会(EASL)都推荐TACE术为中晚期肝癌的首选治疗方法[7,8],尤其是超选择性动脉插管栓塞化疗法,因其创伤小、特异性高、禁忌证少[9],被认为是一线干预方案,但毕竟对正常肝组织有一定的损伤,有导致肝功能不全的可能,所以对患者肝脏储备功能有效评估非常必要,对介入术后患者生存预测意义重大,以往丙氨酸转移酶(ALT)常用来反映肝功能异常,但ALT 除分布于肝细胞外,还广泛分布于其他细胞,不能有效反映肝脏储备功能;临床上我们常用Child-Pugh 分级来评价肝脏储备功能,该分级是根据几十年前临床观察经验而得出各项参数的临界点,无正式的统计学依据,并且因为它包含腹腔积液、肝性脑病两项受主观性因素影响较大的指标,对评估介入术后肝脏储备代偿功能尚有失偏颇。传统的基于ALT和Child-Pugh 分级的指标或系统难以准确并同时反映肝脏的损伤程度及储备功能,Johnson 等[10]在2015年推出了一种新的评估方法:白蛋白-胆红素(albumin-bilirubin,ALBI)分级,经过全球多中心 5 097例HCC 患者验证后证实,在预测肝癌患者预后价值中ALBI 分级不劣于C-P 分级,并且可以作为肝功能评价指标单独应用于急慢性肝病、肝衰竭以及肝癌患者,但白蛋白容易受到除肝脏本身代谢功能之外的外源性因素影响,除肝脏分泌外,一些外源性因素,如高蛋白饮食、慢性病消耗均能显著影响白蛋白水平,比如在治疗实践中当患者合并营养不良时,外源性血浆制品(如人血白蛋白)被广泛运用,以及其他途径对外源性ALB 的补充,使其在评估肝脏储备功能上存在误差。
前体白蛋白替代白蛋白可减少此影响,研究报道肝细胞损伤后血清前白蛋白(PA)会发生特异性改变,且PA 对肝细胞损伤具有高度敏感性[11,12],既往常用来评估肝硬化失代偿期患者的营养状况,若应用在肝癌患者,TACE术前可以用来衡量肝脏的储备功能,术后可以用来观察肝细胞损伤程度。本研究分析显示前白蛋白总胆红素比值在TACE术后3d 明显下降,低组的生存时间短于高组,其中术后3d比值预测患者生存状态更为特异和敏感,术前和术后3d比值均高组、术前或术后3d比值高组、术前和术后3d比值均低组生存时间依次变短。本研究还发现肿瘤直径、肿瘤数目、白蛋白及前白蛋白总胆红素比值是影响患者术后总体生存时间的独立危险因素。
综上,前白蛋白总胆红素比值与肝癌患者TACE术后的生存时间紧密相连,是评价患者预后和制定治疗方案的一项重要指标。但由于单个中心小样本量研究的局限性,需要未来进一步大样本、多中心的研究证实。
