HPLC法同时测定珠芽景天药材中8种黄酮苷类成分的含量
2020-07-01吴莹莹雷艳姚成芬马雪黄勇李勇军林昌虎
吴莹莹 雷艳 姚成芬 马雪 黄勇 李勇军 林昌虎


中圖分类号 R917 文献标志码 A 文章编号 1001-0408(2020)12-1436-04
DOI 10.6039/j.issn.1001-0408.2020.12.06
摘 要 目的:建立同时测定珠芽景天药材中8种黄酮苷类成分含量的方法。方法:采用高效液相色谱法测定珠芽景天药材中山柰酚-3-O-β-D-吡喃葡萄糖-(1→2)-α-L-吡喃葡萄糖-7-O-α-L-吡喃鼠李糖苷(KGGR)、山柰酚-3-O-β-D-吡喃葡萄糖-7-O-α-L-吡喃鼠李糖苷(KGR)、槲皮素-3-O-α-L-鼠李糖-7-O-α-L-鼠李糖苷(QRR)、BulbiferumosideⅡ、山柰酚-3-O-(6-香豆酰基)-β-D-葡萄糖-(1→2)-β-D-葡萄糖-7-O-α-L-鼠李糖苷(KcGGR)、山柰酚-3-O-(2-β-D-葡萄糖)-α-L-鼠李糖-7-O-α-L-鼠李糖苷(KGRR)、山柰酚-3-O-α-L-鼠李糖苷-7-O-α-L-鼠李糖苷(KRR)、山柰酚-3-O-(6″-乙酰基-β-D-葡萄糖)-7-O-α-L-鼠李糖苷(KaGR)的含量。色谱柱为Waters CORTECS C18,流动相为乙腈-0.1%磷酸水溶液(梯度洗脱),流速为0.8 mL/min,检测波长为254 nm,柱温为35 ℃,进样量为5 μL。结果:上述8种成分均达到基线分离,检测进样量的线性范围分别为0.013~0.052、0.005~0.018、0.008~0.031、0.010~0.042、0.009~0.038、0.008~0.030、0.009~0.037、0.032~0.130 μg(r均不低于0.999 0);检测限分别为0.08、0.14、0.11、0.21、0.42、0.35、0.23、0.28 μg/mL,定量限分别为0.25、0.47、0.38、0.69、1.40、1.17、0.77、0.93 μg/mL;精密度、重复性、稳定性(24 h)试验的RSD均小于3%(n为6或7);平均加样回收率为99.67%~104.20%(RSD为0.17%~1.59%,n=6)。13批样品中,上述8种成分的平均含量分别为0.893 8、0.312 6、0.490 8、0.964 9、0.751 2、0.502 2、0.606 2、1.915 7 mg/g(n=3)。结论:该方法简便、准确、重复性好,可用于同时测定珠芽景天药材中8种黄酮苷类成分的含量。
关键词 珠芽景天;高效液相色谱法;黄酮苷类成分;含量测定
Simultaneous Determination of 8 Flavonoid Glycosides in Sedum bulbiferum by HPLC
WU Yingying1,2,LEI Yan1,2,YAO Chengfen1,2,MA Xue1,HUANG Yong3,LI Yongjun1,LIN Changhu1(1. Engineering Research Center for the Development and Application of Ethnic Medicine and TCM/State Key Laboratory of Functions and Applications of Medicinal Plants, Guizhou Medical University, Guiyang 550004, China; 2. School of Pharmacy, Guizhou Medical University, Guiyang 550004, China; 3. Guizhou Provincial Key Laboratory of Pharmaceutics, Guizhou Medical University, Guiyang 550004, China)
ABSTRACT OBJECTIVE: To establish a method for simultaneous determination of 8 flavonoid glycosides in Sedum bulbiferum. METHODS: HPLC method was adopted to determine the contents of kaempferol-3-O-β-D-glucopyranoside-(1→2)-α-L-glucopy- ranoside-7-O-α-L-glucopyranoside (KGGR), kaempferol-3-O-β-D-glucopyranosyl-7-O-α-L-rhamnopyranoside (KGR), quercetin-3- O-α-L-rhamnose-7-O-α-L-rhamnoside (QRR), BulbiferumosideⅡ, kaempferol-3-O-(6-coumarinyl)-β-D-glucose-(1→2)-β-D-glu- cose-7-O-α-L-rhamnoside (KcGGR), kaempferol-3-O-(2-β-D-glucose)-α-L-rhamnose-7-O-α-L-rhamnoside (KGRR), kaempferol-3- O-α-L-rhamnoside-7-O-α-L-rhamnoside (KRR), kaempferol-3-O-(6″-acetyl-β-D-glucose)-7-O-α-L-rhamnoside (KaGR) in S. bulbi- ferum. The determination was performed on Waters CORTECS C18 column with mobile consisted of acetonitrile -0.1% phosphoric acid water solution (gradient elution) at the flow rate of 0.8 mL/min. The detection wavelength was set at 254 nm, and column temperature was 35 ℃. The sample size was 5 μL. RESULTS: The linear range of 8 constituents were 0.013-0.052, 0.005-0.018, 0.008-0.031, 0.010-0.042, 0.009-0.038, 0.008-0.030, 0.009-0.037, 0.032-0.130 μg, respectively (all r were not less than 0.999 0). The limits of detection were 0.08, 0.14, 0.11, 0.21, 0.42, 0.35, 0.23, 0.28 μg/mL,respectively. The limits of quantification were 0.25, 0.47, 0.38, 0.69, 1.40, 1.17, 0.77, 0.93 μg/mL, respectively. RSDs of precision, reproducibility and stability tests (24 h) were all lower than 3% (n=6 or n=7). The average recoveries were 99.67%-104.20% (RSDs=0.17%-1.59%, n=6). Average contents of above 8 constituents in 13 batches of samples were 0.893 8, 0.312 6, 0.490 8, 0.964 9, 0.751 2, 0.502 2, 0.606 2, 1.915 7 mg/g(n=3). CONCLUSIONS: The method is simple, acourate and reproducible, and can be used for simultaneous determination of 8 flavonoid glycosides in S. bulbiferum.
KEYWORDS Sedum bulbiferum; HPLC; Flavonoid glyco- sides; Content determination
珠芽景天为景天科植物珠芽景天(Sedum bulbiferum Makino.)的干燥全草,又名小箭草、珠芽半支,广泛分布于我国南部地区,野生资源丰富,是我国民间常用的植物药,可用于治疗寒热疟疾、食积腹痛、热毒痈肿等症[1-3]。化学成分研究显示,珠芽景天主要含有生物碱类、多糖类、三萜类、黄酮类、矿质元素等化学成分[4-9]。本课题组前期研究中发现,黄酮类化合物为珠芽景天的主要成分,并分离得到以山柰酚、槲皮素为母核的苷类化合物,包括山柰酚-3-O-β-D-吡喃葡萄糖-(1→2)-α-L-吡喃葡萄糖-7-O-α-L-吡喃鼠李糖苷(KGGR)、山柰酚-3-O-β-D-吡喃葡萄糖-7-O-α-L-吡喃鼠李糖苷(KGR)、槲皮素-3-O-α-L-鼠李糖-7-O-α-L-鼠李糖苷(QRR)、BulbiferumosideⅡ、山柰酚-3-O-(6-香豆酰基)-β-D-葡萄糖-(1→2)-β-D-葡萄糖-7-O-α-L-鼠李糖苷(KcGGR)、山柰酚-3-O-(2-β-D-葡萄糖)-α-L-鼠李糖-7-O-α-L-鼠李糖苷(KGRR)、山柰酚-3-O-α-L-鼠李糖苷-7-O-α-L-鼠李糖苷(KRR)、山柰酚-3-O-(6″-乙酰基-β-D-葡萄糖)-7-O-α-L-鼠李糖苷(KaGR)等。已有药理活性研究表明,珠芽景天的黄酮类成分对人肝癌细胞株HepG2、人食管癌细胞株EC109、人结肠癌细胞株SW480的体外增殖有抑制作用[10-11]。
中药成分复杂多样且质量不易控制,这在一定程度上制约了中药的研究与开发。目前,有关珠芽景天质量控制的研究报道较少,仅见黄酮苷元槲皮素和山柰素的定量研究[10-11],然而仅通过单一化学成分的含量测定难以全面评估珠芽景天的质量。近年来,多指标含量测定已广泛应用于中药材的质量控制,如白花蛇舌草、大黄、三叶青等[12-14]。因此,本研究拟建立同时测定珠芽景天药材中上述8种主要黄酮苷类成分含量的高效液相色谱法(HPLC),旨在为该药材的质量控制研究提供参考。
1 材料
1.1 仪器
UltiMate 3000型HPLC仪,包括系统控制器、输液泵、脱气组件、低压梯度组件、自动进样器、柱温箱、温控样品室、二极管阵列检测器、Chromeleon 7.0色谱数据工作站(美国Thermo Fisher Scientific公司);Allegra 64R型低温高速离心机(美国Beckman Coulter公司);WP-UP-Ⅳ-20型超纯水机(四川沃特尔科技发展有限公司);EL204型电子天平[梅特勒-托利多仪器(上海)有限公司]。
1.2 药品与试剂
珠芽景天药材采自贵州省各地,经贵州中医药大学药学院孙庆文教授鉴定为景天科景天属植物珠芽景天(S. bulbiferum Makino.)的干燥全草,13批药材样品来源见表1。KGGR、KGR、QRR、BulbiferumosideⅡ、KcGGR、KGRR、KRR、KaGR对照品均为本实验室自制,经HPLC面积归一法检测纯度均大于98.0%;乙腈、甲醇均为色谱纯,其余试剂均为分析纯,水为超纯水。
2 方法与结果
2.1 色谱条件
色谱柱:Waters CORTECS C18(150 mm×4.6 mm,2.7 μm);流动相:乙腈(A)- 0.1%磷酸水溶液(B);梯度洗脱(0~5 min,5%A→12%A;5~15 min,12%A→13%A;15~30 min,13%A;30~45 min,13%A→14%A;45~60 min,14%A→15%A);流速:0.8 mL/min;柱温:35 ℃;检测波长:254 nm;进样量:5 μL。
2.2 溶液的制备
2.2.1 混合对照品溶液的制备 取KGGR、KGR、QRR、Bulbiferumoside Ⅱ、KcGGR、KGRR、KRR和KaGR对照品适量,精密称定,分别用甲醇溶解并定容至10 mL量瓶中,得单一对照品贮备液。精密吸取上述单一对照品贮备液各适量,置于同一10 mL量瓶中,用甲醇溶解并稀释至刻度,制成每1 mL含KGGR 13.0 μg、KGR 4.6 μg、QRR 7.7 μg、Bulbiferumoside Ⅱ 10.4 μg、KcGGR 9.4 μg、KGRR 7.5 μg、KRR 9.3 μg、KaGR 32.4 μg的混合对照品溶液,保存于4 ℃冰箱中,备用。
2.2.2 供试品溶液的制备 取珠芽景天药材适量,粉碎后,过40目筛。精密称取上述粉末1 g,加入50%乙醇20 mL,称定质量后,水浴加热回流1 h,冷却至室温,再次称定质量,用50%乙醇补足减失质量,摇匀,以12 000 r/min离心10 min,取上清液,即得供试品溶液。
2.3 方法学考察
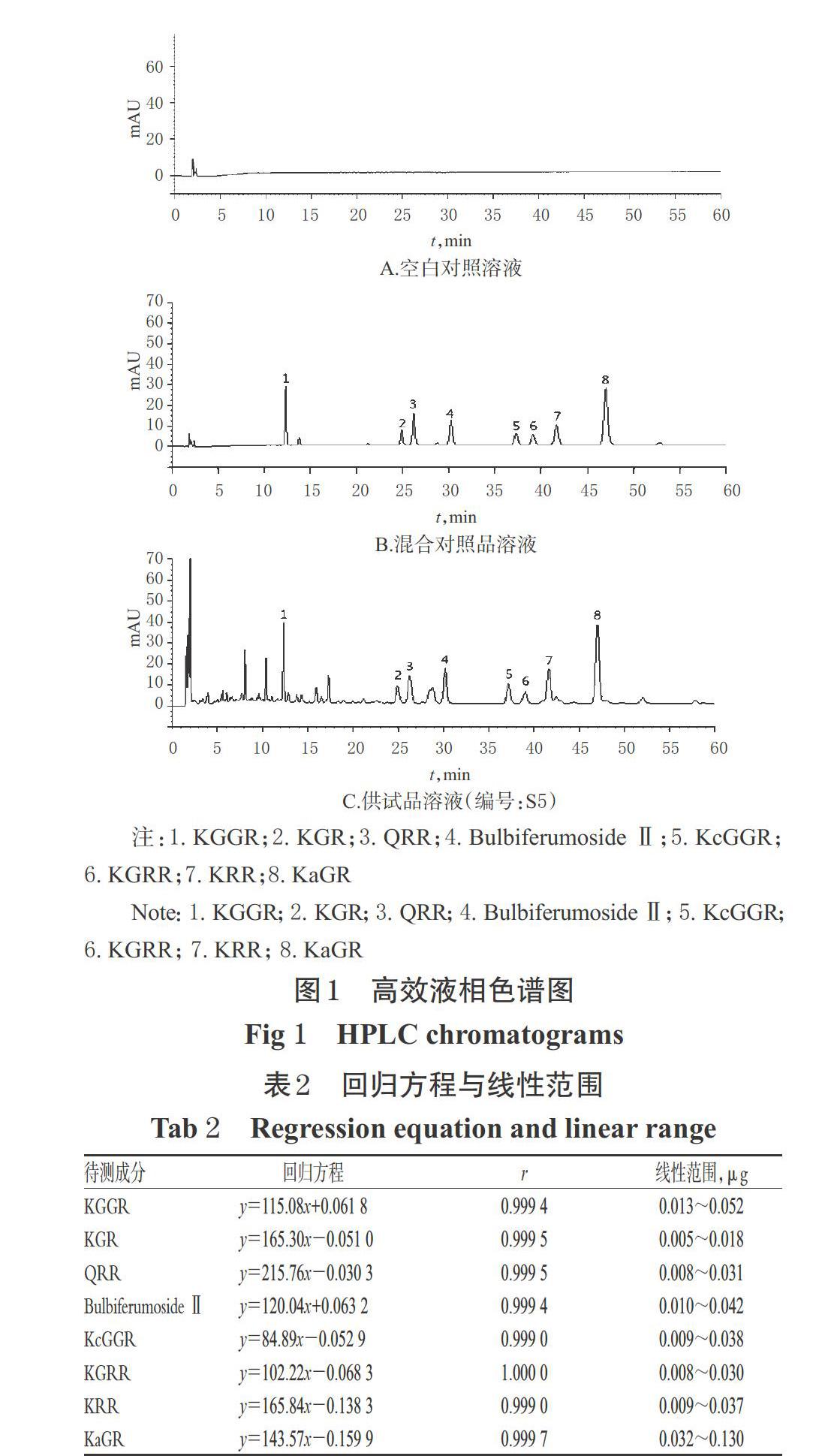
2.3.1 专属性考察 精密吸取空白对照溶液(甲醇溶液)和“2.2”项下供试品溶液(编号:S5)、混合对照品溶液适量,空白对照溶液和供试品溶液按“2.1”项下色谱条件进样测定,混合对照溶液用甲醇稀释5倍后进样测定,记录色谱图,详见图1。结果,在该色谱条件下,KGGR、KGR、QRR、Bulbiferumoside Ⅱ、KcGGR、KGRR、KRR和KaGR的分離度均良好,且色谱峰峰形对称,理论板数按QRR峰计均不低于17 000。
2.3.2 标准曲线绘制 精密吸取“2.2.1”项下混合对照品溶液1.0 mL,置于5 mL量瓶中,加甲醇溶解稀释至刻度,制成KGGR、KGR、QRR、Bulbiferumoside Ⅱ、KcGGR、KGRR、KRR和KaGR质量浓度分别为2.60、0.92、1.54、2.08、1.88、1.50、1.86、6.48 μg/mL的混合溶液,分别精密吸取5、8、10、12、15、18、20 μL,按“2.1”项下色谱条件进样测定,记录峰面积。以待测成分进样量(x,μg)为横坐标、峰面积(y)为纵坐标进行线性回归,结果见表2。
2.3.3 检测限与定量限考察 取“2.2.1”项下混合对照品溶液适量,以甲醇倍比稀释,按“2.1”项下色谱条件进样测定,以信噪比10 ∶ 1、3 ∶ 1分别确定其定量限、检测限。结果,KGGR、KGR、QRR、Bulbiferumoside Ⅱ、KcGGR、KGRR、KRR和KaGR的检测限分别为0.08、0.14、0.11、0.21、0.42、0.35、0.23、0.28 μg/mL,定量限分别为0.25、0.47、0.38、0.69、1.40、1.17、0.77、0.93 μg/mL。
2.3.4 精密度试验 取同一批珠芽景天(编号:S5)供试品溶液,按“2.1”项下色谱条件连续进样测定6次,记录峰面积。结果,KGGR、KGR、QRR、Bulbiferumoside Ⅱ、KcGGR、KGRR、KRR和KaGR峰面积的RSD分别为0.48%、0.96%、0.86%、0.86%、0.39%、0.77%、0.82%、0.83%(n=6),表明方法精密度良好。
2.3.5 重复性试验 取同一批珠芽景天药材(编号:S5)粉末,按“2.2.2”项下方法平行制备供试品溶液6份,再按“2.1”项下色谱条件进样测定,记录峰面积,按标准曲线法计算各待测成分的含量。结果,KGGR、KGR、QRR、Bulbiferumoside Ⅱ、KcGGR、KGRR、KRR和KaGR含量的RSD分别为1.00%、0.47%、2.15%、1.66%、2.53%、2.72%、2.71%、1.17%(n=6),表明方法重复性良好。
2.3.6 稳定性试验 取同一批珠芽景天药材(编号:S5)粉末,按“2.2.2”項下方法制备供试品溶液,分别于室温下放置0、1、2、4、8、12、24 h时按“2.1”项下色谱条件进样测定,记录峰面积。结果,KGGR、KGR、QRR、Bulbiferumoside Ⅱ、KcGGR、KGRR、KRR和KaGR峰面积的RSD分别为1.39%、1.29%、1.99%、1.90%、1.80%、1.97%、1.10%、0.84%(n=7),表明供试品溶液在室温下放置24 h内稳定性良好。
2.3.7 加样回收率试验 取已知含量的珠芽景天药材(编号:S5)粉末,共6份,每份约0.5 g,精密称定,分别按各成分在药材中的含量等量加入相应单一对照品贮备液,按“2.2.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样测定,记录峰面积并计算加样回收率,结果见表3。
2.4 样品含量测定
称取13批珠芽景天药材粉末各1 g,精密称定,按“2.2.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样测定,记录峰面积,按标准曲线法计算8种黄酮苷类成分的含量。每批平行操作3次,结果见表4。
由表4结果可见,所测13批珠芽景天药材中8种黄酮苷类成分含量差异不大,其中平均含量最高的是KaGR(1.915 7 mg/g),平均含量最低的是KGR(0.312 6 mg/g)。
3 讨论
3.1 供试品溶液制备方法选择
本课题组前期分别考察了提取方法(超声、回流)、提取溶剂[水、不同体积分数(100%、75%、50%、25%)的甲醇和乙醇]、提取时间(0.5、1、2、4 h)对珠芽景天提取率的影响。结果发现,以50%乙醇回流1 h的提取率较高,且提取时间适宜,故最终选择此方法作为供试品溶液的制备方法。
3.2 色谱条件选择
本课题组前期分别对色谱柱(ACE Excel 5 C18-AR、ACE Excel 5 C18、Waters CORTECS C18)、流动相(乙腈-0.1%磷酸水溶液、乙腈-0.1%甲酸水溶液、甲醇-0.1%磷酸水溶液、甲醇-0.1%甲酸水溶液)、流速(0.8、1.0、1.2 mL/min)进行了考察。结果发现,当色谱柱为Waters CORTECS C18、流动相为乙腈-0.1%磷酸水溶液(梯度洗脱)时,珠芽景天中8种黄酮苷类成分的色谱峰峰形、分离度均较好,且基线平稳,故最终选用此色谱条件。本课题组在全波长扫描时发现,珠芽景天中这8种黄酮苷类成分均在254 nm波长处有较理想的色谱响应,且与其他杂质峰分离度也较好,故选择254 nm波长作为检测波长。
综上所述,本研究所建方法操作简便,准确度、精密度高,重复性、稳定性好,可用于同时测定珠芽景天药材中8种黄酮苷类成分的含量,可为其质量控制及进一步开发利用提供方法支持。
参考文献
[ 1 ] 《贵州植物志》编辑委员会.贵州植物志:第2卷[M].贵阳:贵州人民出版社,1986:198.
[ 2 ] 《全国中草药汇编》编写组.全国中草药汇编:下册[M].北京:人民卫生出版社,2000:481.
[ 3 ] 万定荣.垂盆草及其同属(景天属)药用种的民族医疗应用[J].时珍国医国药,2007,18(8):1853-1855.
[ 4 ] KIM JH,THART H,STEVENS JF. Alkaloids of some Asian Sedum species[J]. Phytochemistry,1996,41(5):1319-1324.
[ 5 ] 《湖南植物志》编辑委员会.湖南药物志:第5卷[M].长沙:湖南科学技术出版社,2004:3392-3393.
[ 6 ] 江苏新医学院.中药大辞典:上册[M].上海:上海科学技术出版社,1986:260.
[ 7 ] WARASHINA T,MIYASE T. Flavonoid glycosides from Sedum bulbiferum[J]. Chem Pharm Bull:Tokyo,2017,65(12):1199-1204.
[ 8 ] 姚成芬,汪洋,蒋礼,等.珠芽景天的化学成分研究[J].中药材,2018,41(6):1369-1371.
[ 9 ] 杨耿,巩吉力,郑艳,等.珠芽景天的矿质元素分析[J].基层中药杂志,2000,14(3):8-9.
[10] 胡婧.珠芽景天的鉴定、黄酮类成分含量测定及抗肿瘤活性研究[D].武汉:中南民族大学,2012.
[11] 胡婧,王璐瑶,万定荣,等.珠芽景天抗肿瘤活性研究及槲皮素和山柰素的含量测定[J].中国实验方剂学杂志,2013,19(24):139-142.
[12] 段和祥,刘绪平,陈希,等. HPLC法同时测定白花蛇舌草中6种有机酸类成分的含量[J].中药材,2019,42(8):1842-1845.
[13] 陆文瑾,窦志华,曹瑞,等. HPLC法同时测定大黄药材中8个非蒽醌类成分的含量[J].中国药房,2019,30(14):1975-1980.
[14] 李彩凤,胡欣,金鹏飞,等. HPLC法同时测定三叶青块根中6个黄酮类成分的含量[J].中国药房,2019,30(13):1755-1758.
(收稿日期:2020-01-17 修回日期:2020-04-06)
(编辑:邹丽娟)
