VV-ECMO 救治重度ARDS患者并发右心功能不全的管理
2020-07-01刘学松张容席寅陈思蓓刘晓青黎毅敏
刘学松 张容 席寅 陈思蓓 刘晓青 黎毅敏
广州医科大学附属第一医院重症医学科 广州呼吸健康研究院510120
ARDS常并发肺动脉高压,导致右心功能不全[1]。低心输出量和/或静脉系统瘀血程度决定不同的临床表现。右心功能不全是影响ARDS 患者预后的重要因素[2]。
1 病例资料
2018年广州医科大学附属第一医院ICU 收治1例重度ARDS患者,具体病情如下。患者女,37岁,因“发热、咳嗽、咳痰伴气促19 d”入院。患者19 d前接触感冒患者后开始出现全身肌肉酸痛,伴有流少量鼻涕,随后开始发热伴咳嗽、咳铁锈色痰伴气促,发热时体温最高达39.0 ℃,口服感冒药后无缓解;9 d后出现呼吸急促、痰量增多、心率增快等,病情加重遂就诊于佛山市三水人民医院急诊科。血常规:白细胞计数1.57×109/L,中性粒细胞百分比84.7%。胸部CT 示:双肺透亮度低,双肺见大片状、斑片状实变影、磨玻璃影及淡薄影,以左肺为著,实变影内可见支气管充气征,双侧无胸腔积液。诊断为重症肺炎。静脉给予亚胺培南西司他汀+莫西沙星+卡泊芬净抗感染及口服奥司他韦抗病毒治疗。后因患者呼吸衰竭加重、痰量增多,脉搏血氧饱和度下降至60%,给予经口气管插管接有创呼吸机辅助通气及肺复张、俯卧位通气等治疗。气道内可吸出大量铁锈色样痰,血培养为肺炎链球菌,痰培养为鲍曼不动杆菌。抗感染治疗更改为替加环素+美罗培南+卡泊芬净静脉滴注,奥司他韦口服。在住院第10天时,患者再次出现高热,体温最高39.5 ℃,伴呼吸窘迫,复查胸部CT 提示双肺多发病灶,病灶范围较前增大并新发空洞形成,心包及双侧胸腔少量积液。考虑患者病情进展,转入广州医科大学附属第一医院ICU。既往史:1 年半前体检发现甲状腺功能亢进,口服他巴唑治疗。2017年12月中旬出现左侧面瘫,注射鼠神经生长因子后面瘫好转。患者呈镇静肌松状态, 持续静脉泵入咪达唑仑0.1 mg·kg-1·h-1,丙泊酚4 mg·kg-1·h-1,瑞芬太尼0.05 μg· kg-1· min-1, 罗库溴铵8μg·kg-1·min-1,躁动镇静评分为-5分。经鼻气管插管接呼吸机辅助通气,辅助/控制模式:潮气量320 ml,呼气末正压12 cm H2O (1 cm H2O=0.098 k Pa),呼吸频率18 次/min,吸入氧浓度100%。监测呼吸频率35 次/min,脉搏血氧饱和度为88%。听诊双肺呼吸音粗,双肺底可闻及大量吸气相湿啰音,心率为133 次/min,血压为100/73 mm Hg (1 mm Hg=0.133 k Pa) (去甲肾上腺素0.4μg·kg-1·min-1)。动脉血气分析:p H值为7.208,PaCO2为56.7 mm Hg,PaO2为64.0 mm Hg,碳酸氢根浓度为27.9 mmol/L。氧合指数为64 mm Hg。诊断: (1)重症肺炎 (病毒、细菌、真菌混合型感染); (2)重度ARDS;(3)感染性休克;(4)甲状腺功能亢进症。患者严重低氧血症经积极治疗无改善,给予行右股静脉和右颈内静脉体外膜肺氧合 (veno-venous extracorporeal membrane oxygenation,VV-ECMO)治疗,血流量为4.0 L/min (气流量为4 L/min,转速为3 025 r/min,吸入氧浓度为100%),肝素抗凝,监测活化部分凝血活酶时间及激活全血凝固时间。镇静镇痛药物缓慢下调,呼吸机辅助通气,辅助/控制模式(潮气量为320 ml,呼气末正压为6 cm H2O,呼吸频率为14次/min,吸入氧浓度为60%)。监测显示潮气量为200 ml,呼吸频率为22次/min,气道峰压为26 cm H2O。血气分析:p H 值为7.474,PaCO2为38.5 mm Hg,PaO2为68.0 mm Hg,碳酸氢根浓度为27.9 mmol/L。每日吸出的气道分泌物约300 ml。 心率为120 次/min,血压为105/63 mm Hg (去甲肾上腺素0.3μg·kg-1·min-1)。患者入ICU 第2天心脏彩超提示左、右心腔大小在正常范围,有三尖瓣反流,估测肺动脉压为56 mm Hg,考虑存在肺动脉压升高,右功能不全。
患者存在右心功能不全后,进行液体管理,减少液体入量。入ICU 后第7天,患者心脏超声提示右心室增大,左心室舒张末期缩小,考虑存在右心功能衰竭 (图1),给予连续性肾脏替代治疗(continuous renal replacement therapy,CRRT)加强液体管理,适当液体负平衡,并加用前列地尔降肺动脉压治疗。入ICU 第12天患者出现气胸,行胸腔闭式负压引流改善胸腔内压。在治疗过程中积极抗感染,同时患者的肺部结构因化脓性改变破坏明显(图2、3A~D),给予积极的气道分泌物引流(每日主动行3~4次纤维支气管镜气道分泌物引流),同时继续肺保护通气。经上述处理后患者的肺动脉压改善明星,右心功能较前恢复 (表1),肺部炎症也较前改善(图3E、F),于入ICU 后第23天成功撤离ECMO 和CRRT。住院83 d后出院在家康复,1年后复查胸部CT 示肺部结构明显改善(图3G、H),1年半后恢复正常生活并能参加工作。考虑此患者发生右心功能不全的因素主要有ARDS、感染性休克、液体容量过多、肺部结构破环后肺血管床面积减少、机械通气、低氧、高碳酸血症、炎症因子、微血栓形成等。给予处理的措施包括控制输入液体的总量和速度、CRRT 减轻液体负荷、加强气道的引流和气胸引流、药物降肺动脉压、右心保护的肺通气策略、VV-ECMO 等处理。
2 讨论
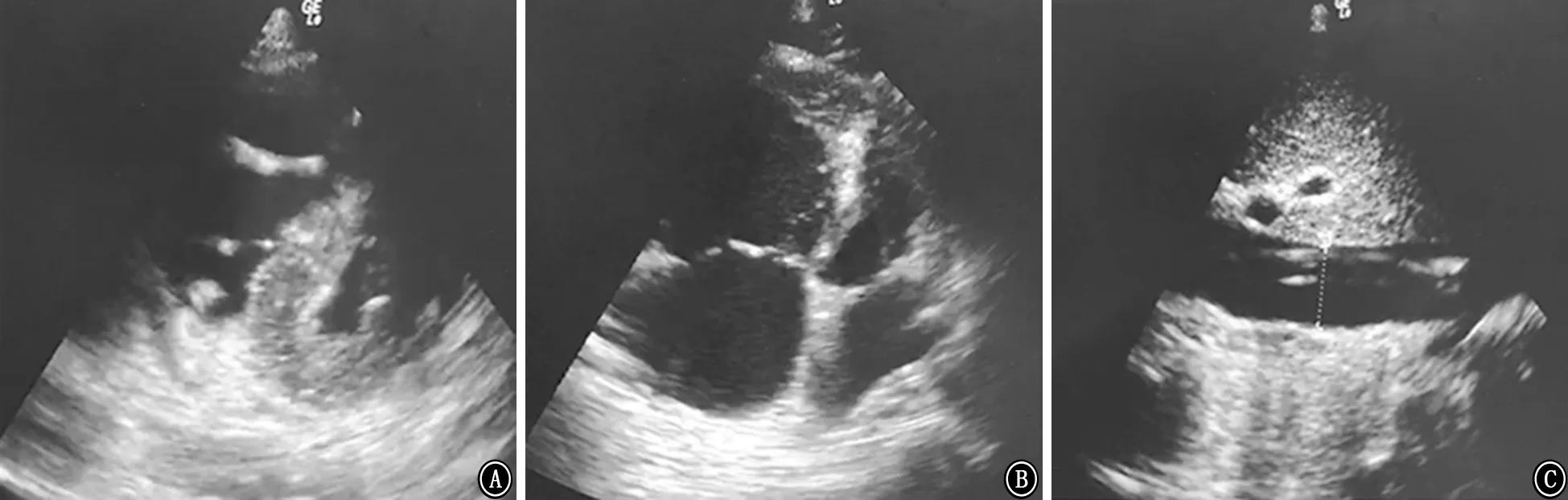
图1 心脏超声 A:胸骨旁短轴切面可见右心室增大,右心室壁增厚,左心室缩小,室间隔与左心室壁同向运动;B:心尖四腔切面可见右心房、右心室明显增大,右心室壁增厚,左心小,右心室舒张末面积/左心室舒张末面积>1;C:下腔静脉宽度为2.5 cm,无呼吸变异度
肺动脉高压是影响患者预后的重要因素。低氧血症、高碳酸血症、内环境紊乱、高气道压、炎性因子、肺容积塌陷等多种因素引起肺血管收缩、肺血管阻力增加,导致急性肺动脉压升高[3]。同时,外科手术肺叶切除,肺结构破环,肺血管床面积减少,也可能会引起肺循环阻力的增加[4-5]。在重症患者中,不适当的机械通气、低氧、严重感染、肺栓塞等多种因素均会导致肺血管阻力升高,心输出量下降,并出现严重的血流动力学紊乱和器官功能障碍[6]。这些由重症相关因素所致的肺动脉高压称为重症相关肺动脉高压。
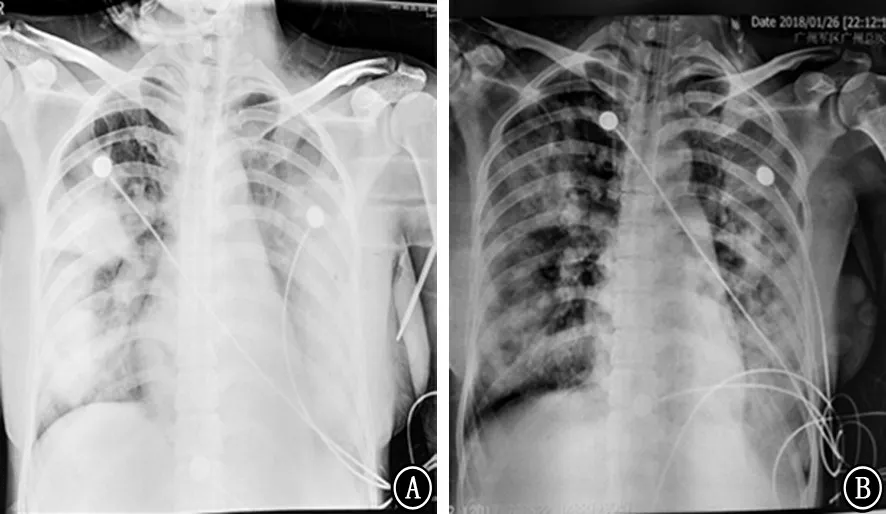
图2 胸部X 线表现 A:发病后10 d;B:发病后15 d
由于右心特殊的解剖和生理功能[7],右心室的游离壁由横行肌纤维构成,明显薄于左心室,使得右心室对压力和容量在其不同状态下的反应不一样。如果因液体负荷增加使右心增大,右心室舒张末期压力迅速增高,少量的液体改变会导致压力明显改变。当右心室舒张末面积 (right ventricle end diastolic areas,RVEDA)/左心室舒张末面积(left ventricle end diastolic areas,LVEDA)>0.6时,会出现右心室扩张,由于左右心室是相互依赖和交互影响的,一侧心室容积、压力的改变或一侧心肌硬度和收缩力的改变均会影响另一侧心室,增大的右心会使室间隔左移,通过室间隔和心包压迫左心,致左心室舒张受限,左心舒张末容积缩小,左心舒张末压力增高,导致心输出量下降。ARDS、感染性休克患者常合并右心受累,无论是舒张功能还是收缩功能受累,右心的前负荷储备功能均明显下降[8]。在右心处于高张力阶段期,容量的调整和评估对右心功能的影响更加明显,少量的液体改变可能导致心输出量的明显变化,使血流动力学出现较大的波动[9]。本病例在早期已加强液体管理,控制液体输入的总量和速度,从表1中可见患者的中心静脉压不高,液体的优化是右心功能不全管理的关键措施之一。ARDS患者在评估右心功能时可以利用脉搏压力变化或每搏量变异来对是否存在右心功能不全进行初步筛查,中心静脉压、脉搏压力变化联合重症超声的右心评估是ARDS患者血流动力学波动的初始评估手段[10]。ARDS 出现右心功能受累或急性肺动脉高压,建议在超声评估基础上,首选肺动脉漂浮导管进行连续监测[11-12]。本例患者左侧颈内静脉有深静脉置管,右侧为ECMO 回血管,脉搏压力变化和每搏量变异均不能反映心功能的情况,而肺动脉漂浮导管的置管难度和风险较高,临床实施存在一些困难,因此重症超声是评估血流动力学的有效手段。右心房压力、右心室厚度、三尖瓣口舒张期血流频谱、三尖瓣环组织多普勒频谱、三尖瓣环收缩期速度、肝静脉的脉冲多普勒频谱、下腔静脉内径包括右心室大小等可评估右心舒张功能[13-15]。
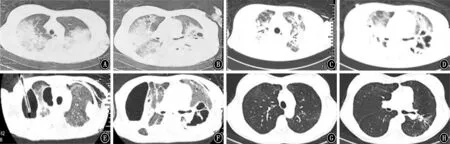
图3 胸部CT 的变化 A、B:发病后第17天的胸部CT;C、D:发病后第28天的胸部CT;E、F:发病后第43天的胸部CT;G、H:发病后1年的胸部CT
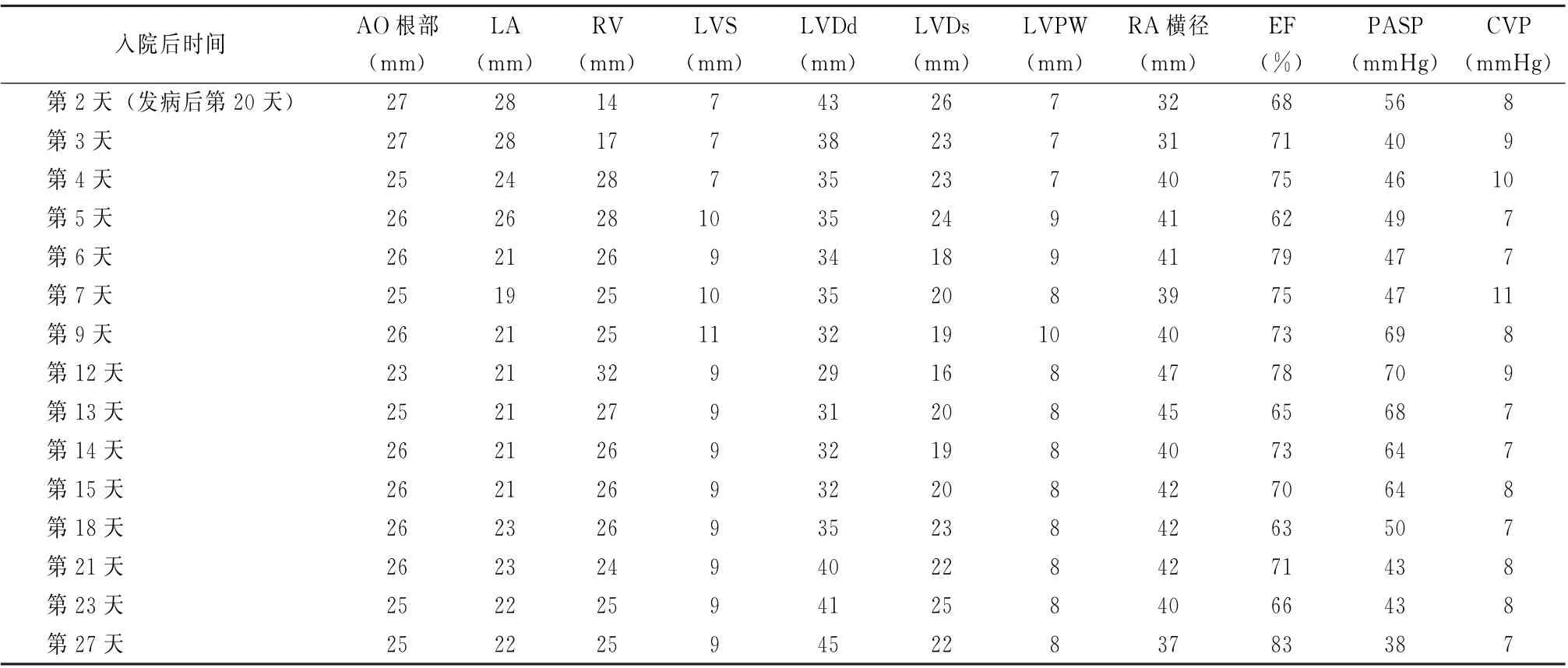
表1 心脏超声结果的变化
通过降低右心室容积、心包腔压力,使得左心舒张末期容积增加,从而增加每搏输出量[16]。因此当临床尝试进行反向液体复苏时,需要判断右心处于何种阶段,只有右心明显增大,处于高张力阶段并通过室间隔影响左心舒张时,可通过液体负平衡改变右心高张力阶段而增加心输出量。无心脏慢性基础疾病或右心后负荷增加时,RVEDA/LVEDA>0.6可引起左心明显舒张受限[17],RVEDA/LVEDA>1表明存在严重的肺动脉高压和右心功能衰竭[18]。从表1中可见本病例在入住ICU 的第4 天心脏超声提示右心室增大,左心室舒张末期逐步缩小趋势,RVEDA/LVEDA>0.6考虑存在右心功能不全,处于高张力阶段,给予CRRT 反向液体复苏,精确调控液体,减轻右心负荷。
右心室收缩力下降与肺血管阻力升高密切相关,同时由于右心室舒张末压增高导致右心的心肌灌注减少,将进一步降低右心的舒张功能[19]。本病例在早期就加用前列地尔降肺动脉压治疗,扩张血管活性药物是降低肺循环压力的疗法之一。由于相关受体分布存在差异,应用血管活性药物时应注意其对肺循环和体循环的不同影响。一般扩张血管药物在作用肺循环时也可能影响到体循环,一方面扩张肺动脉,降低肺循环阻力,有利于右心功能恢复;另一方面扩张血管药物也同时降低体循环压。在应用扩血管药物时肺动脉压下降不明显而体循环压下降明显时,会导致跨室间隔压力的改变,出现室间隔左移,左心舒张末容积减少,心输出量下降,导致体循环压力进一步下降[20]。
增加跨肺压导致右心功能异常是机械通气不良反应之一[21]。机械通气影响肺循环阻力,在正压通气时,肺泡的过渡牵张会使肺血管受压,引起肺动脉阻力增加,肺循环血流减少;随着呼气末正压的升高,肺血管阻力也呈升高趋势。不合理的机械通气会导致急性肺动脉压升高,右心后负荷过高[3,22]。本病例在早期就采用右心保护的肺通气策略,包括潮气量<6 ml/kg;限制平台压<27 cm H2O,驱动压<17 cm H2O,PaCO2<60 mm Hg;适当的呼气末正压;在中重度ARDS患者中采用肺复张、俯卧位通气、ECMO 等。将其对右心的影响降到最低限度[10,23-25]。
20%~25%的ARDS 患者出现急性肺源性心脏病[26]。微血栓、动脉重构及低氧所致的血管痉挛和微血管堵塞、酸中毒及炎性因子等多种因素导致肺血管阻力增加,从而导致肺动脉压升高;允许性高碳酸血症的通气策略导致的高碳酸血症也导致肺动脉压升高[27],同时机械通气治疗通过增加跨肺压,增加右心后负荷,均会导致急性肺源性心脏病,出现右心功能障碍[28]。由于左右心共用室间隔及在同一心包腔内,右心室体积和压力的过大使得左心室舒张受限,从而影响左心室的输出量,导致循环进一步恶化,这一现象在中重度ARDS 中较为常见[1]。感染性休克与ARDS 均因合并右心受累而导致病死率明显增加[1,29]。因此,在ARDS的治疗策略中,右心保护应成为循环管理的核心。
本例患者肺部严重化脓性感染后导致肺结构的显著破坏,肺循环面积减少,肺动脉压升高,从而出现右心功能不全[30],给予积极控制感染,因气道分泌物量大,给予积极的气道分泌物引流有利于肺部感染的控制。
本例患者在行ECMO 治疗中出现气胸,在调整抗凝策略的同时,行胸腔闭式负压引流改善胸腔内压。右心充盈压较其他腔室更易受到心包和胸腔压力的影响,心包填塞或胸腔压力增加导致跨右心室壁压力增加,从而影响有效射血[31]。正压通气、急性张力性气胸、大量胸腔积液及腹腔高压等情况下,胸腔内压在短时间内迅速增加,可通过影响右心室室壁的顺应性、右心房舒张和下腔静脉回流,影响右心的舒张功能[23,31]。一方面,胸腔内压增高可通过影响胸段下腔静脉和右心房舒张导致静脉回流减少,同时胸腔压力增加,静脉回流减少使右心室跨壁压差增加,为维持一定的心输出量,右心室舒张末期压力需代偿性增加,导致右心室室壁张力升高,使右心舒张的无张力期或低张力期明显缩短,右心舒张储备功能明显受损[23,32]。由于右心室舒张末压增高导致右心的心肌灌注减少,进一步降低了右心的舒张功能[19]。
VV-ECMO 能改善ARDS 合并的右心功能不全。一项研究中的13 例严重呼吸衰竭患者在行VV-ECMO 后,肺动脉的压力下降,其次是CVP略有下降,心脏指数增加,升压药剂量下调[33]。这些主要基于氧合的改善和二氧化碳的清除。Schmidt等[34]的研究提示缺氧性肺动脉收缩对于肺动脉前毛细血管内的氧分压的改变是非常敏感的,如果减少VV-ECMO 的气流量将会导致肺动脉压的快速升高。但是在需要ECMO 支持的重度ARDS患者中,肺动脉高压的发生率仍然有43%,右心功能不全为23%,并与死亡率相关[35]。可能的原因为疾病的本身进展,ECMO 的血流速度大,且为非波动性血流,影响右心的收缩与舒张功能,同时因存在ECMO 的置管和血液的体外循环引起炎症反应、溶血、出血和血栓栓塞等风险[36-37]。这些原因可能加重肺动脉压升高和/或右心功能不全。本例患者在出现右心功能不全时是否需改变ECMO 的模式进行了综合评估。首先应重新考虑在行ECMO 之后引起右心功能不全的原因;其次是去除影响肺动脉高压和右心功能不全的因素如上文所述的液体负荷、气道的引流、胸腹腔压力、降肺动脉压药物,并采用右心保护的肺通气策略。如果仍存在左心功能不全时,可以考虑行主动脉球囊反搏或改为外周型静-动脉体外膜肺氧合 (venoarterial extracorporeal membrane oxygenation,VA-ECMO),改善心功能及冠状动脉的灌注[38]。改为VA-ECMO 时应仔细斟酌利弊,虽然VAECMO 更能减轻右心的负荷,但左心室后负荷明显增加,通过左心室-左心房-肺循环-右心室传导及左心室被动增强的收缩过程,可能导致右心室舒张功能下降。同时由于分流,左心输出量下降,在左心仍存有射血功能的患者中,从股动脉的回血难以到达升主动脉的起始部,导致冠状动脉血流下降,而且血流量随ECMO 流量的增高而减少。如果患者的休克无法改善或休克进展的原因是心功能衰竭恶化,出现组织灌注不足 (血乳酸>8 mmol/L)、持续的进展性代谢性酸中毒(碱剩余≥-6),可以更改ECMO 模式为静脉-动脉-静脉体外膜肺氧合(veno-arterial-venous extracorporeal membrane oxygenation,VAV-ECMO) 模 式[39-40]。 对 于ARDS患者的右心衰竭,VAV-ECMO 可以减轻右心负荷,改善全身的低氧状态。但也同时减少了冠状动脉血流和增加了左心的后负荷,虽然与VAECMO 相比要轻,并与右心回血和动脉回血的比例相关。血流的调节方面也难以精确,通常动脉回血占总血流量的2/3[40]。VAV-ECMO 的整体管理难度加大,所以在更改模式时需仔细权衡,全面评估。本例患者因左心功能良好,在上述改善右心功能的措施后,右心功能得到改善,未改变ECMO的模式。
在ARDS 等重症疾病中,右心功能易受累,受累严重或未能及时纠正时,将引起严重血流动力学波动及后果。面对复杂的危重患者的右心功能,液体的优化(输注的总量与速度)、感染控制、气道的引流、改善胸腹腔压力、心率控制、药物降肺动脉压、右心保护的肺通气策略和ECMO 支持等是右心管理的主要措施,需要密切评估和综合管理。以右心保护为核心的循环管理是ARDS 治疗的关键环节之一。
利益冲突所有作者均声明不存在利益冲突
