鲜冬虫夏草冷水提取物体外抗炎作用研究
2020-07-01陈欣欣周红霞李润峰江海明邱健健李文佳姜志宏钟南山杨子峰
陈欣欣 周红霞 李润峰 江海明 邱健健 李文佳 姜志宏 钟南山杨子峰
1广州医科大学附属第一医院 广州呼吸健康研究院 呼吸疾病国家重点实验室 国家呼吸系统疾病临床医学研究中心510000;2广东东阳光药业有限公司国家中医药管理局重点研究室,东莞523850
COPD 是一种以呼吸系统持续气流受限为特征的可以预防和治疗的疾病,是仅次于高血压、糖尿病的中国第三大常见慢性病[1]。目前我国COPD患者人数约占全世界COPD 患者人数的25%[1]。香烟暴露是COPD 重要的危险因素,在疾病的发生和发展中起重要作用[2]。香烟暴露引起气道上皮细胞氧化应激和炎症反应[3],在此基础上感染细菌或病毒易引起急性加重,进一步促发更剧烈的炎症反应[4]。因此,抗炎是COPD 治疗必不可少的环节。目前抗炎药主要有吸入性糖皮质激素和磷酸二酯酶4抑制剂,有较好的疗效,但并未能完全逆转疾病的发展以及有效降低患者肺功能的年递减率,且有一定的不良反应,故需要寻求可长期使用且安全有效的新抗炎药。
本研究用人支气管上皮细胞 (human bronchial epithelial cell,16 HBE)和单核巨噬细胞 [佛波酯诱导人急性单核细胞白血病细胞(human acute monocytic leukemia cell,THP-1)贴壁]建立了香烟提取物 (cigarette smoke extraction,CSE)单一刺激或CSE 刺激后感染流感病毒的炎症因子表达模型,分别观察鲜冬虫夏草冷水提取物对炎症因子表达的抑制活性以及对黏液蛋白5AC (mucin 5AC,MUC5AC)高表达的抑制作用,从固有免疫反应角度阐明冬虫夏草提取物在体外治疗呼吸系统慢性炎症性疾病的药理活性。
1 材料与方法
1.1 材料
1.1.1 药物 鲜冬虫夏草冷水提取物由广东东阳光药业有限公司提供。将适量鲜冬虫夏草在冰浴下匀浆5 min,在冰上超声30 min,-20 ℃冷冻1 h后,再次匀浆5 min,4 ℃下,以离心半径6 cm、5 500 r/min离心10 min,取上清液,将上清液冷冻干燥,-20 ℃保存备用。
1.1.2 试剂 超氧化物歧化酶 (superoxide dismutase,SOD)试剂盒 (货号20180518,南京建成生物科技有限公司)、苯酚 (货号131714020,Aladdin)、RPMI 1640 basic(1×)培养基 (货号C11875500BT,美国Gibco 公司)、DMEM basic(1×)培养基 (货号C11995500BT,美国Gibco公司)、胎牛血清 (货号10270-106,美国Gibco 公司)、磷酸盐缓冲液(phosphate buffer saline,PBS)(货号C10010500BT,美国Gibco公司)、0.25%-乙二胺四乙酸胰酶 (货号25200-056,美国Gibco公司)、CCK-8 (货号CK04,日本东仁化学试剂研究所)、佛波酯 (货号1002511716,美国Sigma 公司)、RNA 提取试剂盒 (货号RC101-0150 rxn,南京诺唯赞生物科技有限公司)、PrimeScriptTMRT Master Mix (Perfect Real Time)反转录试剂盒 (货号 RR036A-1, 日本 Ta KaRa 公司)、PREmix Ex TaqTM(Probe qPCR)PCR 扩增试剂盒(货号RR390,日本Ta KaRa 公司)、Millicell EZ SLIDE 8-well玻片 (货号PEZGS0816,美国Millicell公司);4%多聚甲醛 (货号DF0135,捷倍斯生物科技有限公司);Triton-X100 (货号0694,捷倍斯生物科技有限公司);荧光放大系统试剂盒VectaFluor Antibody Kit Dy Light 488 (货号DK-2488,美国Vectorlab公司);Anti-MUC5AC抗体 (货号ab77576,美国Abcam 公司),DAPI抗荧光淬灭剂(货号P36935,美国Invitrogen公司)。
1.1.3 病毒与细胞 甲型流感病毒 [A/PR8/34(H1N1)]、狗肾上皮细胞、16 HBE 和THP-1均购自美国菌种保藏中心。
1.2 方法
1.2.1 药物不同成分的含量及酶活性测定 紫外高效液相色谱法分析样品核苷特征图谱,硫酸-苯酚法检测样品总糖含量,SOD 试剂盒检测样品SOD 活力。
1.2.2 CSE制备 将去掉过滤嘴的香烟点燃,用气体采样管(大包氏管)采集香烟主流烟雾,2个串联的大包氏管内各装有5 ml无血清的DMEM 培养基作为吸收液,一端连接香烟,另一端连接50 ml注射器,以50 ml/min的速度吸烟2支,每支烟吸10 次,然后将该溶液p H 值调整为7.40,并用直径为0.20μm 滤膜过滤,去除细菌和颗粒,该溶液为100%CSE[5]。
1.2.3 CSE 的细胞毒性测定 16HBE 于96孔板长至70%后进行饥饿处理,用无血清的培养基孵育24 h后,加入不同浓度梯度的CSE (0%、1%、2%、3%、4%、5%、6%、7%、8%、9%),每个浓度设置4个复孔,48 h后每孔加10μl CCK-8溶液,作用2 h后测定OD450值。96孔板每孔加入3×104个THP-1 细胞,用100μg/L 的PMA诱导分化为巨噬细胞,24 h后用PBS 洗2 次,每孔加RPMI1640培养基100μl继续孵育24 h,然后加入相同梯度浓度的CSE,24 h后测定OD450值。计算药物对细胞的半数毒性浓度 (50%toxic concentration,TC50)。
1.2.4 药物的细胞毒性测定 药物从8 000 mg/L倍比稀释为7个浓度的含药溶液,加入96孔板的16 HBE和THP-1细胞中,每个浓度4个复孔,孵育24 h (THP-1细胞)和48 h (16HBE 细胞)后每孔加10μl CCK-8溶液,作用2 h后用酶标仪测定OD450值。
1.3 鲜冬虫夏草体外抗炎作用
1.3.1 CSE 诱导细胞不同时间点的炎症因子检测 16HBE以2×105个/ml的密度铺于12孔板,待细胞长至70%的时候饥饿处理24 h,用3%CSE刺激12、24、48 h,提取核酸样本,进行逆转录和荧光定量PCR 检测炎症介质mRNA 表达。在12孔板中,用100μg/L PMA 诱导THP-1 (1×105个/ml)分化成贴壁细胞,作用24 h后用PBS洗2次,加入DMEM 培养基培养24 h后用3%的CSE刺激4、8、12 h,提取核酸,用qPCR 方法检测炎症介质m RNA 表达。
1.3.2 药物对CSE诱导细胞炎症因子表达的抑制作用 使用与1.3.1相同的方法造模,16 HBE 细胞刺激48 h,THP-1细胞刺激8 h,CSE刺激的同时加入1 000、500、250 mg/L鲜冬虫夏草水提取物,提取核酸,用qPCR 检测炎症因子m RNA 表达。
1.3.3 药物对CSE刺激后感染H1N1流感病毒的抗炎作用 12孔板单层16HBE细胞饥饿24 h,分为7个组,方法见表1。
实验终点后,提取核酸,用qPCR 方法检测炎症因子m RNA 表达。各种炎症介质引物探针 (表2)由华大基因生物有限公司合成。
1.3.4 CSE 诱导细胞表达MUC5AC 的免疫荧光实验 16HBE 细胞消化后均匀铺于8 孔玻片中,培养24 h后,饥饿处理24 h,饥饿后,按照实验设置,1 000 mg/L 和500 mg/L 的药物与CSE 共同加入细胞中,37 ℃孵育48 h,取出8 孔玻片,PBS冲洗,4%多聚甲醛固定15 min后PBS冲洗3次,每次5 min,0.3% Triton-X100 透化3 min,PBS冲洗3次,每次5 min,2.5%马血清,37 ℃封闭20 min,PBS 冲洗后加入MUC5AC 一抗(1∶100),4℃过夜,PBS冲洗3次,每次5 min,用荧光放大系统试剂盒,按照说明书,每孔中的玻片上滴加200μl二抗,37 ℃孵育15 min,PBS冲洗3 次,每次5 min,冲洗后每孔加入200 μl Dy Light-488试剂孵育30 min,PBS冲洗3次,每次5 min,滴加抗荧光淬灭剂,封片,置于镜下观察。
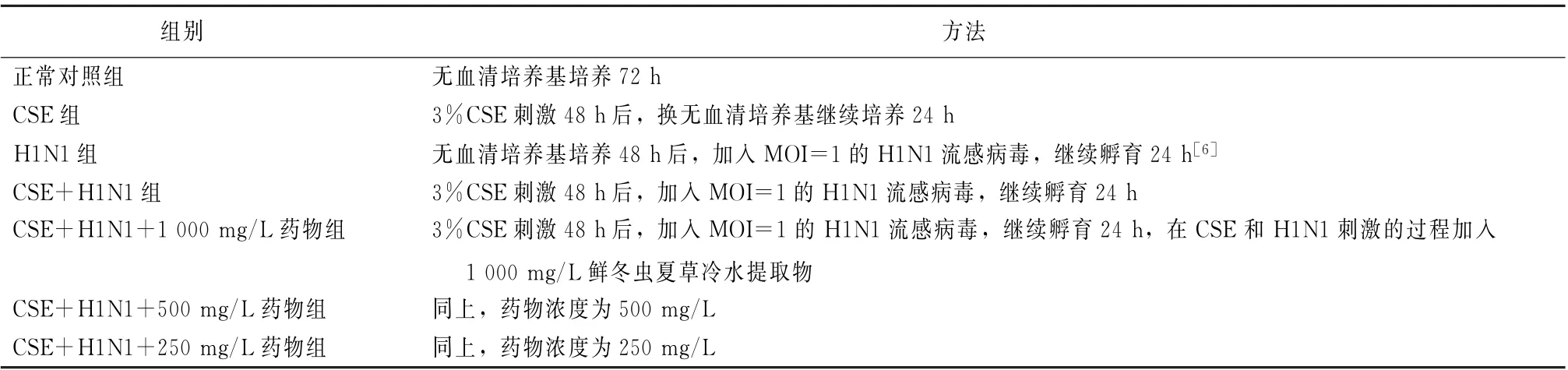
表1 药物对CSE刺激后感染H1N1流感病毒的抗炎作用实验方法

表2 炎症介质各基因引物序列
2 结果
2.1 药物不同成分的含量和酶活性 结果显示,鲜冬虫夏草水提取物的总核苷含量为0.423%,总糖含量为18.69%,SOD 活力为14 736.5 U/ml。
2.2 药物的细胞毒性 CCK-8法测定鲜冬虫夏草冷水提取物对16 HBE 细胞和THP-1细胞的TC50分别为4 677.35 mg/L 和5 520.77 mg/L。结合显微镜观察,1 000 mg/L 鲜冬虫夏草冷水提取物处理的2种细胞病变明显,与正常对照组形态相同,故确定此浓度为后续药效实验的最高允许浓度。
2.3 CSE刺激诱导16HBE 和THP-1细胞的炎症因子表达 CCK-8染色显示,CSE 对16HBE 细胞和THP-1细胞的无毒浓度为2.2%。用3%CSE 刺激2 种细胞,不同时间点 (16HBE:12、24、48 h;THP-1:4、8、12 h)测定炎症因子m RNA表达水平。结果表明,16HBE 细胞的IL-6、IL-8和MUC5AC的m RNA 表达高峰出现在CSE 刺激后48 h,而THP-1细胞的肿瘤坏死因子α、IL-1β、IL-6和IL-8表达高峰在刺激后8 h。据此,确定药物在16HBE细胞的抗炎活性检测时间点为CSE刺激后48 h,THP-1 细胞的检测时间点为刺激后8 h。
2.4 药物在单一CSE刺激气道上皮和单核巨噬细胞模型的抗炎活性 与CSE 刺激组比较,1 000 mg/L和500 mg/L 药物对CSE 刺激16 HBE细胞48 h引起IL-6的m RNA 表达有明显抑制活性(t 值分别为6.514、5.156,P 值均<0.05);1 000 mg/L药物对CSE刺激16HBE 细胞48 h引起IL-8 的m RNA 表达有明显抑制活性 (t =4.304,P <0.05); 各剂量 (1 000、500、250 mg/L)药物显著抑制了MUC5AC 的m RNA表达 (t 值分别为8.922、5.796、7.842,P 值均<0.05)。见表3。
各剂量 (1 000、500、250 mg/L)对CSE 刺激THP-1细胞8 h引起肿瘤坏死因子α的表达有明显抑制作用(t值分别为9.549、9.616、8.573,P 值均<0.05),对IL-6的表达亦有抑制作用 (t值分别为4.458、5.399、4.151,P 值均<0.05),1 000 mg/L和500 mg/L药物组的IL-1β表达明显低于CSE刺激组(t值分别为7.237、6.020,P 值均<0.05),250 mg/L剂量对IL-1β表达无明显影响(P >0.05)。见表4。
表3 香烟提取物刺激16HBE细胞和不同浓度的药物干预组的细胞因子m RNA 相对表达量 (±s)
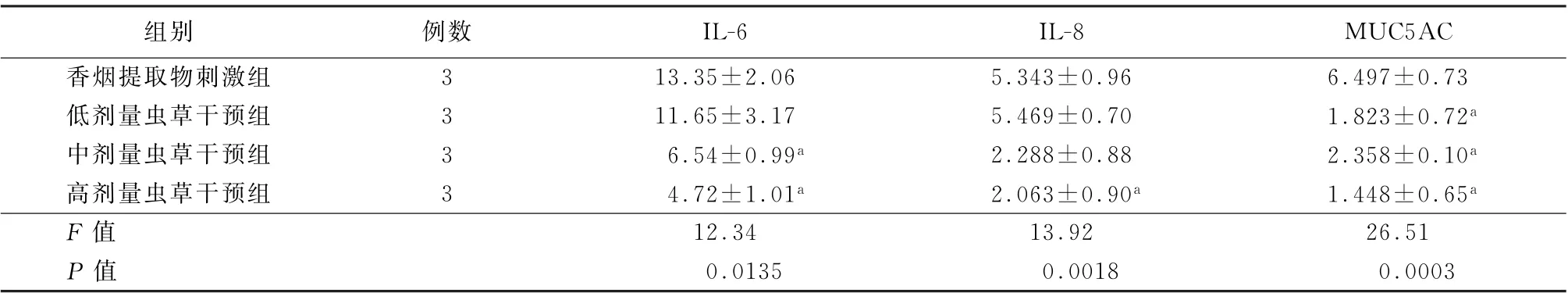
表3 香烟提取物刺激16HBE细胞和不同浓度的药物干预组的细胞因子m RNA 相对表达量 (±s)
注:MUC5AC为黏液蛋白5AC;与香烟提取物刺激组比较,a P <0.05
组别例数IL-6 IL-8 MUC5AC香烟提取物刺激组3 13.35±2.06 5.343±0.96 6.497±0.73低剂量虫草干预组3 11.65±3.17 5.469±0.70 1.823±0.72a中剂量虫草干预组3 6.54±0.99a 2.288±0.88 2.358±0.10a高剂量虫草干预组3 4.72±1.01a 2.063±0.90a 1.448±0.65a F 值12.34 13.92 26.51 P 值0.0135 0.0018 0.0003
表4 香烟提取物刺激THP-1细胞和不同浓度的药物干预组的细胞因子m RNA 相对表达量 (±s)
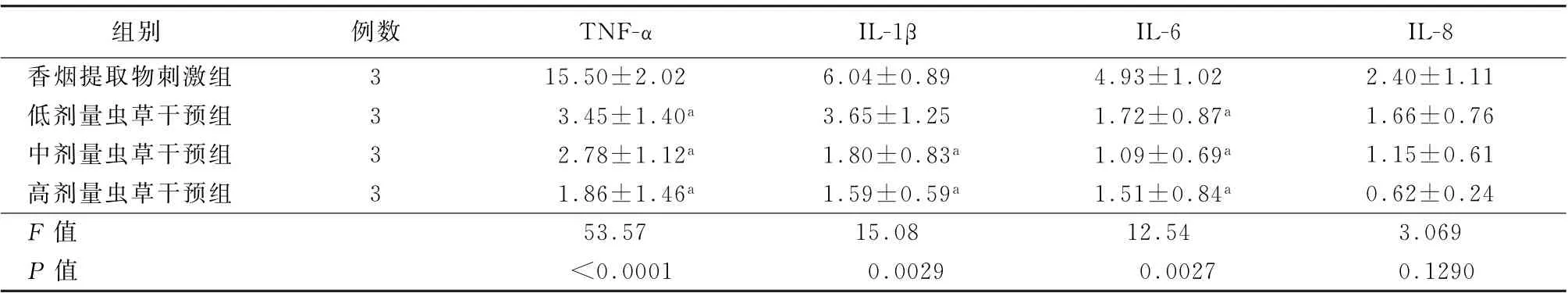
表4 香烟提取物刺激THP-1细胞和不同浓度的药物干预组的细胞因子m RNA 相对表达量 (±s)
注:TNF-α为肿瘤坏死因子α;与香烟提取物刺激组比较,a P <0.05
组别例数TNF-αIL-1βIL-6 IL-8香烟提取物刺激组3 15.50±2.02 6.04±0.89 4.93±1.02 2.40±1.11低剂量虫草干预组3 3.45±1.40a 3.65±1.25 1.72±0.87a 1.66±0.76中剂量虫草干预组3 2.78±1.12a 1.80±0.83a 1.09±0.69a 1.15±0.61高剂量虫草干预组3 1.86±1.46a 1.59±0.59a 1.51±0.84a 0.62±0.24 F 值53.57 15.08 12.54 3.069 P 值<0.0001 0.0029 0.0027 0.1290
2.5 药物在CSE刺激气道上皮后感染流感病毒的抗炎活性 与单一感染H1N1流感病毒相比,CSE刺激16 HBE 细胞48 h 后再感染H1N1 (CSE+H1N1组)诱导的IL-8和干扰素βmRNA 表达水平均显著升高(t值分别为6.567、13.21,P 值均<0.05),且高于单一CSE与单一流感引起炎症介质表达水平之和,表明CSE 与H1N1流感感染具有协同促进炎症因子表达的作用。与CSE+H1N1组比较,各浓度 (1 000、500、250 mg/L)药物均明显抑制了IL-8 m RNA 的表达 (t 值分别为8.970、6.800、5.302,P 值均<0.05)和干扰素β m RNA 的表达 (t 值分别为23.46、22.12、17.53,P 值均<0.05);1 000 mg/L 药物组明显抑制IL-6 m RNA 表达 (t=5.860,P <0.05)。见表5。
2.6 药物对CSE 刺激气道上皮细胞表达MUC5AC的影响 正常16HBE 细胞的胞核及胞浆表达较弱的MUC5AC 荧光,3%CSE 刺激48 h后,MUC5AC表达明显增强。1 000 mg/L药物干预后,MUC5AC 荧光集中在胞核及其邻近区域,胞浆表达明显减少。1 000 mg/L 药物干预组明显比3%CSE 刺激组的绿色荧光强度弱,500 mg/L药物干预组的绿色荧光强度与3% CSE 刺激组接近。见图1。
3 讨论
冬虫夏草多糖已被证实具有免疫调节和抗氧化作用[7],是冬虫夏草活性成分之一。SOD 可高效催化超氧化物自由基分解,清除氧自由基,对抗氧化应激反应。同时研究结果证实鲜冬虫夏草中的SOD 活性最高,约为60 ℃烘干冬虫夏草的3倍[8],揭示了低温化提取或服用有利于保留SOD等活性成分。鲜冬虫夏草冷水提取物总糖含量(18.69%)和SOD 活力 (14 736.5 U/ml)较高,有利于发挥抗炎抗氧化药理活性。
香烟暴露刺激上皮细胞和巨噬细胞分泌炎症介质,本研究构建了CSE诱导局部气道上皮细胞(16HBE 细胞,暴露48 h)和固有免疫细胞(THP-1细胞,暴露8 h)炎症反应的细胞模型,评价鲜冬虫夏草冷水提取物的抗炎活性。
表5 各组细胞因子mRNA 相对表达量 (±s)

表5 各组细胞因子mRNA 相对表达量 (±s)
注:IFN-β为干扰素β;与流感病毒刺激组比较,a P <0.05;与香烟提取物+流感病毒刺激组比较,b P <0.05
组别例数IL-6 IL-8 IFN-β香烟提取物刺激组3 1.85±0.42 1.59±0.18 2.01±0.21流感病毒刺激组3 9.19±1.82 12.74±1.46 354.63±32.08香烟提取物+流感病毒刺激组3 12.55±2.31 27.19±3.52a 776.91±45.13a低剂量虫草干预组3 8.50±1.53 14.07±2.45b 238.85±28.07b中剂量虫草干预组3 4.55±1.41 11.19±2.06b 130.95±22.81b高剂量虫草干预组3 3.75±1.21b 7.66±1.36b 107.99±20.06b F 值21.32 48.90 288.2 P 值0.0002<0.0001<0.0001

图1 鲜冬虫夏草冷水提取物对CSE诱导16HBE表达MUC5AC免疫荧光的抑制作用
在单一CSE 刺激的基础上,进一步增加了流感病毒感染的因素,因为感染在COPD 发病和临床转归中起重要作用,接近50%的COPD 急性加重与病毒感染有关,其中流感病毒占7.83%[9]。本研究发现鲜冬虫夏草冷水提取物对CSE 复合流感病毒感染引起的炎症介质m RNA 表达均有显著的抑制活性,高浓度药物的炎症介质表达低于单一感染流感的表达,说明冬虫夏草对CSE 与流感病毒感染协同促进炎症反应具有较好抑制活性。
黏液高分泌是COPD 的重要病理生理特征。本文构建了CSE 刺激16HBE 细胞引起MUC5AC高分泌的模型,从m RNA 表达水平和免疫荧光发现MUC5AC表达高峰出现在刺激后48 h,选择此时间点进行药效观察。结果显示,鲜冬虫夏草冷水提取物可显著抑制CSE 诱导的MUC5AC 高分泌。冬虫夏草对COPD 气道黏液高分泌的抑制活性有待进一步在动物模型进而在COPD 患者来源的原代细胞模型中得到证实。
本研究存在以下局限性:(1)鲜冬虫夏草冷水提取物的抗炎效应局限在m RNA 水平,需进一步在蛋白水平展开评价; (2)本研究选用了非Th2型细胞因子作为抗炎评价指标,而Th2型细胞因子(如IL-4、IL-5 和IL-13 等)同样也是COPD治疗的重要指标[10],需据此进一步拓展鲜冬虫夏草冷水提取物的抗炎症因子谱;(3)本文已发现鲜冬虫夏草冷水提取物对CSE 刺激致MUC5AC 高分泌有抑制作用,对CSE 刺激后感染流感的药效尚待进一步研究。
综上所述,本研究首先发现了鲜冬虫夏草冷水提取物可有效抑制CSE 单一刺激或复合流感病毒感染诱导16HBE细胞的炎症反应,并且在CSE刺激的THP-1细胞炎症模型中兼具抗炎活性。其次,鲜冬虫夏草冷水提取物可显著抑制CSE 刺激气道上皮细胞的MUC5AC高分泌。本研究揭示了冬虫夏草兼具潜在治疗COPD 炎症和黏液高分泌两大病理生理特征的药用特色,比单一靶点药物药效更全面,值得进一步在动物模型开展药效确认和机制研究。
利益冲突所有作者均声明不存在利益冲突
