粘红酵母对猕猴桃贮藏期青霉病的抑制效果
2020-07-01刘颖沙李国秀
雷 琼,刘颖沙,李国秀
(杨凌职业技术学院,陕西 杨凌 712100)
猕猴桃具有丰富的营养价值和良好的药用价值,其维生素C的含量远远超过柑橘、苹果和梨,有VC之王的美称[1]。进入21世纪以来,我国猕猴桃产业发展迅速,种植规模逐年增加,猕猴桃产量也随之增加,猕猴桃采后在贮藏期出现的软腐病问题也日益突出[2]。在陕西、四川、贵州和江西等省猕猴桃主要生产区,猕猴桃软腐病发生普遍,平均发病率达20%~50%,造成严重的经济损失[3]。段爱莉等[4]对陕西周至主栽猕猴桃品种贮藏期霉烂果实病原菌分离鉴定发现,其病原菌主要为青霉属(Penicillium)、木霉属(Trichoderma)、交链孢霉属(Alternaria)、毛霉属(Mucor)和拟青霉属(Simplicillium),其中青霉属为优势菌。不同的研究报道显示,青霉病的病原菌种类不同,且优势种类存在一定地域差异,对于青霉引起的腐烂病,其研究集中在室内药剂筛选和田间药效防治方面[3,5-6]。目前,关于猕猴桃贮藏期由青霉引起的腐烂病的药效验证及安全性检测尚未有研究报道。青霉属于真菌,真菌引起的猕猴桃采后及贮藏期病害的防治目前主要采用化学方法,但长期使用化学杀菌剂一方面会使病原菌产生抗性,另一方面化学残留也威胁人类健康。随着人们对食品安全和品质要求的提高,化学杀菌剂的使用也受到了限制[7]。粘红酵母(Rhodotorulaglutinis)作为一种生物防治的拮抗菌,具有拮抗效果好,不产生毒素,可以和化学杀菌剂共同使用等特点,对梨、苹果、桃及草莓等水果在采后贮藏期青霉菌引起的腐烂病具有明显的防治效果[8]。陕西杨凌猕猴桃采后贮藏期的腐烂病主要由青霉菌引起,为研究粘红酵母对猕猴桃青霉菌的控制效果,进行粘红酵母对猕猴桃青霉菌的体外抑菌试验和果实接种试验,以期对陕西猕猴桃采后贮藏和保鲜提供新的思路和途径。
1 材料与方法
1.1 材料
1.1.1 猕猴桃果实 以正常成熟的猕猴桃果实为试验对象,品种为海沃德,购自陕西杨凌五泉镇猕猴桃基地。选择无机械损伤、无虫伤、健康的猕猴桃果实,其大小、成熟度等外观基本一致,分组待用。
1.1.2 试验菌株 粘红酵母(Rhodotorulaglutinis)由杨凌职业技术学院食品微生物实验室提供;扩展青霉(Penicilliumexpansum)从腐烂的猕猴桃果实分离获得,由杨凌职业技术学院植物病理实验室提供。
1.1.3 试验仪器 数显恒温振荡培养箱(HZQ-F160),台式离心机(L550),千分之一电子天平(AX223ZH/E),隔水式恒温培养箱(GHP-9160N),高压灭菌锅(上海申安LDZX-30KBS),移液器(100 μL)、血球计数板(25×16),光学显微镜(奥林巴斯CX23)。
1.2 方法
1.2.1 拮抗菌制备 在 250 mL的三角瓶中装入 50 mL的120Brix麦芽汁培养基,灭菌、接种,28℃、200 r/min振荡培养20 h,3 000 r/min离心10 min收集菌体。血球计数板计数,调整其浓度,制成相应浓度的处理液。
1.2.2 病原菌孢子悬浮液制备 病原菌在PDA培养基上28℃培养7 d后,刮取适量孢子,转移到无菌生理盐水中,采用血球记数板计数,将其孢子浓度调至5×104个/mL。
1.2.3 粘红酵母处理液制备 培养原液,将在麦芽汁培养基振荡培养20 h的粘红酵母培养液,用血球计数板调整其浓度为108CFU/mL;菌悬液,将上述培养原液离心后收集菌体,用无菌生理盐水制成的菌悬液,其浓度为108CFU/mL;滤液为离心后的上清液。
1.2.4 粘红酵母对青霉菌的体外抑菌试验 取108CFU/mL、107CFU/mL、106CFU/mL和105CFU/mL粘红酵母菌悬液、培养原液(108CFU/mL)、滤液(108CFU/mL)和无菌水各0.l mL,分别加至装有5 mL PDB的无菌试管内,向各试管加入0.l mL浓度为5×104个/mL青霉菌孢子悬浮液。试验共7个处理,2次重复。将所有试管置于28℃的振荡培养摇床,80 min/r培养12 h,用普通光学显微镜和血球计数板分别测量各处理中青霉菌的孢子萌发率和芽管伸长长度。
1.2.5 不同处理粘红酵母对青霉菌接种抑菌试验 用70%酒精将猕猴桃果实浸泡40~50 s,无菌水冲洗果实2~3次,无菌滤纸吸干果实表面水分。用直径9 mm的无菌打孔器在每个果实表面赤道部位对称打2个孔,深度为3 mm。每孔加入30 μL粘红酵母不同处理液(108CFU/mL培养原液,108CFU/mL菌悬液,108CFU/mL滤液,无菌水CK),4 h后再在每孔口处加入15 μL青霉菌孢子悬浮液。用保鲜膜密封孔口,然后将所有果实置于保鲜盒中,在室温条件(20℃)贮藏5 d。试验共4个处理,每处理选择5个果实,2次重复。5 d后取出果实,用游标卡尺测量果实的病斑直径,计算发病率。
1.2.6 不同浓度粘红酵母菌悬液对青霉菌接种抑菌试验 将粘红酵母的菌悬液的浓度分别调整为109CFU/mL、108CFU/mL和107CFU/mL、106CFU/mL,以无菌水作为对照,按照1.2.5的方法接种猕猴桃,考察不同浓度粘红酵母菌悬液处理猕猴桃果实的病斑直径和发病率。试验共5个处理,每处理选择5个果实,2次重复。5 d后取出果实,测量果实病斑直径,计算发病率。
1.3 数据处理
采用Excel 2016和SPSS 25.0进行数据统计,SPSS 25.0对数据进行单因素方差分析,Duncan新复极差法检验显著性。
2 结果与分析
2.1 粘红酵母不同处理对青霉菌孢子萌发的抑制效果
从表1看出,粘红酵母菌菌悬液在低浓度(105CFU/mL)时,对青霉菌孢子具有抑制作用,孢子萌发率为30%。当粘红酵母菌悬液和培养液的浓度均为108CFU/mL,青霉菌孢子的萌发很低,分别为3%和5%,显著低于滤液和对照;芽管的伸长长度也明显低于滤液和对照。表明,粘红酵母菌悬液和培养液均能在一定程度抑制青霉菌孢子的萌发,随着粘红酵母菌悬液浓度增大,孢子萌发率和芽管伸长长度均明显降低;滤液和无菌水对青霉菌孢子均无抑制作用,芽管生长良好。
表1 粘红酵母不同处理对青霉菌孢子萌发的体外抑制效果
Table 1 In vitro inhibition effect ofR.glutiniswith different concentration on spore germination ofPenicillium

处理Treatment孢子萌发率/%Spore germination rate芽管长度/μmGerm tube length粘红酵母菌悬液 105CFU/mL 30.0 b23.3 c 105 CFU/mL R. glutinis suspension粘红酵母菌悬液 106 CFU/mL 10.0 c16.4 c 106 CFU/mL R. glutinis suspension粘红酵母菌悬液 107 CFU/mL 11.0 c9.3 c 107 CFU/mL R. glutinis suspension粘红酵母菌悬液 108 CFU/mL 3.0 c8.4 c 108 CFU/mL R. glutinis suspension粘红酵母培养液 108 CFU/mL5.0 c30.3 b 108 CFU/mL R. glutinis solution粘红酵母滤液(108 CFU/mL)100.0 a50.8 b 108 CFU/mL R. glutinis filtrate无菌水(CK) Sterile water100.0 a65.0 a
注:同列不同小写字母表示差异显著(P<0.05),下同。
Note: Different lowercase letters in the same column indicate significance of difference atP<0.05.
2.2 粘红酵母不同处理对青霉菌的接种抑菌效果
病原微生物主要以果实表面的伤口侵入,引起果实采后贮存期腐烂变质。有研究表明[9-10],当果实表面存在伤口时,果实表面的拮抗酵母与病原菌在短时间内(24 h)产生营养和空间上的竞争关系,从而抑制病原菌生长。由图1看出,猕猴桃采后接种青霉病菌,粘红酵母不同处理对青霉病的防治效果不同。粘红酵母菌悬液(108CFU/mL)抑制猕猴桃采后青霉病害的效果最佳,其发病率和病斑直径分别为40%和3 cm,二者均大幅低于其他3种处理液(培养原液、滤液和无菌水)。浓度相同(108CFU/mL)条件下,培养原液抑菌效果低于菌悬液,其发病率和病斑直径分别为50%和3.5 cm。用粘红酵母滤液处理猕猴桃果实,加重病害发生,发病率高达100%。原因可能是滤液中存在某些营养物质利于青霉菌的生长。
2.3 不同浓度粘红酵母菌悬浮液对青霉菌的抑菌效果
从表2看出,猕猴桃采后接种青霉菌,不同浓度粘红酵母菌悬液对青霉病的防治效果存在差异。粘红酵母菌悬液浓度越大,猕猴桃青霉病发病率和病斑直径越小,抑菌效果越好。粘红酵母菌悬液浓度为109CFU/mL时,发病率和病斑直径分别为 6%和0.9 cm,显著低于除108CFU/mL外的其余处理,几乎完全控制青霉菌的发展。对照(无菌水)的发病率和病斑直径分别为100%和3.4 cm。因此,在猕猴桃贮藏期间,综合考虑经济价值和抑菌效果,可选用108CFU/mL的粘红酵母菌悬液来降低青霉病的发生,延长贮藏时间。
表2 不同浓度粘红酵母菌悬液对青霉菌的抑菌效果
Table 2 Inhibition effect ofR.glutinissuspension with different concentration onPenicillium
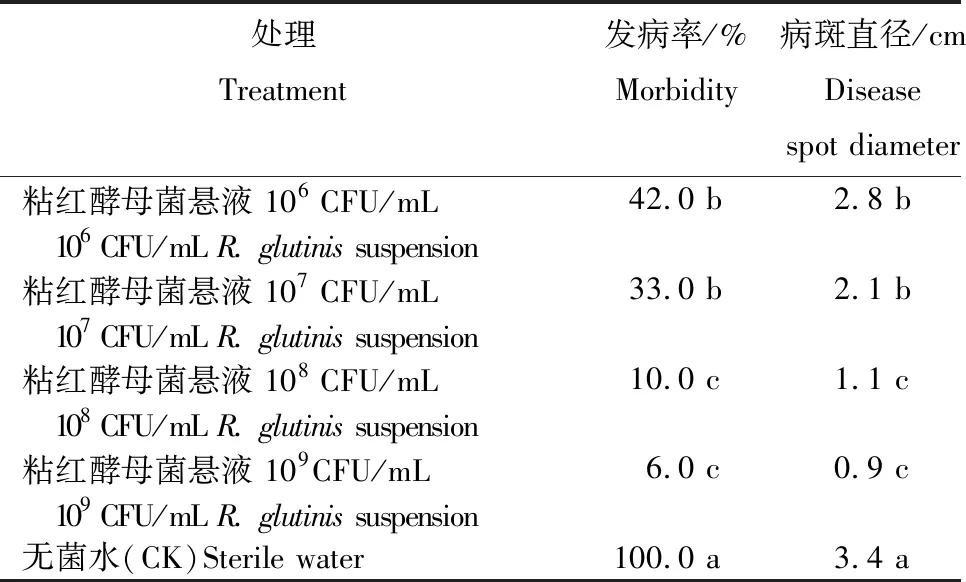
处理Treatment发病率/%Morbidity病斑直径/cm Disease spot diameter粘红酵母菌悬液 106 CFU/mL 42.0 b2.8 b 106 CFU/mL R. glutinis suspension粘红酵母菌悬液 107 CFU/mL 33.0 b2.1 b 107 CFU/mL R. glutinis suspension粘红酵母菌悬液 108 CFU/mL 10.0 c1.1 c 108 CFU/mL R. glutinis suspension粘红酵母菌悬液 109CFU/mL 6.0 c0.9 c 109 CFU/mL R. glutinis suspension无菌水(CK)Sterile water100.0 a3.4 a
3 结论与讨论
粘红酵母作为一种生防菌对多种水果采后引起的腐烂病具有较好的防治效果[8],前人的研究多集中在苹果、梨、草莓、甜樱桃及柑橘等水果采后病害的研究。通过粘红酵母不同浓度(108CFU/mL、107CFU/mL、106CFU/mL和105CFU/mL)和不同类型(培养原液、菌悬液、滤液)处理液进行青霉菌体外抑制试验和猕猴桃果实青霉菌接种防治试验,研究粘红酵母对猕猴桃贮藏期由青霉菌引起的腐烂病的抑制效果,结果表明,粘红酵母菌悬液、培养液均能在一定程度抑制青霉菌孢子的萌发,而滤液没有抑制作用。在粘红酵母不同处理液中,以粘红酵母菌悬液处理的青霉菌抑菌效果最佳,当粘红酵母菌悬液处理浓度为109CFU/mL时,猕猴桃果实在20℃的室温条件贮藏,接种青霉病菌的果实发病率和病斑直径分别为 6%和0.9cm,几乎完全控制青霉菌的发展,但防治效果与粘红酵母菌悬液108CFU/mL处理的差异不显著。因此,在猕猴桃贮藏期间,综合考虑经济价值和抑菌效果,可选用108CFU/mL的粘红酵母菌悬液来降低青霉病的发生,延长贮藏时间。
研究表明,采用粘红酵母菌悬液处理猕猴桃果实,能一定程度抑制猕猴桃腐烂病发生,但猕猴桃的其他理化性质是否发生改变,需要进一步研究。因此,为了进一步提高粘红酵母的抑菌效果,还需深入研究其抑菌机理。
