Nesfatin-1 对高糖高脂诱导的睾丸间质细胞氧化应激的干预作用
2020-07-01蔡旺春胡亚楠胡振兴李广永吴海峰李培军
蔡旺春, 胡亚楠, 胡振兴, 李广永, 吴海峰, 何 瑞, 李培军
(1.宁夏医科大学生育力保持教育部重点实验室,银川 750004; 2.宁夏医科大学总医院,银川 750004)
根据国际糖尿病联合协会(IDF)报道,我国已成为全球患有糖尿病人数最多的国家之一[1]。据报道[2-3],生殖系统功能障碍是糖尿病并发症之一,其中,糖尿病性勃起功能障碍发病率随年龄的增长逐渐升高,在20~30 岁的患者中,勃起功能障碍(ED)的发生率为25%~30%,50 岁以上则升至50%~70%。成人男性糖尿病患者中,发生阳萎者占30%~60%,其次可出现逆行射精、早泄、性欲减退等症。糖尿病患者的生殖功能障碍,与血糖升高、血脂异常引起氧化应激反应导致睾丸功能受损[4],进而影响睾丸间质细胞(TM3 细胞)分泌睾酮的功能[5-6],最终导致糖尿病睾丸功能损伤,引发雄性的不育[7-8]。Nesfatin-1 是近年来发现的一种新的胃肠多肽,在中枢下丘脑区域阳性表达,与机体神经内分泌功能紧密相关,参与调节下丘脑-垂体-性腺轴,影响生殖系统的发育及调控功能。有报道[9],Nesfatin-1 参与改善机体胰岛素靶器官对胰岛素的敏感性,纠正血糖、血脂异常,从而改善糖尿病及其生殖系统等并发症,而Nesfatin-1 改善糖脂代谢的功能与氧化应激有关[10]。本研究通过高糖高脂诱导TM3 细胞,模拟糖尿病高脂高糖环境造成的睾丸氧化应激,给予10-8M Nesfatin-1 干预治疗,探讨Nesfatin-1对高糖及高脂诱导的TM3 细胞氧化应激损害的抵抗和改善作用,以期进一步研究糖尿病患者生殖功能障碍的发生及改善的相关机制,为糖尿病患者生殖功能障碍的预防和治疗提供新的思路及新靶点。
1 材料与方法
1.1 材料
1.1.1 细胞系 TM3 细胞(中国科学院的上海细胞生物学研究所)。
1.1.2 药品与试剂 丙二醛(MDA)测试盒、超氧化物歧化酶(SOD 测试盒)、细胞冻存液、CCK-8试剂盒购于南京建成生物工程研究所,胰蛋白酶和新生小牛血清购于浙江天杭生物科技有限公司,DMEM(高糖型)培养基购于赛默飞世尔(苏州)仪器有限公司,DMSO(纯度99.5%)购于无锡市的亚泰联合化工有限公司,油酸(OA)购于Sigma 公司。
1.1.3 仪器与设备 酶标仪BE-9008(北京东南仪诚实验室设备有限公司)、超净工作台(苏州安泰空气技术有限公司)、荧光倒置显微镜(德国Bresser 公司制造)、高速台式离心机(上海力申科学仪器有限公司)、CO2培养箱(上海力申科学仪器有限公司)。
1.1.4 溶液配制 1)高脂液: 量取9.7 μL OA 置于1.5 mL Ep 管中,打开盖子并放在超净台中,用紫外灯照射消毒约30 min,然后加入40 μL 已消毒的DMSO 溶液,振荡使其充分溶解,即为备用的62.5 Um OA[11]母液。在造模前,先用50 mL的完全培养基DMEM(含有1%双抗、10%新生小牛血清)来稀释上面的母液至造模所需的相应浓度,放于-4 ℃保存;高糖液:用45 mL 高糖(市售)的完全培养基DMEM,加入0.45 mL 双抗、4.5 mL 新生小牛血清,放于-4 ℃保存;高糖高脂液:用50 mL 的高糖液来稀释高脂的母液至造模所需的相应浓度,放于-4 ℃保存。2)配制含有10%新生小牛血清的细胞培养液:量取10 mL 新生小牛血清和90 mL DMEM 培养基、0.9 mL 双抗,混匀。3)Nesfatin-1 溶液:配制10-8M Nesfatin-1[12-14],量取12.5 μL Nesfatin-1 母液和50 mL 高糖高脂液,混合均匀。
1.2 实验方法
1.2.1 细胞培养及实验分组 将小鼠TM3 细胞接种在直径10 cm 的培养皿中,加入6 mL 的细胞培养液,放置在5%CO2、37 ℃的培养箱中培养,等TM3 细胞贴壁之后给予换液1 次;之后隔天给予换液1 次,待TM3 细胞增殖并平铺75%培养皿后进行细胞传代。丢弃培养皿中的原有培养液,用PBS 液冲洗2 遍,随即滴加0.25%的胰酶1 mL 进行消化和细胞传代。取对数生长期的细胞,用胰酶消化后,滴加9 mL 的培养液,配成单细胞悬液(1×104个/mL),并接种在96 孔培养板中,每一孔加入100 μL 用于铺板,使TM3 细胞的密度至10000 个/孔,并把培养板放置在37 ℃、5% CO2培养箱中孵育24 h,在倒置显微镜下进行观察,主要观察TM3 细胞的贴壁及其生长状况;待细胞增殖铺满每孔的70%后,丢弃原有的细胞培养液,于每孔再分别滴加培养基至以下4 组中:完全培养基DMEM(对照组,C 组)、25 Mm 高糖[12,15]完全培养基DMEM(高糖组,G 组)、62.5 Um 油酸的完全培养基DMEM(高脂组,O 组),62.5 Um 油酸与25 Mm 高糖完全培养基DMEM(高糖高脂组,GO 组),每个造模组设置4 个复孔,然后继续孵育6 h、12 h、24 h,进行以上4 组细胞活力检测。选取对细胞存活抑制最强的高糖高脂联合模型组给予10-8M Nesfatin-1 干预(高糖高脂+Nesfatin-1 干预组,GO+N 干预组),10-8M Nesfatin-1 干预1h 之后,进行细胞活力检测。
1.2.2 CCK-8 法检测细胞的活力 上述5 组孵育6 h、12 h、24 h 后按照试剂盒说明每一孔滴加10 μL 的CCK8 的检测液,并在37 ℃的条件下孵育2 h,在读数之前放置摇床上,低速振荡缓慢混合均匀。在酶标仪450 nm 处测量其各孔的相应光密度(OD)值。细胞存活率(%)=[(实验孔OD 值-空白孔OD 值)(/对照孔OD 值-空白孔OD 值)]×100;抑制率(%)=[(对照孔OD 值-实验孔OD 值)(/对照孔OD 值-空白孔OD 值)]×100。对照孔:细胞、CCK-8、培养基,空白孔:CCK-8、培养基,实验孔:CCK-8、培养基、细胞、受试化合物。
1.2.3 TM3 细胞SOD 活性的检测 每组设置4个复孔,然后继续培养24 h,进行细胞SOD 活性的检测。选取对细胞存活抑制最强的高糖高脂联合模型组给予10-8M Nesfatin-1 干预(GO+N 组)细胞,10-8M Nesfatin-1 干预1h 之后,进行细胞SOD 活性的检测。对各组培养细胞用0.25%的胰酶消化随后收集细胞,用细胞破碎仪超声破碎细胞,根据SOD 测定试剂盒说明书,检测每组细胞培养液中SOD 含量,用酶标仪在450 nm 处测定其光密度(OD)值。设置4 个复孔取均值。
1.2.4 TM3 细胞MDA 含量测定 细胞处理同1.2.3,根据MDA 测定试剂盒说明书,检测每组细胞培养液中MDA 含量,用酶标仪在532 nm 处测定OD 值。
1.3 统计学方法
实验数据采用SPSS 20.0 统计软件进行分析。计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,进一步两两比较采用SNK-q检验,P≤0.05 为差异有统计学意义。
2 结果
2.1 高糖、高脂、高糖高脂及Nesfatin-1 干预对TM3 细胞存活率、抑制率的影响
CCK-8 测定结果表明,高糖组、高脂组和高糖高脂组在诱导12 h 和24 h 时细胞存活率均低于同时间对照组,抑制率高于同时间对照组(P均<0.05)。
高糖高脂+Nesfatin-1 干预组12 h 和24 h细胞存活率高于同时间高糖高脂组,抑制率低于同时间高糖高脂组(P均<0.05),因此,本研究选择高糖高脂组24 h 作为后续研究干预的最佳条件。见表1。
表1 不同时间高糖诱导小鼠TM3 细胞抑制率与存活率的变化(n=5,±s)
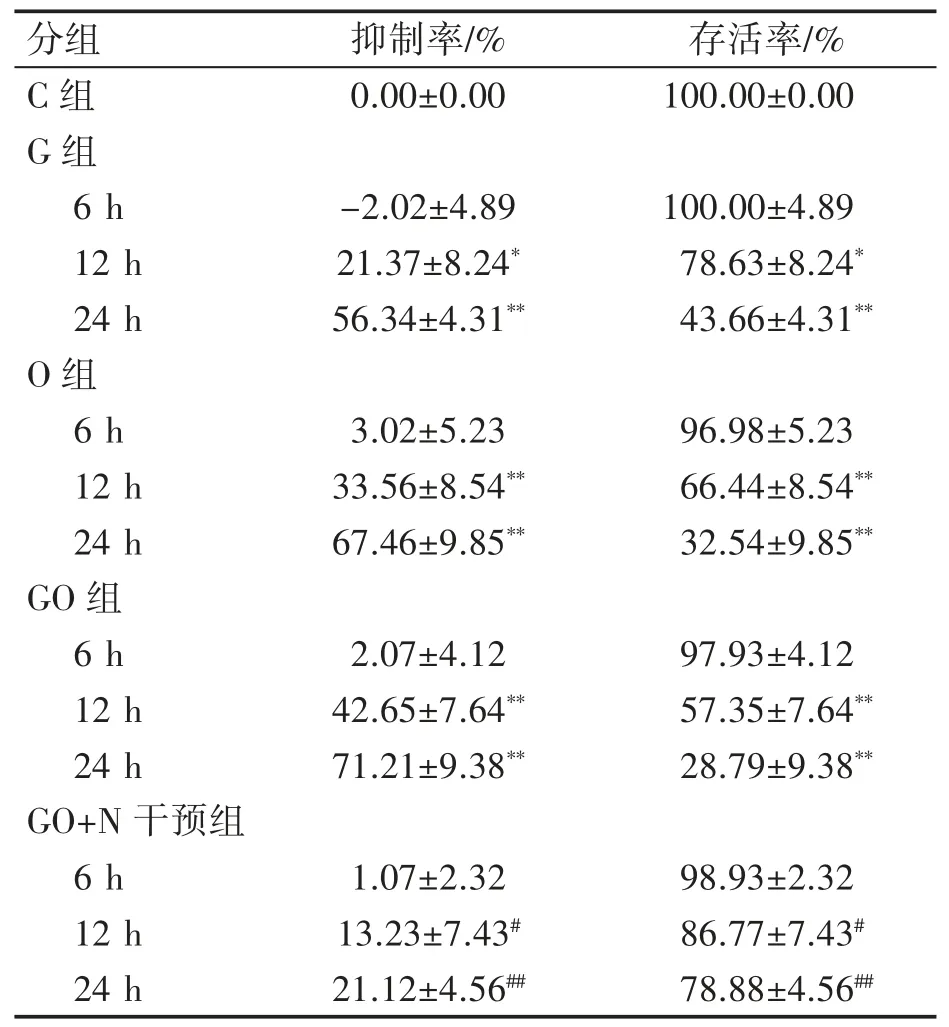
表1 不同时间高糖诱导小鼠TM3 细胞抑制率与存活率的变化(n=5,±s)
与C 组比较*P<0.05,**P<0.01;与GO 组比较#P<0.05,##P<0.01
分组 抑制率/% 存活率/%C 组 0.00±0.00 100.00±0.00 G 组6 h -2.02±4.89 100.00±4.89 12 h 21.37±8.24* 78.63±8.24*24 h 56.34±4.31** 43.66±4.31**O 组6 h 3.02±5.23 96.98±5.23 12 h 33.56±8.54** 66.44±8.54**24 h 67.46±9.85** 32.54±9.85**GO 组6 h 2.07±4.12 97.93±4.12 12 h 42.65±7.64** 57.35±7.64**24 h 71.21±9.38** 28.79±9.38**GO+N 干预组6 h 1.07±2.32 98.93±2.32 12 h 13.23±7.43# 86.77±7.43#24 h 21.12±4.56## 78.88±4.56##
2.2 高糖高脂对TM3 细胞SOD 的活性与MDA含量的影响
由表2 可见,与对照组比较,高糖、高脂和高糖高脂组TM3 细胞内SOD 活力降低,MDA 水平升高(P均<0.05)。与高糖高脂组比较,高糖高脂+Nesfatin-1 干预组的细胞内SOD 活力升高,MDA 含量降低(P均<0.05),说明10-8M Nesfatin-1 可使诱导24 h 高糖高脂模型组TM3 细胞的SOD 活性逆转上升,MDA 含量下降。
表2 高糖高脂诱导24hTM3 细胞对SOD 活性、MDA 含量的影响(n=5,±s)
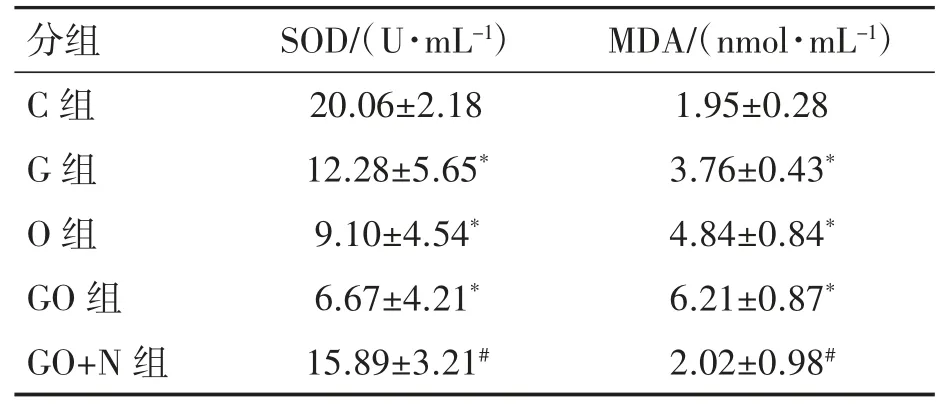
表2 高糖高脂诱导24hTM3 细胞对SOD 活性、MDA 含量的影响(n=5,±s)
与C 组比较*P<0.05,与GO 组比较#P<0.05
分组 SOD/(U·mL-1) MDA/(nmol·mL-1)C 组 20.06±2.18 1.95±0.28 G 组 12.28±5.65* 3.76±0.43*O 组 9.10±4.54* 4.84±0.84*GO 组 6.67±4.21* 6.21±0.87*GO+N 组 15.89±3.21# 2.02±0.98#
3 讨论
本研究结果显示,12 h 和24 h 后的高糖或高脂均抑制TM3 细胞的增殖,而高糖高脂同时处理TM3 细胞,可以最大程度上抑制其细胞增殖,并激活其氧化应激反应。SOD 是机体一种自由基酶中防御系统中的重要酶类,其具有清除超氧自由基的功能,并能间接地抑制其脂质过氧化作用以及其膜损害的功能,使细胞免受活性氧的氧化损伤[13]。MDA 是机体一种脂质过氧化的重要最终产物,并且其含量可有效地反映机体组织中脂质过氧化的强度及速率。在机体细胞的正常代谢过程中,细胞可以产生各种各样的活性氧(ROS),并且,细胞膜内外相应的各种抗氧化物质会清除掉多余的ROS,来保持机体内环境的生理平衡;然而,当ROS 产生过多或者抗氧化系统受到损害时,ROS 的产生及其清除出现了失衡,则就会引起细胞相应的氧化应激[14]。此研究的结果显示,与对照组比较,高糖高脂组细胞内SOD 的活力降低、MDA 的含量升高,经推测,其原因可能是,高糖高脂联合诱导能使机体内的氧自由基产生过多,可能消耗掉了大量的SOD,从而使SOD 的活力出现下降,同时抑制了其抗氧化酶的相应的活力,由此导致细胞的抗氧化能力下降,并且脂质过氧化反应的相应增强,产生了氧化应激损害。在此研究基础上,我们进一步研究Nesfatin-1 干预对高糖高脂诱导的TM3 细胞是否有抗应激损伤作用[16]。
Nesfatin-1 是近年来发现的一种新的胃肠多肽,在中枢下丘脑区域阳性表达,与机体神经内分泌功能紧密相关,参与调节下丘脑-垂体-性腺轴,影响生殖系统的发育及调控功能。在外周,除了在胃黏膜分泌外,Nesfatin-1 还在机体的胰腺、肝脏、外周脂肪组织、卵巢、睾丸等性腺中有阳性表达,且与很多激素类物质共区域共表达,与机体的代谢及生殖功能密切相关[9]。在前期高糖高脂干预细胞的基础上,发现高糖高脂同时处理TM3 细胞,可以最大程度上抑制其细胞增殖,并可能激活其氧化应激反应[9],故对高糖高脂联合组给予10-8M Nesfatin-1 进行干预。研究结果显示,与高糖高脂组比较,高糖高脂+Nesfatin-1 干预组可以明显上调TM3 细胞的存活率并上升其SOD 活性,降低MDA 含量,显示了其对高糖高脂造成的TM3 细胞损伤具有抗氧化应激的作用。后续,本课题组还将对Nesfatin-1 对高糖与高脂联合诱导组的干预作用进行更加深入的研究,从细胞线粒体损伤指标的测定和相关蛋白水平的测定、细胞周期及凋亡的检测的相关探讨,以便从多个方向、多个角度及多个水平对Nesfatin-1对高糖与高脂联合诱导损伤作用的机制进行更加深入的探究。
综上,高糖高脂可降低TM3 细胞细胞抗氧化能力,发生氧化应激。而Nesfatin-1 通过抗氧化应激作用逆转细胞损伤。
