小鼠卵巢玻璃化冻融过程中FSH 联合S1P 干预对血管内皮生长因子和缝隙连接蛋白表达的影响
2020-07-01杨延周俞晓丽王燕蓉裴秀英
田 媛, 杨延周, 秦 天, 俞晓丽, 王燕蓉, 裴秀英
(宁夏医科大学生育力保持教育部重点实验室,宁夏回族自治区生殖与遗传重点实验室,宁夏医科大学基础医学院生物化学与分子生物学学系,银川 750004)
卵巢冷冻及移植技术已经成为肿瘤生育领域研究的热点之一,并且也是保护青春期前女性生育功能的唯一途径。然而卵巢冻存过程的冷冻损伤、卵泡发育延迟及卵泡凋亡[1],移植后无血管吻合缺血缺氧的状态,造成大量卵泡的破坏损伤[2]。由垂体分泌的卵泡刺激素(FSH)主要促进卵泡发育及成熟。本课题组前期结果表明[3],卵巢玻璃化冻存过程中添加0.3 IU·mL-1FSH,可以提高血管生成相关因子表达,缩短卵巢移植后血流重建的时间,抑制卵泡闭锁。1-磷酸鞘氨醇(sphingosine-1-phosphate,S1P)是细胞膜鞘磷脂的代谢产物,调节细胞增殖分化、血管形成[4],可作为主要的血管生成刺激物[5-6],减少卵巢移植后缺血再灌注损伤从而提高卵子质量[7],并且2 μmol·L-1S1P 对冻融卵巢移植物原始卵泡的完整性有显著影响[8]。S1P 半衰期非常短,使其保护作用不能维持。有研究显示[5],FSH 上调卵巢S1P的生成,是否FSH 联合S1P 能更好地保护冻存卵巢结构与功能尚不清楚,本实验将以0.3 IU·mL-1FSH 及2 μmol·L-1S1P 为基础,通过不同浓度的FSH 联合2 μmol·L-1S1P 或0.3 IU·mL-1FSH 联合不同浓度的S1P 作用于小鼠卵巢玻璃化冻存过程,筛选FSH 联合S1P 的最适干预浓度,为保护冻融卵巢组织、提高卵巢移植后存活率提供科学依据。
1 材料与方法
1.1 材料与试剂
1.1.1 实验动物 选取21 日龄清洁级ICR 雌性小鼠,均购自宁夏医科大学实验动物中心[许可证号:SCXK(宁)2015-0001],光照时间周期为12 h照明/12 h 黑暗,动物室室温保持在(24±2)℃,湿度保持在40%~50%,并定期更换鼠笼、水粮、垫料并消毒。
1.1.2 主要试剂 注射用重组人促卵泡刺激素(rhFSH,默克雪兰诺-果纳芬),1-磷酸鞘氨醇(S1P)(sigma-S9666),牛血清白蛋白(纯度≥96%)(Sigma A1933),DMSO(MP Biomedicals-196055),DeadEndTMFluorometric TUNEL 检测试剂盒(Promega-G3250),DAPI 溶液(Solarbio -C0065),DAB(中杉金桥ZLI-9018),VEGF 兔多克隆抗体(abcam-ab46154),VEGFR-2 兔多克隆抗体(abcam-ab39256),CX43 兔多克隆抗体(abcam-ab11 370),CX37 兔多克隆抗体(abcam-ab181701),二抗为山羊抗兔IgG(中杉金桥ZB-2301)。
1.2 实验方法
1.2.1 液体的配制 基础培养液:DMEM/F-12培养基+1%青霉素-链霉素+1% DMSO;培养液:含10 % BSA 牛血清白蛋白的基液;预平衡液:20 % BSA+1.5 mol·L-1乙二醇(EG)的基液;玻璃化液:20 % BSA+0.5 mol·L-1蔗糖+30 %聚蔗糖(Ficoll)+5.5 mol·L-1EG 的基液;解冻液为浓度分别是0.5、0.25、0.125 mol·L-1的蔗糖溶液。
1.2.2 卵巢的获取 将21 日龄ICR 雌性小鼠称重,按体质量(25 g/kg)腹腔注射1 %戊巴比妥钠麻醉,颈椎脱臼处死。用75 %酒精棉擦拭背部,剪开小鼠背部皮肤及背膜,剥离卵巢。
1.2.3 实验分组 将21 日龄ICR 小鼠卵巢分为13 组:A(新鲜组):新鲜21 日龄ICR 雌鼠卵巢;B(冻存组):冻融过程不添加FSH 或S1P;C(0.3 IU·mL-1FSH 干预玻璃化冻融组);D(2 μmol·L-1S1P 干预玻璃化冻融组);E 为不同浓度FSH(E1:0.3 IU·mL-1FSH;E2:1 IU·mL-1FSH;E3:0.5 IU·mL-1FSH;E4:0.2 IU·mL-1FSH;E5:0.1 IU·mL-1FSH)+2 μmol·L-1S1P 组;F 为不同浓度S1P(F1:4 μmol·L-1S1P;F2:10 μmol·L-1S1P;F3:20 μmol·L-1S1P;F4:40 μmol·L-1S1P)+0.3 IU·mL-1FSH 组。
1.2.4 玻璃化冻存及解冻过程 将卵巢置于37 ℃CO2培养箱内预热的培养液中培养60 min,预平衡液中7 min,玻璃化液3 min,后迅速投入-196 ℃的液氮罐中保存。冻存至少3 d 以上,将卵巢从液氮中取出,置于37 ℃CO2培养箱内预热的0.5、0.25、0.125 mol·L-1蔗糖解冻液中各10 min,后入培养液培养2 h(全程置于37℃的培养箱中)。培养液、预渗透平衡液、玻璃化冻存液及解冻液中的FSH 及S1P 浓度依分组而不同。
1.2.5 组织切片及卵泡计数 卵巢解冻后经4%多聚甲醛固定18~24 h,石蜡连续切片(5 μm),每隔5 张切片选取1 张切片HE 染色,高倍镜下选取5 个视野,形态正常卵泡的评估基于卵母细胞及基底膜的完整性、颗粒细胞层的整齐排列、是否核固缩。卵泡计数标准:①原始卵泡为外周单层扁平的颗粒细胞包裹卵母细胞;②初级卵泡为单层立方颗粒细胞包裹卵母细胞并出现透明带;③次级卵泡和成熟卵泡为多层立方颗粒细胞围绕卵母细胞;④闭锁卵泡为卵母细胞退化,细胞核固缩,颗粒细胞层数减少逐渐趋向纤维化。卵泡总数为正常卵泡+闭锁卵泡,各级卵泡百分比=各级卵泡总数/卵泡总数。
1.2.6 TUNEL 检测凋亡 石蜡切片脱蜡脱水放置0.85% NaCl 中5 min,PBS 清洗;4%多聚甲醛固定15 min,PBS 清洗3 次,5 min/次;入用PBS按1∶500 将蛋白酶K 储液(10 mg·mL-1)稀释成20 μg·mL-1的工作液室温孵育8~10 min 后,PBS清洗3 次,5 min/次;4%多聚甲醛再次固定5 min,PBS 清洗3 次,5 min/次;Equilibration Buffer 室温平衡5~10 min;rTdT 缓冲液避光37 ℃孵育60 min;将去离子水按1∶10 将20×SSC 稀释,室温孵育15 min 后,PBS 清洗3 次,5 min/次;2 μg·mL-1DAPI染色5~15 min 后,PBS 清洗3 次,5 min/次;抗荧光淬灭剂封片,Leica 荧光显微镜蓝光激发拍照。
1.2.7 免疫组化 石蜡切片脱蜡脱水,PBS 清洗3 次,5 min/次,入枸橼酸钠缓冲液,微波修复两次,每次15 min,PBS 清洗3 次,5 min/次;3% H2O2避光孵育10 min 以消除内源性过氧化物酶,PBS清洗3 次,5 min/次;10%山羊血清封闭30 min;将VEGF 抗体(1∶250)、VEGFR-2(1∶250)、CX43(1∶500)、CX37(1∶500)稀释后滴加在组织上,阴性对照(Negatire Control,NC)组用PBS 代替,4 ℃孵育过夜,PBS 清洗3 次,5 min/次;将山羊抗兔IgG /HRP 二抗按(1∶200)稀释后滴加在组织上,37 ℃孵育60~120 min,PBS 清洗3 次,5 min/次;DAB 染色,显微镜下观察着棕黄色,入水终止反应;苏木素复染后脱水、透明并封片;用DP Ctroller 3.1.1.267 图像采集系统明场拍照,Image Pro Plus 6.0 图像全自动分析系统软件计算组织面积(Area)和阳性染色累积光密度(IOD),以平均光密度(IOD/Area)为蛋白表达量,进行分析。
1.3 统计学方法
数据采用SPSS 17.0 软件进行统计分析,计量资料以均数±标准差(±s)表示,组间比较采用单因素方差分析,P≤0.05 为差异有统计学意义。
2 结果
2.1 卵巢形态检测及卵泡计数
冻存组较新鲜组相比,颗粒细胞分散,间质疏松,有核固缩现象;添加FSH 与S1P 后,与冻存组相比,卵巢结构排列整齐且较致密,卵母细胞完整性较好。见图1。
冻存组闭锁卵泡数高于新鲜组(P<0.01),除0.1IU·mL-1FSH+2 μmol·L-1S1P 组及0.3IU·mL-1FSH+4、10 μmol·L-1S1P 组,其余各组闭锁卵泡数目均少于冻存组(P均<0.05);与新鲜组相比,过高浓度的1 IU·mL-1FSH+2 μmol·L-1S1P 组及0.3 IU·mL-1FSH+40 μmol·L-1S1P 组中原始卵泡数目减少(P均<0.05),且0.3 IU·mL-1FSH+40 μmol·L-1S1P组闭锁卵泡数高于新鲜组(P<0.05),卵泡趋向成熟;初级、次级和成熟卵泡各组之间差异无统计学意义(P均>0.05)。见表1。
表1 卵巢冻存过程添加FSH 与S1P 对各级卵泡百分比的影响(±s,%)
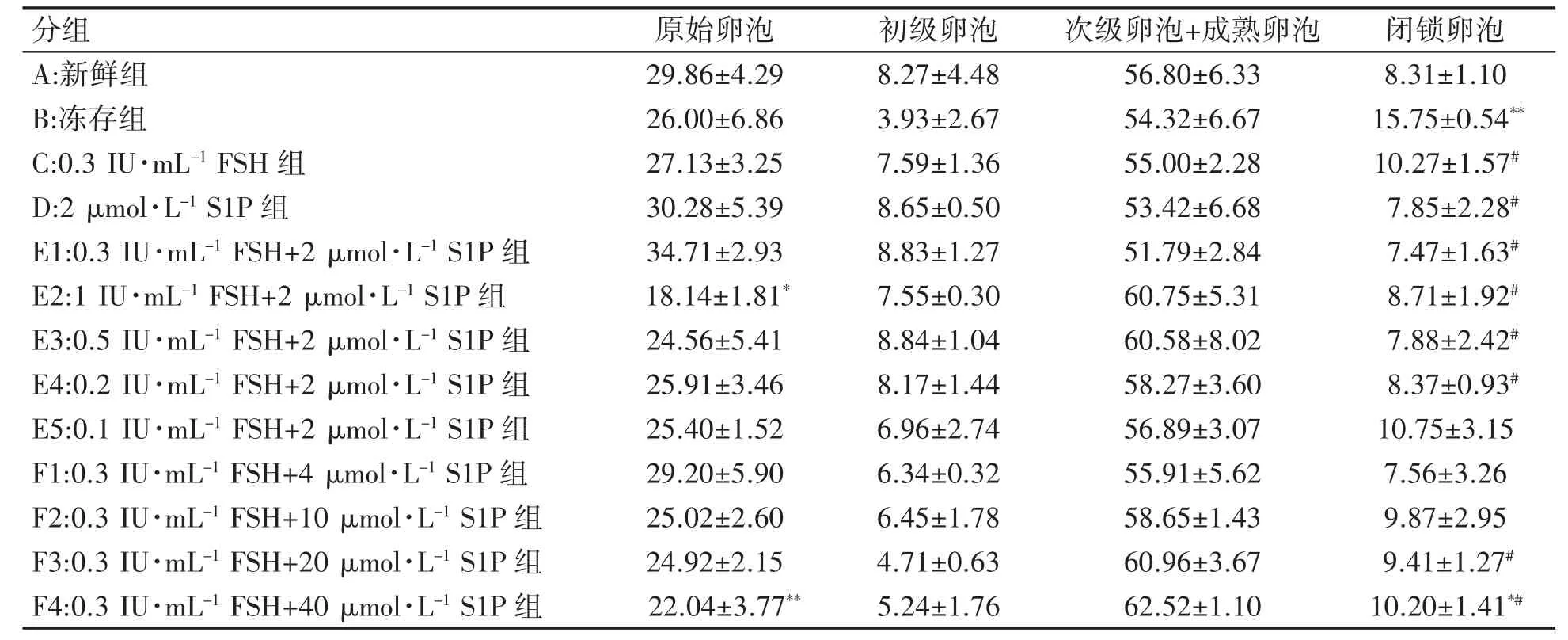
表1 卵巢冻存过程添加FSH 与S1P 对各级卵泡百分比的影响(±s,%)
与新鲜组比较*P<0.05,**P<0.01;与冻存组比较#P<0.05
分组 原始卵泡 初级卵泡 次级卵泡+成熟卵泡 闭锁卵泡A:新鲜组 29.86±4.29 8.27±4.48 56.80±6.33 8.31±1.10 B:冻存组 26.00±6.86 3.93±2.67 54.32±6.67 15.75±0.54**C:0.3 IU·mL-1 FSH 组 27.13±3.25 7.59±1.36 55.00±2.28 10.27±1.57#D:2 μmol·L-1 S1P 组 30.28±5.39 8.65±0.50 53.42±6.68 7.85±2.28#E1:0.3 IU·mL-1 FSH+2 μmol·L-1 S1P 组 34.71±2.93 8.83±1.27 51.79±2.84 7.47±1.63#E2:1 IU·mL-1 FSH+2 μmol·L-1 S1P 组 18.14±1.81* 7.55±0.30 60.75±5.31 8.71±1.92#E3:0.5 IU·mL-1 FSH+2 μmol·L-1 S1P 组 24.56±5.41 8.84±1.04 60.58±8.02 7.88±2.42#E4:0.2 IU·mL-1 FSH+2 μmol·L-1 S1P 组 25.91±3.46 8.17±1.44 58.27±3.60 8.37±0.93#E5:0.1 IU·mL-1 FSH+2 μmol·L-1 S1P 组 25.40±1.52 6.96±2.74 56.89±3.07 10.75±3.15 F1:0.3 IU·mL-1 FSH+4 μmol·L-1 S1P 组 29.20±5.90 6.34±0.32 55.91±5.62 7.56±3.26 F2:0.3 IU·mL-1 FSH+10 μmol·L-1 S1P 组 25.02±2.60 6.45±1.78 58.65±1.43 9.87±2.95 F3:0.3 IU·mL-1 FSH+20 μmol·L-1 S1P 组 24.92±2.15 4.71±0.63 60.96±3.67 9.41±1.27#F4:0.3 IU·mL-1 FSH+40 μmol·L-1 S1P 组 22.04±3.77** 5.24±1.76 62.52±1.10 10.20±1.41*#
2.2 TUNEL 检测卵巢凋亡
冻存组卵巢凋亡率高于新鲜组(P<0.05),添加FSH 及S1P 后的各组凋亡率均低于冻存组(P均<0.05),0.1U·mL-1FSH+2 μmol·L-1组凋亡率高于新鲜组(P<0.05)。见图2。
2.3 免疫组织化学检测VEGF、VEGFR-2、CX43、CX37 蛋白表达
VEGF 主要表达于卵母细胞、颗粒细胞及细胞浆中,冻存组、0.3 IU·mL-1FSH+40 μmol·L-1SIP组VEGF 表达低于新鲜组(P<0.05);除0.5、0.1 IU·mL-1FSH+2 μmol·L-1S1P 组、0.3 IU·mL-1FSH+40 μmol·L-1S1P 组,其余各组VEGF 蛋白表达高于冻存组(P均<0.05)。VEGFR-2 主要表达于卵母细胞及颗粒细胞中,2 μmol·L-1S1P 组、0.3 IU·mL-1FSH+10、40 μmol·L-1S1P 组的VEGFR-2表达高于冻存组(P均<0.05)。CX43 主要表达于颗粒细胞中,0.3、0.5、0.2 IU·mL-1FSH+2 μmol·L-1S1P 组及0.3 IU·mL-1FSH+4、20 μmol·L-1S1P组CX43 蛋白表达均高于冻存组(P均<0.05)。CX37 主要表达于卵母细胞和颗粒细胞中,冻存组及0.5、0.2、0.1 IU·mL-1FSH+2 μmol·L-1S1P 组CX37 表达均低于新鲜组,除0.3 IU·mL-1FSH+40 μmol·L-1S1P 组,其余各组CX37 蛋白表达均高于冻存组(P均<0.05)。见图3~7。
3 讨论
迄今为止,通过卵巢组织冷冻保存技术(OTC)全世界已经出生了130 多个健康婴儿,并且几乎所有患者在组织移植后都恢复了卵巢功能[9]。但是冻存引起的颗粒细胞凋亡导致卵泡发育停滞[10],移植后的缺血再灌注损伤会导致原始卵泡的丢失[2]。因此卵巢玻璃化中减少细胞凋亡、增加的血管生成是亟待解决的问题。研究显示在冷冻过程中添加褪黑素[11]、GnRHa[12]、FSH[3]、S1P[7,13-14]、血管生成因子-2[15]、Setarud[16]、抗冻蛋白[17]等能提高卵巢皮质移植后的血管形成及卵泡存活率。FSH 作为卵巢卵泡生成的关键,对女性生育能力至关重要,它通过与颗粒细胞中的FSH 受体(FSHR)结合,来诱导卵泡分化和生长,以及促进雌二醇的生成[18-19]。然而过高的FSH 会刺激原始卵泡过度发育,从而加速卵泡池消耗[20]。S1P 是一种生物活性脂质,可以促进细胞增殖并提高细胞存活率,保护原始卵泡免受化疗引起的死亡,保留部分卵巢功能[5,21-22]。但由于S1P 半衰期极短,使其保护卵巢的作用并不能持续[14],并且高剂量的S1P 致使颗粒细胞凋亡进而诱发卵泡闭锁[14],因此适量的FSH 或S1P 浓度是卵泡存活所必需的。
本研究细胞形态学检测发现:冻存组较新鲜组相比,颗粒细胞、间质松散,甚至出现核固缩,冻存效果不佳;在添加FSH 与S1P 后,与冻存组相比,卵巢结构排列整齐且较致密,卵母细胞完整性较好,卵巢在形态上得到较好的保护;闭锁卵泡数冻存组高于新鲜组,除0.1 IU·mL-1FSH+2 μmol·L-1S1P 组及0.3 IU·mL-1FSH+4、10 μmol·L-1S1P组,其余各组闭锁卵泡数目均低于冻存组。同样,TUNEL 荧光显示,冻存组卵巢颗粒细胞凋亡率高于新鲜组,在添加FSH 及S1P 后的各组与冻存组相比,均有效抑制了卵巢颗粒细胞的凋亡。这两个检测说明卵泡正常结构得到保护。与新鲜组相比,高浓度的1 IU·mL-1FSH+2 μmol·L-1S1P 组及0.3 IU·mL-1FSH+40 μmol·L-1S1P 组中,原始卵泡数目减少,高浓度的FSH 与S1P 联合使用会导致卵巢发育提前,降低原始卵泡的储备数量,不利于卵巢冻存保护。
卵巢中血管生成受诸多因素调节,卵巢卵泡和黄体中血管生成的主要调节因子是VEGF。本实验中VEGF 在冻存组中表达低于新鲜组,除0.5、0.1 IU·mL-1FSH+2 μmol·L-1S1P 组、0.3 IU·mL-1FSH+40 μmol·L-1S1P 组,其余各组VEGF 蛋白表达较冻存组均有所增加。2 μmol·L-1S1P 组、0.3 IU·mL-1FSH+10、40 μmol·L-1S1P 组的VEGFR-2 表达均高于冻存组,提示适宜浓度的FSH有益于VEGF 的表达,S1P 有益于VEGFR-2 的表达。CX43、CX37基因同是缝隙连接蛋白基因家族的成员,它们编码的蛋白质是间隙连接的组成部分,这些蛋白质组成的通道为低分子量的物质在细胞间的扩散提供了途径,并在胚胎发育中起着至关重要的作用。CX43 蛋白主要表达于颗粒细胞,主要功能是促进颗粒细胞间细胞通讯功能的实现,是卵子发生的必备条件[23-24],而CX43基因敲除后的小鼠,卵泡生长受到限制颗粒细胞增殖受损[25]。CX37 蛋白主要表达在卵母细胞和颗粒细胞中,它在颗粒细胞与卵母细胞信息交流中发挥关键作用[24]。研究表明,在卵母细胞中的基因表达随着卵巢中卵泡数量的增加而表达增加[26]。本实验中干预组缝隙连接蛋白较冻存组的表达高:0.3、0.5、0.2 IU·mL-1FSH+2 μmol·L-1S1P 组及0.3 IU·mL-1FSH+4、20 μmol·L-1S1P 组CX43蛋白表达均高于冻存组。除0.3 IU·mL-1FSH+40 μmol·L-1S1P 组,其余各组CX37 蛋白表达均高于冻存组。提示过高或过低的FSH 不利于CX43的表达,而在浓度为2~20 μmol·L-1的范畴内S1P可有效促进玻璃化冻存卵巢细胞CX37 的表达。
综上所述,本实验通过细胞形态学检测与冻融后功能检测都证明了0.3 IU·mL-1FSH+2 μmol·L-1S1P 组联合干预对卵巢冻存复苏后的卵泡结构保存及功能蛋白的表达有较好效果,这些结果为提高冻融卵巢内卵泡的存活及血管生成提供了新的思路,其相关机制尚待进一步研究。
