雷公藤多苷抑制睾丸支持细胞增殖及其相关机制研究
2020-07-01张丹阳王宇欣李一田崔瑞琴
张丹阳, 王宇欣, 李一田, 王 璐, 崔瑞琴,2
(1.宁夏医科大学中医学院,银川 750004; 2.生育力保持教育部重点实验室,银川 750004)
雷公藤多苷(tripterygium wilfordii glycosides,GTW)是从植物雷公藤的根、茎中提取的总苷,具有肯定的降尿蛋白功效,曾经是儿童紫癜性肾炎的常规治疗药物,治疗效果较好,如钟娇霞等[1]临床研究发现:雷公藤多苷联合丙种球蛋白治疗儿童过敏性紫癜性肾炎效果优于单纯注射丙种球蛋白。然而近年来因其毒副作用被限制临床应用,如GTW 产生的生殖副作用令众多患儿家长担忧——导致患儿成年后的不孕或不育,所以目前诸多学者着眼于减少GTW 毒副作用的机制研究。为减轻GTW 的生殖毒副作用,更好地发挥其疗效,因此本研究在前期GTW 生殖损伤机制研究基础上探讨GTW 对睾丸支持细胞(Sertoli Cell,SC)增殖的影响,以期为GTW 安全用药提供理论依据。
1 材料与方法
1.1 实验动物与细胞来源
SD 雄性大鼠36 只,SPF 级,体质量180~220 g,购于宁夏医科大学实验动物中心,饲养于SPF 级动物房饲养。小鼠SC 获赠于生育力保持教育部重点实验室。
1.2 实验材料
雷公藤多苷片(江苏美通制药有限公司,批号:180102);补肾益精丸(厦门中药厂,批号:171001);羧甲基纤维素钠、DEME 培养基、青链霉素、胎牛血清(GIBCO 公司);胰蛋白酶(索莱宝科技有限公司);MTT 细胞增殖与细胞毒性试剂盒、细胞周期检测试剂盒、全蛋白提取试剂盒、BCA 蛋白含量检测试剂盒(凯基生物技术股份有限公司);Caspase-9 兔一抗、Caspase-3 兔一抗(Bioss 公司);山羊抗兔二抗(Abbkine 公司);Western Blot ECL(advansta 公司)。
1.3 细胞与含药血清共培养实验方法
1.3.1 制备含药血清 将适应喂养后的SD 大鼠按体质量随机分为无药血清组、GTW 组、补肾中药组,每组12 只,均灌胃,1 次/d,连续7 d。无药血清组予0.5%羧甲基纤维素钠溶液,GTW 组予雷公藤多苷混悬液0.9 mg/0.5 mL(将GTW 生药磨碎溶于0.5%羧甲基纤维素钠溶液中),补肾中药组予补肾益精丸溶液0.15 g/0.5 mL(将补肾益精丸生药磨碎溶于0.5%羧甲基纤维素钠溶液中)。依据各自的临床常规用量换算得出的给药剂量,给药容积均为0.5 mL/100 g。末次给药2 h 后,经心脏取血,静置,离心,取血清。56 ℃灭活备用。
1.3.2 细胞培养与药物干预方法 用含10%胎牛血清+1%青链霉素的DMEM 培养基培养小鼠睾丸支持细胞。待细胞铺满培养皿80%时用胰蛋白酶消化,按1∶3 比例传代至对数生长期,分为无药血清组(只加入无药血清)、GTW 组(只加入GTW 含药血清)和GTW+补肾中药组(加入GTW含药血清与补肾中药含药血清各半进行联合用药),开始干预实验。
1.4 指标检测方法
1.4.1 SC 增殖率 将对数生长期的细胞消化,用FBS 液终止消化;离心,重悬,计数。调整浓度到2×104mL-1接种于96 孔培养板中,并分组,每组6 个复孔,每孔加入细胞悬液200 μL,继续培养24 h 后弃上清,开始药物观察阶段的实验。无药血清组加入含20%无药血清组的培养液,GTW组添加含GTW 含药血清的培养液,补肾中药组添加GTW 含药血清及补肾中药含药血清各半的培养液,均为200 μL/孔。增加调零孔,余者用PBS 填充。混匀,放入培养箱继续培养。于24、48 h 各取一板,去上清,加入1xMTT 溶液50 μL后置CO2培养箱中,孵育4 h;然后再次弃上清,避光加入150 μL DMSO,振荡10 min。用酶标仪检测(490 nm 处)OD 值,并计算细胞增殖率。
1.4.2 细胞周期观测 取对数生长期细胞按1×106mL-1密度接种于六孔板中,培养24 h 后分组。分组同前。各自加入相应培养液后继续孵育12 h。取出,用胰酶消化,完全培养基终止消化。离心5 min 弃上清,用PBS 吹打混匀;再次离心3 min 弃上清,加入1 mL PBS 重悬;再离心3 min弃上清,加入500 μL 预冷的70%乙醇,4 ℃固定3 h。之后,将细胞离心5 min,弃上清,用PBS 冲洗冷乙醇;再次离心3 min 弃上清。离心速度均为1000 r·min-1。最后加入500 μL PI∶RNaseA 为9∶1 的染色液,避光,室温染色1 h。将离心管内的细胞经300 目滤膜过滤后在流式细胞仪上分析结果。
1.4.3 SC 总蛋白的提取及测定 含药血清与各组细胞共培养12 h 后,消化,经PBS 洗2 遍;离心,弃上清后转入新预冷的离心管;在冰上加入Lysis Buffer 180 μL,静置10 min 后震荡3 min。连续4 次。4 ℃离心机离心10 min,取上清液,即为全蛋白提取物。取酶标板一块,将配制完成的BCA 工作液与蛋白提取物混合在酶标仪中检测,绘制标准曲线,计算细胞总蛋白浓度。
1.4.4 Caspase-9、Caspase-3 蛋白测定 事先配制浓度均为10%的分离胶与浓缩胶,待胶凝固后安装装置并加入各组蛋白样品及内参(β-actin),在120 v、300 mA 条件下跑胶1.5 h,取下凝胶,切去积层胶和含溴酚蓝部分并标记左上角,制作“三明治夹心”;再加入转膜液电转45 min;将蛋白转移到PVDF 膜上用TBST 洗过后放入5%脱脂牛奶中封闭1 h;加入一抗,4 ℃过夜。次日复温1 h,TBST 再洗膜3 次,每次5 min;接下来加入二抗,室温反应1 h;继用TBST 洗膜4 次,每次10 min;混合等体积的ECL 发光液,并与PVDF 膜共孵育1 min。最终在化学发光成像仪上显影,分析灰度值来获取结果。
1.5 统计学方法
数据运用SPSS 23.0 软件进行统计学分析。符合正态分布且方差齐性计量资料用均数±标准差(±s)表示,组间比较采用单因素方差分析,多重比较采用LSD-t法检验。P≤0.05 为差异有统计学意义。
2 结果
2.1 细胞生长状态观察
加入血清24 h 后,无药血清组的细胞呈梭型,分布密集,见有圆形细胞核,长势良好。GTW组的细胞大小不规整,分布不均匀,视野中可见到漂浮的死亡细胞。补肾中药组的细胞较GTW组的细胞生长态势良好,分布均匀。
2.2 含药血清对SC 增殖率的影响
与无药血清组相比,GTW 组24、48 h SC 增殖率降低(P均<0.05),补肾中药组SC 增殖率差异无统计学意义(P>0.05)。与GTW 组相比,补肾中药组24、48 h SC 增殖率增高(P均<0.05)。见表1。
表1 含药血清对SC 增殖率的影响(±s)
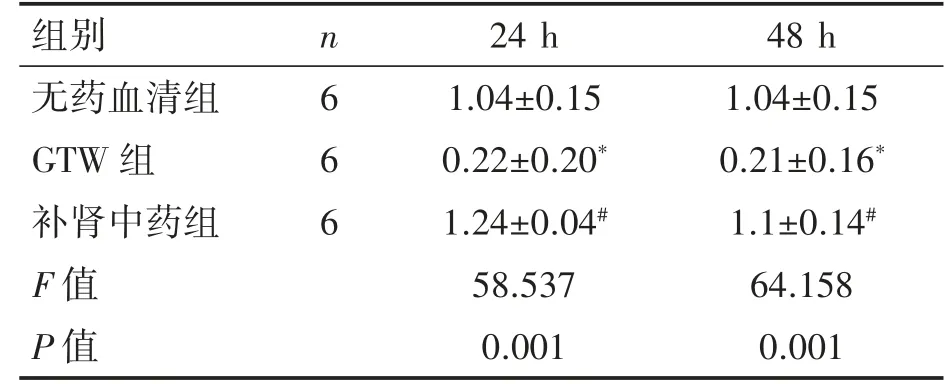
表1 含药血清对SC 增殖率的影响(±s)
与无药血清组相比*P<0.05;与GTW 组相比 #P<0.05
组别 n 24 h 48 h无药血清组 6 1.04±0.15 1.04±0.15 GTW 组 6 0.22±0.20* 0.21±0.16*补肾中药组 6 1.24±0.04# 1.1±0.14#F 值 58.537 64.158 P 值 0.001 0.001
2.3 含药血清对睾丸支持细胞周期的影响
取与含药血清共培养12 h 的SC,在流式细胞仪中测定细胞各周期的细胞数(图1)。结果显示: 与无药血清组比较,GTW 组G1 期细胞占比多,S 期占比少(P均<0.05);补肾中药组G1 期、S期细胞占比差异无统计学意义(P>0.05)。与GTW组相比,补肾中药组G1 期细胞占比减少,S 期细胞占比增多(P均<0.05)。见图1。
2.4 含药血清对Caspase-9、Caspase-3 蛋白的影响
与无药血清组相比,GTW 组Caspase-9 及Caspase-3 蛋白相对表达量增高(P<0.05);补肾中药组Caspase-9 及Caspase-3 蛋白相对表达量差异无统计学意义(P>0.05)。与GTW 组相比,补肾中药组Caspase-9 及Caspase-3 蛋白相对表达量减少(P均<0.05)。见图2。
3 讨论
中医认为肾为先天之本,藏精,主生殖。肾所藏之精既有先天之精也有后天之精。《黄帝内经·灵枢》:“人始生,先成精”,说明肾精是推动人体生长发育的重要因素[2]。肾精有广义之精与狭义之精之不同,精子乃狭义之精。精子的生成和成熟依赖肾阴的濡养与肾阳的温煦。现代研究证实,男性的精子是精原干细胞经逐步分化、成熟而成,但精原干细胞的体外培养极其困难,需要有共培养体系的支撑[3]。SC 作为睾丸内最重要的生殖细胞之一,可为精原干细胞的生存及分化出的生精细胞提供支架功能,同时还分泌大量蛋白质参与各项物质交换,也可发挥其吞噬胞饮作用,清除凋亡的生精细胞[4]。正是它为生精细胞提供生长发育的环境,因此,SC 又被称为生精细胞的保姆细胞(nursing cell)。故此,很多研究者选择以观察SC 来间接探索精原干细胞的增殖分化或者损伤机制,如郑垂木等[5]体外培养SC 并使用三氯生染毒,结果显示:三氯生可影响SC 的增殖能力、细胞形态,从而证明三氯生对SC 的直接毒性可能影响精子发育过程。秦茂等[6]研究结果显示:中药五子衍宗丸可通过上调支持细胞骨架蛋白的表达,抑制各级生精细胞凋亡进而改善精子的生长发育。而补肾中药可以通过调整肾气、肾精的状态来影响精原干细胞及各级生精细胞的分化成熟进程。
GTW 可用于治疗风湿性关节炎、红斑狼疮等一系列自身免疫性疾病,效果肯定的同时也时常见到多种脏器的功能损伤反应,比如可产生一定的、可逆的抗生育作用[7]。关于GTW 的生殖损伤机制研究对临床安全用药具有重要的意义。针对GTW 的生殖功能损伤效应的研究报道很多。现有文献显示,相关研究内容已经从现象观察进入到损伤机制与损伤靶点的探索领域。胡莹莹等[8]用30 mg·(kg·d)-1GTW 对雄性SD 大鼠进行6 周动物实验,发现存在精子质量差,生精上皮和生精小管变薄、萎缩,各级生精细胞几乎全部缺失,几乎未见成熟精子的病理改变。樊媛芳等[9]发现给药21 d 时临床等倍剂量的雷公藤多苷片可造成Ⅱ型胶原诱导性关节炎模型大鼠的生殖损伤;且随着时间和剂量的增加损伤程度也逐渐增强。郭健敏等[10]观察雷公藤多苷对雄性SD 大鼠青春期至性成熟期的生殖损伤机制,发现不同剂量雷公藤多苷组较正常对照组具有影响大鼠生精功能和精子发育形态,长期给药损伤加重且无法恢复。GTW 对SC 的研究鲜少报道,故此,本研究在以往GTW 的生殖损伤研究基础上,探索其对SC 增殖分化的影响,希望以此结果推测GTW 对精原干细胞分化成熟的影响机制。
本实验结果发现,与无药血清组相比,GTW组细胞在G1 期的细胞数量占比增加,S 期的细胞数量占比降低;而与GTW 组相比,补肾中药组G1 期细胞数量占比降低,S 期细胞占比增多。中药组由于是GTW 含药血清与补肾中药含药血清联合培养,故推测补肾中药“补肾益精丸”可以修复由GTW 导致的SC 凋亡。据此分析,GTW 是通过对细胞的G1 期和S 期产生影响来发挥生殖损伤作用——阻碍支持细胞的增殖、抑制细胞的分裂。而补肾中药是在S 期发挥对细胞DNA的合成产生促进作用,降低GTW 致SC 阻滞在G1 期的问题,从而抑制了GTW 对支持细胞的生殖损伤作用。这一点也得到了同期实验另一结果的佐证,即在24 h 与48 h 的MTT 结果中,GTW组SC 增殖率低于补肾中药组,提示GTW 对SC的增殖存在抑制作用,而补肾中药可以拮抗GTW 的这种损伤效应,分析原因是补肾填精中药使虚损的肾气得以充实从而修复了肾脏的主生殖功能。
本研究结果显示,GTW 组Caspase-9、Caspase-3 的表达在GTW 组升高,提示GTW 对SC的凋亡具有促进效应,推测其作用机制是上调了Caspase-9 表达,引起Caspase-3 启动级联瀑布反应从而引起凋亡蛋白过表达加速了SC 的凋亡进程,最终表现出生殖损伤作用,而补肾中药可以抑制该损伤作用。
综上所述,本研究通过对SC 的细胞周期、细胞形态、细胞增殖、细胞凋亡四个维度的研究,证实了GTW 产生生殖损伤的可能机制之一是抑制了SC 增殖,从而促进其凋亡,同时也证实了补肾中药可以抑制GTW 的损伤进程。据此证实,GTW 的生殖损伤作用具有可逆性和可修复性。
