环氧树脂/有机脲体系的固化反应动力学
2020-06-30高菁菁张晓雅王炳强蔡计杰胡和丰
高菁菁,张晓雅,朱 康,王炳强,蔡计杰,孙 昊,孙 莺*,胡和丰
(1. 上海大学 材料科学与工程学院,上海市 200444;2. 上海晋飞碳纤科技股份有限公司,上海市 201306)
环氧树脂的潜伏性固化在实际应用中越来越重要,有机脲是一种性能优异的潜伏性固化促进剂,目前的研究主要集中于有机脲对环氧树脂的固化促进作用[1-4]。有机脲单独用作环氧树脂固化剂的研究较少[5-6],特别是对于有机脲固化环氧树脂的机理鲜有研究。本工作研究了环氧树脂/有机脲体系的固化机理,并采用差示扫描量热法(DSC)研究了环氧树脂E20与有机脲的固化反应动力学,推导了环氧树脂与有机脲固化反应的动力学方程,计算了反应初期和中期的表观活化能。
1 实验部分
1.1 主要原料与仪器
环氧树脂E20,环氧值0.2,美国陶氏化学公司。N,N″-(4-甲基-1,3-亚苯基)双(N′,N′-二甲基脲) UR500,纯度95%;3-苯基-1,1-二甲基脲UR300,纯度98%:德国赢创工业集团。TA Q2000型差示扫描量热仪,美国TA仪器公司生产。
1.2 实验方法
将环氧树脂与有机脲按质量比10∶1混合,用玛瑙研钵研细,得到混合物。E20/UR500体系做非等温DSC测试,温度为室温~260 ℃,升温速率为10 ℃/min;E20/UR500体系分别在125,130,135,140,145 ℃做等温DSC测试,E20/UR300体系分别在170,175,180,185,190 ℃做等温DSC测试,均为氮气氛围,流量50 mL/min。
2 结果与讨论
2.1 非等温DSC曲线
从图1看出:112 ℃以下无热效应,放热从112℃开始,放热峰峰温为150 ℃,说明该体系在较低温度时具有良好的稳定性,在112~150 ℃能有效固化,有机脲适合作为环氧树脂潜伏性固化剂。
2.2 环氧树脂/有机脲体系的转化率与时间的关系曲线
环氧树脂固化是放热反应,环氧基的转化率与放热量成正比[7],转化率按α=ΔHt/ΔH0计算,其中,α为转化率;ΔHt为t时刻的放热量;ΔH0为总放热量。反应速率按dα/dt=(1/ΔH0)·dH/dt计算,其中,H为热焓,即反应速率与热流率成正比。两种环氧树脂/有机脲体系在不同温度条件下的等温固化DSC曲线见图2。通过DSC曲线的积分值得到转化率与时间的关系曲线,见图3。从图2和图3看出:温度较低时,采集到的DSC曲线较为完整,转化率与时间的关系曲线较平缓,说明反应温度越高,反应速率越快。
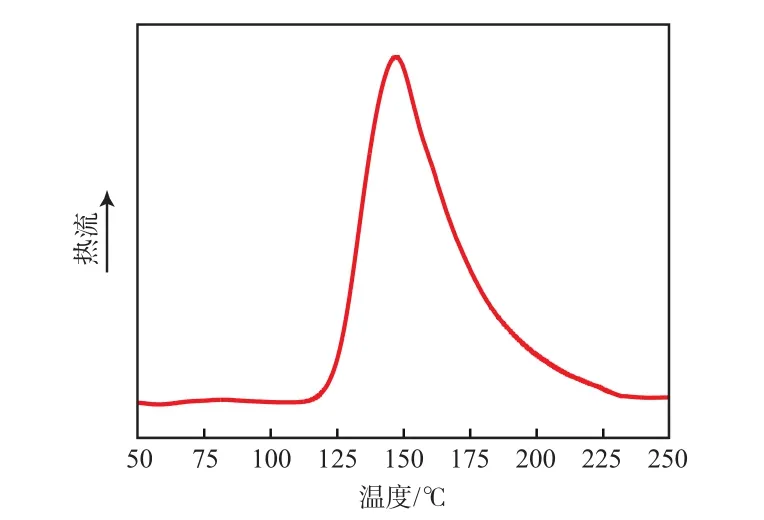
图1 E20/UR500体系的非等温DSC曲线Fig.1 Non-isothermal DSC curve of E20/UR500 system
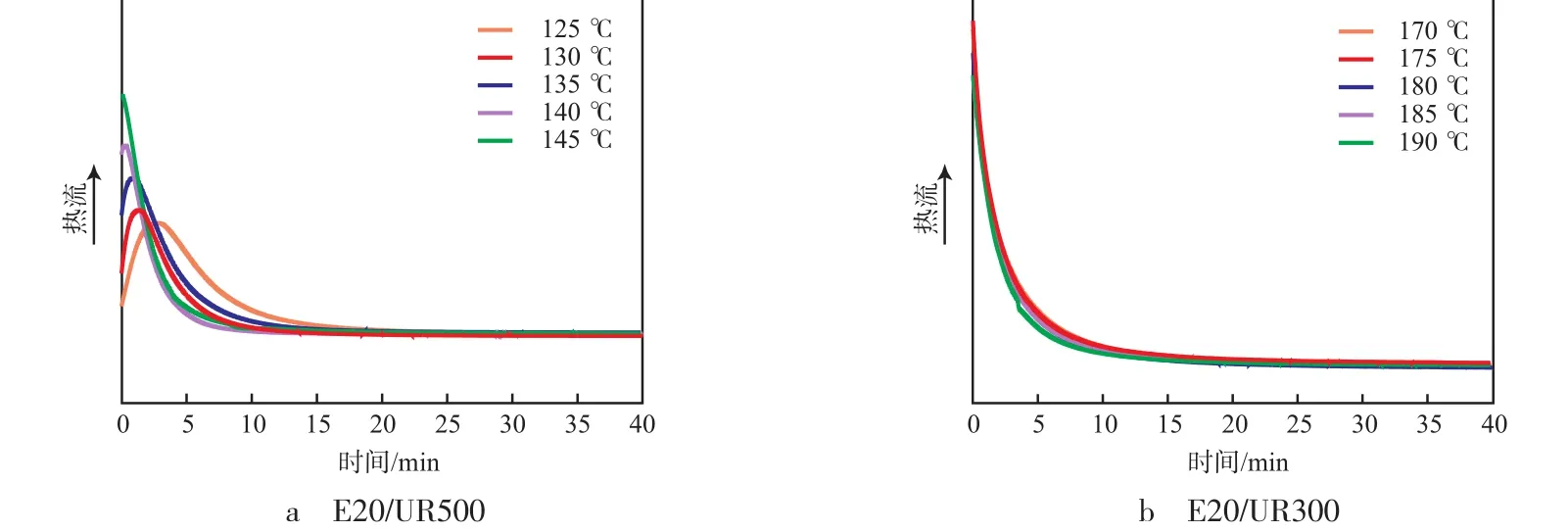
图2 环氧树脂/有机脲体系的等温DSC曲线Fig.2 DSC curve of epoxy resin/organic urea system
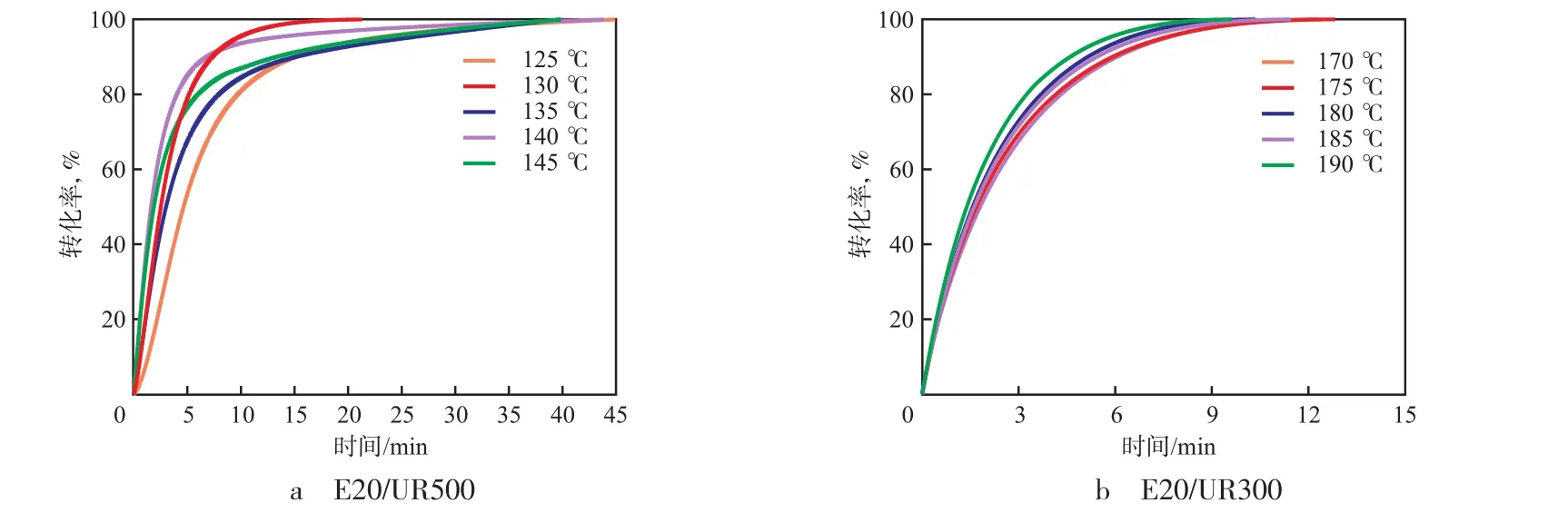
图3 环氧树脂/有机脲体系的转化率与时间的关系曲线Fig.3 Conversion rate of epoxy resin/organic urea system as a function of time
2.3 固化反应动力学方程
亢雅君等[8]认为,有机脲与环氧树脂首先反应生成噁唑酮和仲胺,在环氧树脂过量的情况下,仲胺与环氧树脂反应生成叔胺,叔胺进一步反应产生阴离子活性中心,最终引发阴离子开环聚合,但对于固化反应动力学没做进一步研究,反应机理见式(1)~式(5)。本工作的环氧树脂/有机脲体系的反应机理与式(1)~式(5)基本一致。
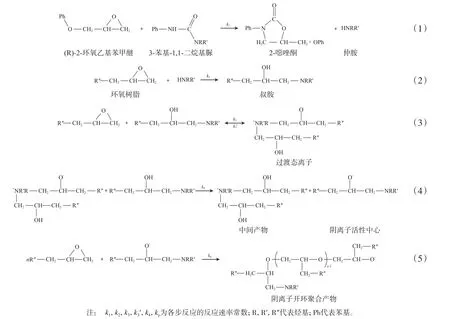
环氧基的反应速率dx/dt=k1·[N]·e+k2·[N]·e+k3·[A]·e-k3′·[B]+kp·[C-]·e,其中,e为环氧树脂在该反应时刻的浓度,x为消耗的环氧基浓度,[A],[B],[C-],[N]分别为叔胺浓度、过渡态离子浓度、阴离子活性中心浓度、仲胺浓度。在聚合过程中环氧基主要消耗在式(5),因此,可以用dx/dt=kp·[C-]·e近似表示总反应速率,转化率α=x/e0,e=e0-x,e0为环氧基总浓度,dα/dt=1/e0·dx/dt=1/e0·kP·[C-]·e。式(3)产生过渡态离子是一个平衡,存在平衡常数(K),K=[B]/([A]·e),则[B]=K·[A]·e,式(4)过渡态离子一经产生立刻转化为活性阴离子,即[C-]=[B]=K·[A]·e,dα/dt=1/e0·kP·K·[A]·e2,假设叔胺浓度等于仲胺浓度,即[A]=[N],d[N]/dt=k1·e·u0,u0为总的有机脲浓度,则[N]=k1·e·u0·t,由此得出初期固化反应动力学方程dα/dt=e02·kp·k1·K·u0·(1-α)3·t,显示(dα/dt)/(1-α)3是关于t的一次方程。根据图3不同时间的转化率,得出(dα/dt)/(1-α)3~t曲线。从图4可以看出:反应初期(dα/dt)/(1-α)3与t较为符合线性关系,随后的反应曲线出现偏离。对图4曲线进行拟合,在E20/UR500体系中,125 ℃转化率在0~18%,130 ℃转化率在0~20%,135 ℃转化率在0~38%,140 ℃转化率在0~39%,145 ℃转化率在0~37%时符合理论曲线(相关系数均为0.990)。E20/UR300体系中,170 ℃转化率在0~22%,175 ℃转化率在0~23%,180 ℃转化率在0~23%,185 ℃转化率在0~23%,190 ℃转化率在0~22%时符合理论曲线(相关系数均为0.990)。
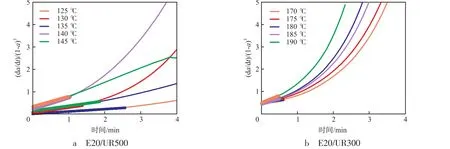
图4 环氧树脂/有机脲体系固化反应历程的(dα/dt)/(1-α)3~t关系曲线Fig.4 (dα/dt)/(1-α)3~t curves of epoxy resin/organic urea system
反应经历一定时间后有机脲消耗完毕,体系中阴离子活性中心浓度达到恒定,反应主要按式(5)进行,由此得出中期固化反应动力学方程dα/dt=1/e0·dx/dt=1/e0·kP·[C-]·e=kP·[C-]·(1-α),显示dα/dt是关于(1-α)的一次方程。根据图3中不同时间的转化率,得出dα/dt~(1-α)曲线,从图5可以看出:反应中期dα/dt与(1-α)成线性关系,反应初期、后期曲线出现偏离。对图5曲线进行线性拟合,得到E20/UR500体系中,125,130,135,140,145 ℃的转化率分别为46%~80%,45%~79%,42%~80%,37%~76%,39%~71%时符合理论曲线(相关系数均为0.999)。E20/UR300体系中,170,175,180,185,190 ℃的转化率分别为33%~78%,33%~70%,34%~80%,32%~69%,31%~71%时符合理论曲线(相关系数均为0.999)。后期曲线出现偏离,是由于反应后期环氧基浓度降低,体系中交联网络形成,环氧基及活性阴离子扩散困难,反应变得更加复杂。
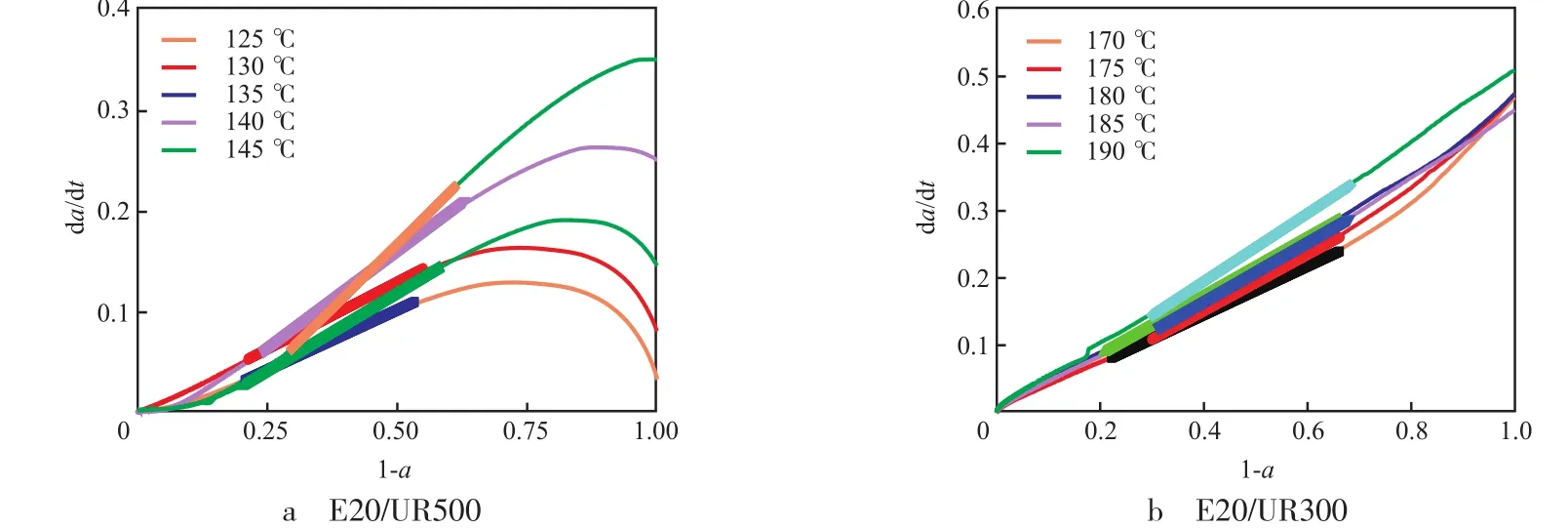
图5 环氧树脂/有机脲体系固化反应历程的dα/dt~(1-α)关系曲线Fig.5 dα/dt~(1-α) curves of curing reaction of epoxy resin/organic urea system
环氧树脂/有机脲体系固化反应历程分为初期、中期、后期。初期固化动力学方程为dα/dt=e02·kp·k1·K·u0·(1-α)3·t,中期固化动力学方程为dα/dt=kP·[C-]·(1-α)。
2.4 固化反应活化能
图4和图5直线部分的斜率分别为固化反应初期和中期的表观速率常数,由Arrhenius公式k=A·exp(-Ea/RT)计算,其中,k为表观速率常数;A为指前因子;Ea为表观活化能,kJ/mol;R为摩尔气体常数,8.314 J/(mol·K);T为热力学温度,K。用lnk对1/T作图,见图6,求得固化反应初期、中期的表观活化能。E20/UR500体系反应初期和中期的表观活化能分别为103.9,52.4 kJ/mol;E20/UR300体系反应初期和中期的表观活化能分别为67.5,25.0 kJ/mol。
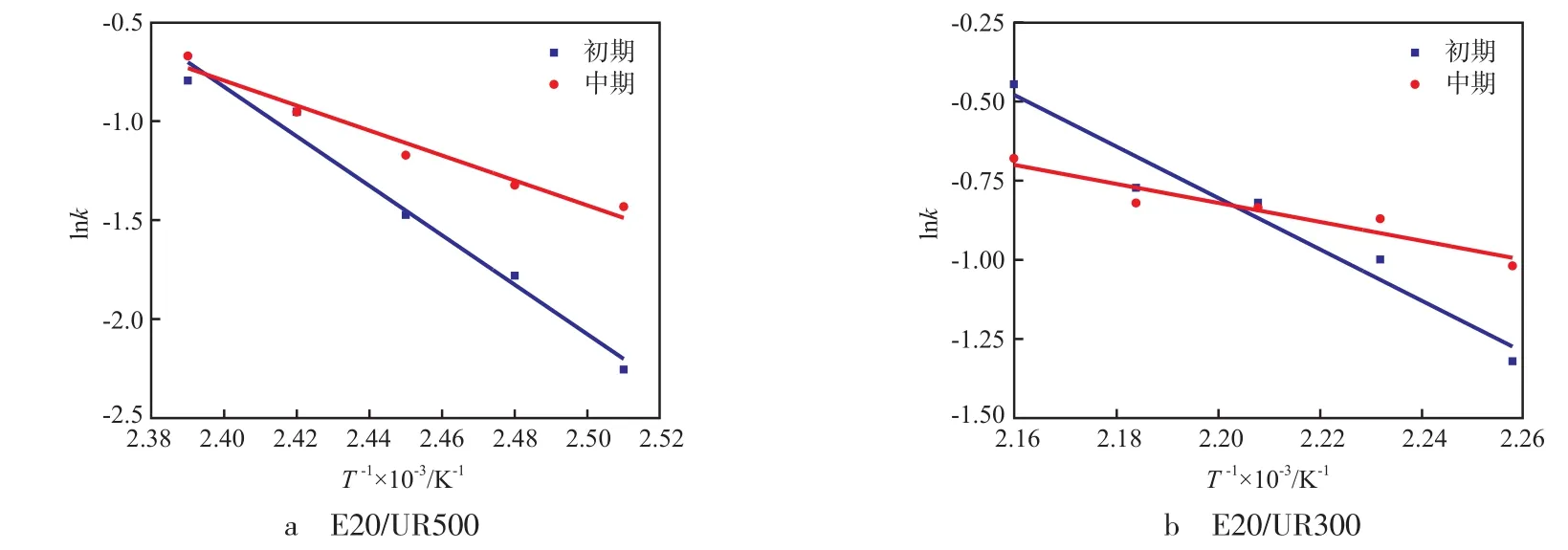
图6 环氧树脂/有机脲体系的lnk与1/T关系曲线Fig.6 Relationship between lnk and 1/T of epoxy resin/organic urea system
3 结论
a)有机脲作为一种潜伏性固化剂,能有效固化环氧树脂。
b)固化反应机理为有机脲与环氧树脂反应生成噁唑酮和仲胺,在环氧树脂过量的情况下,仲胺与环氧树脂反应生成叔胺,叔胺进一步反应产生阴离子活性中心,最终引发阴离子开环聚合。
c)反应初期,(dα/dt)/(1-α)3是关于t的一次方程;反应中期,dα/dt是关于(1-α)的一次方程。
d)E20/UR500体系和E20/UR300体系反应初期的表观活化能分别为103.9,67.5 kJ/mol,反应中期的表观活化能分别为52.4,25.0 kJ/mol。
