二穗短柄草GRFs基因家族的鉴定及表达模式分析
2020-06-30尚申申杨夏夏杨金华韩群威李记民冯雅岚
马 超 宋 鹏 尚申申 杨夏夏 杨金华 韩群威 李记民 冯雅岚
(河南科技大学农学院/河南省旱地农业工程技术研究中心,河南 洛阳 471023)
生长调控因子(growth-regulating factors, GRFs)是植物特有的转录因子家族,其在植物生长发育过程中起着重要的调节作用[1],如参与叶片细胞大小[2]和数量的调控[3]、分生组织的生长和维持[4]、花的发育[5]和花期调控[6]、种子[7]和根的发育[8]、植物寿命[4]以及对逆境胁迫的响应[9-10]等。 随着基因组测序技术的发展,多种植物的GRFs基因家族已被鉴定,包括玉米、油菜、梨等[11]。 研究表明,GRFs基因家族含有2个保守的结构域:复杂芳香疏水性氨基酸QLQ(谷氨酸、亮氨酸、谷氨酸)结构域和WRC(色氨酸、精氨酸、半胱氨酸)结构域[11]。 前者是重要的蛋白互作区域,如拟南芥该保守区域可与GIF(GRF-interacting factor)蛋白发生互作从而行使转录激活作用[12];后者含有的C3H 锌指结构,能够引导GRF 蛋白入核并结合其靶基因[13]。 QLQ 和WRC 结构域都位于GRF 蛋白序列的N 端,前者在所有真核生物中都有存在,而后者是植物特有的,一些物种个别GRF 蛋白成员可能缺少QLQ或WRC 结构域[13]。
二穗短柄草(Brachypodium distachyon)是原产于非洲北部、欧洲南部和亚洲中部的一种适应冷凉气候的一年生禾本科植物[14]。 二穗短柄草与普通小麦、大麦、燕麦等麦类作物同属于早熟禾亚科,其形态、生理特征及基因组等特点都十分相似;另外,由于二穗短柄草具有株型较小,可实现在温室内大量的种植,生命周期较短,严格的自花授粉,易于遗传转化等特点,使其具有与拟南芥相似的模式植物特点[15-16]。 二穗短柄草自交系Bd-21 的基因组测序已于2010 年完成,二穗短柄草基因组小、染色体少,且DNA 重复序列少,也佐证了其具有作为模式植物的基本特性[17]。 水稻作为单子叶植物的典型模式植物,其相关研究取得了迅猛发展,但是水稻的原始生境处于热带、亚热带。 对于像小麦、大麦等生活在冷凉气候、需要春化过程的麦类作物来说,水稻并不是理想的模式植物,而二穗短柄草在亲缘关系上与小麦、大麦、燕麦等粮食作物更近;同时,水稻植株较大且生育期较长[18-19]。 基于以上特点,Draper 等[20]首次建议将二穗短柄草作为禾本科植物功能基因组学研究的模式植物。
本研究利用NCBI 数据库首次对二穗短柄草12个GRFs基因家族成员的系统进化关系和基因结构进行分析,通过RT-qPCR 的方法对GRFs基因家族成员的表达模式进行研究,旨在为进一步了解二穗短柄草中GRFs家族成员基因功能提供理论基础。
1 材料与方法
1.1 供试材料
以二穗短柄草Bd-21 为试验材料,在湿润的滤纸上催芽1 d 后转入4℃冰箱春化8 d,然后种植于营养钵内。 在灌浆期分别取根、茎、老叶、新叶、幼穗、籽粒6 个不同组织用于基因表达定量分析。 于五叶期进行外源激素处理,分别施用生长素(auxin,IAA) 10 μmol·L-1, 脱落酸(abscisic acid,ABA)50 μmol·L-1、赤霉素(gibberellin,GA3) 50 μmol·L-1、细 胞 分裂素( cytokinin, 6-BA) 10 μmol·L-1、 油菜素内酯(brassinolide,BR)10 μmol·L-1,喷施12 h 后取叶片为样品,液氮速冻后-80℃超低温冰箱保存待测。
1.2 GRFs 基因家族鉴定及染色体分布分析
利用 Plant Transcription Factor Database v4.0(http:/ /planttfdb.cbi.pku.edu.cn/)对二穗短柄草和拟南芥中GRFs基因家族进行筛选;利用Pfam 31.0 数据库(http:/ /pfam.xfam.org/)对筛选到的GRFs基因家族进行结构域确定并去除冗余基因[21];利用Phytozome v12.1(http:/ /www.phytozome.net/)和TAIR(http:/ /www.arabidopsis. org/)数据库确定二穗短柄草与拟南芥GRFs基因家族在染色体上的位置信息;利用Circos 0.6 软建构建GRFs基因家族的染色体分布图谱[22];利用在线软件ProtParam(https:/ /web. expasy. org/protparam/)和Sopma(http:/ /npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl? page =/NPSA/npsa_hnn.html)预测蛋白质基本理化性质;利用蛋白质保守基序在线搜索软件MEME(http:/ /meme.nbcr.net/)分析GRFs基因家族保守结构域的特征;利用DNAMAN version 6.0 对序列保守性进行分析。
1.3 GRFs 家族成员氨基酸序列比对与系统发育树构建
将筛选完成的二穗短柄草、拟南芥、水稻、玉米和谷子GRFs 家族成员氨基酸全序列另存为FASTA 格式,利用MEGA5.05(http:/ /www.mega-software.net/)进行序列比对及系统发育树构建,bootstrap 值设定为1 000[23]。
1.4 GRFs 基因家族表达模式分析
根据二穗短柄草GRFs基因家族序列信息设计特异引物,由北京华大基因公司合成。 Total RNA 的提取采用Trizon 法,cDNA 第一链的合成使用PrimeScriptTMRT reagent Kit with gDNA Eraser (Perfect Real Time)试剂盒,Real-time PCR 使用SYBR©Premix Ex TaqTMⅡ(Tli RNaseH Plus)试剂盒,均购自宝生物工程有限公司。 反应总体积20 μL,包含10 μL SYBR premix Ex Taq (2×)、1 μL cDNA(稀释5 倍)、上下游引物各0.4 μL(10 μmol·L-1),8.2 μL ddH2O。 反应程序为二步法:95℃预变性30 s;95℃变性5 s,60℃退火30 s,40个循环;在复性时采集荧光信号,重复3 次。 以UBC18为内参基因,采用2-ΔΔCT法[24]计算相对表达量。
2 结果与分析
2.1 二穗短柄草GRFs 基因家族的鉴定与染色体定位
通过Plant Transcription Factor Database (http:/ /planttfdb.cbi.pku.edu.cn/)获取二穗短柄草与拟南芥GRFs候选基因,对这些候选基因结构域进行比对,最终确定到12 个二穗短柄草GRFs基因、9 个拟南芥GRFs基因。 为了确定GRFs基因在染色体上的分布特点,构建了二穗短柄草、拟南芥GRFs基因在染色体上的分布图(图1)。 其中12 个二穗短柄草GRFs基因(图1 灰色部分)分布在二穗短柄草5 条染色体上;9个拟南芥GRFs基因(图1 黑色部分)分布在拟南芥4条染色体上(拟南芥at01 染色体上无GRFs基因分布)。 在二穗短柄草中,bd01 号染色体上分布最多,有5 个GRFs基因,bd02 和bd04 号染色体上分布最少,都只有1 个GRFs基因;而在拟南芥中,在at02 号染色体上分布最多,有4 个GRFs基因,在at05 号染色体上分布最少,只有1 个GRFs基因。 上述结果表明,GRFs基因在2 种植物不同染色体上的分布是不均匀的,在同一染色体上的位置分布也是不均匀的。
2.2 二穗短柄草GRFs 基因家族基本理化特性分析
由表1 可知,二穗短柄草GRFs家族成员编码序列(coding sequence, CDS)长度为645~1 734 bp,编码蛋白长度为238~577 aa,分子量为25.44~61.64 kDa,等电点(pI)为4.81~10.57;GRF3、GRF6 和GRF9 由4个外显子组成,GRF4、GRF5 和GRF8 由5 个外显子组成,其他家族成员均由3 个外显子组成;亚细胞定位预测结果表明,二穗短柄草GRFs 家族蛋白均定位于细胞核,具有转录因子的一般特性。

图1 二穗短柄草和拟南芥GRFs 直系同源基因关系分布图Fig.1 The distribution diagram of GRFs orthologous genes between Brachypodium distachyon and Arabidopsis thaliana
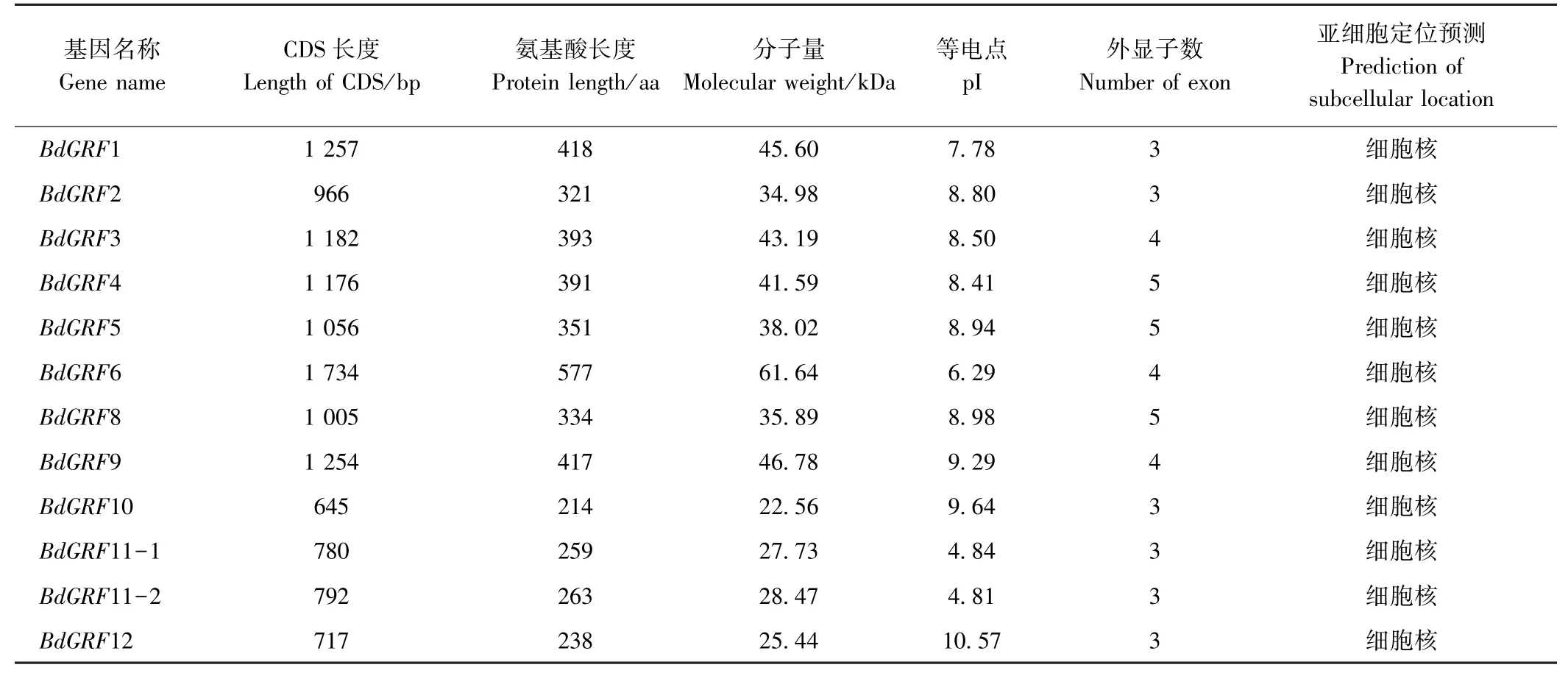
表1 二穗短柄草GRFs 基因家族成员理化性质Table 1 The physic-chemical characters of bdGRFs gene family in Brachypodium distachyon
2.3 二穗短柄草GRFs 蛋白家族的多重序列比对分析
GRFs 家族是一类植物特有的转录因子家族,其典型特征是含有保守的DNA 结合域。 GRFs 家族成员包含2 个保守的结构域,QLQ 结构域位于GRFs 蛋白的N 端,含有18~26 个α 螺旋,1 ~4 个β 转角,6 ~15 个无规则卷曲和2 ~7 个延伸链;另一个WRC 结构域也位于GRFs 蛋白的N 端,含有4~15 个α 螺旋,0 ~6 个β 转角,29 ~40 个无规则卷曲和0 ~11 个延伸链(表2),而WRC 结构域能够与C3H 基序结合,该区域是DNA 结合域并能引导该蛋白入核行使转录因子的功能。 由图2 可知,12 个二穗短柄草GRFs 蛋白都具有保守的QLQ 和WRC 结构域,2 个结构域氨基酸残基分别为34 ~36 个(最少的是BdGRF2 ~5,最多的是BdGRF1、BdGRF6 ~9、BdGRF11-1 和BdGRF11-2)和49~66 个(最少的是BdGRF4,最多的是BdGRF2)。
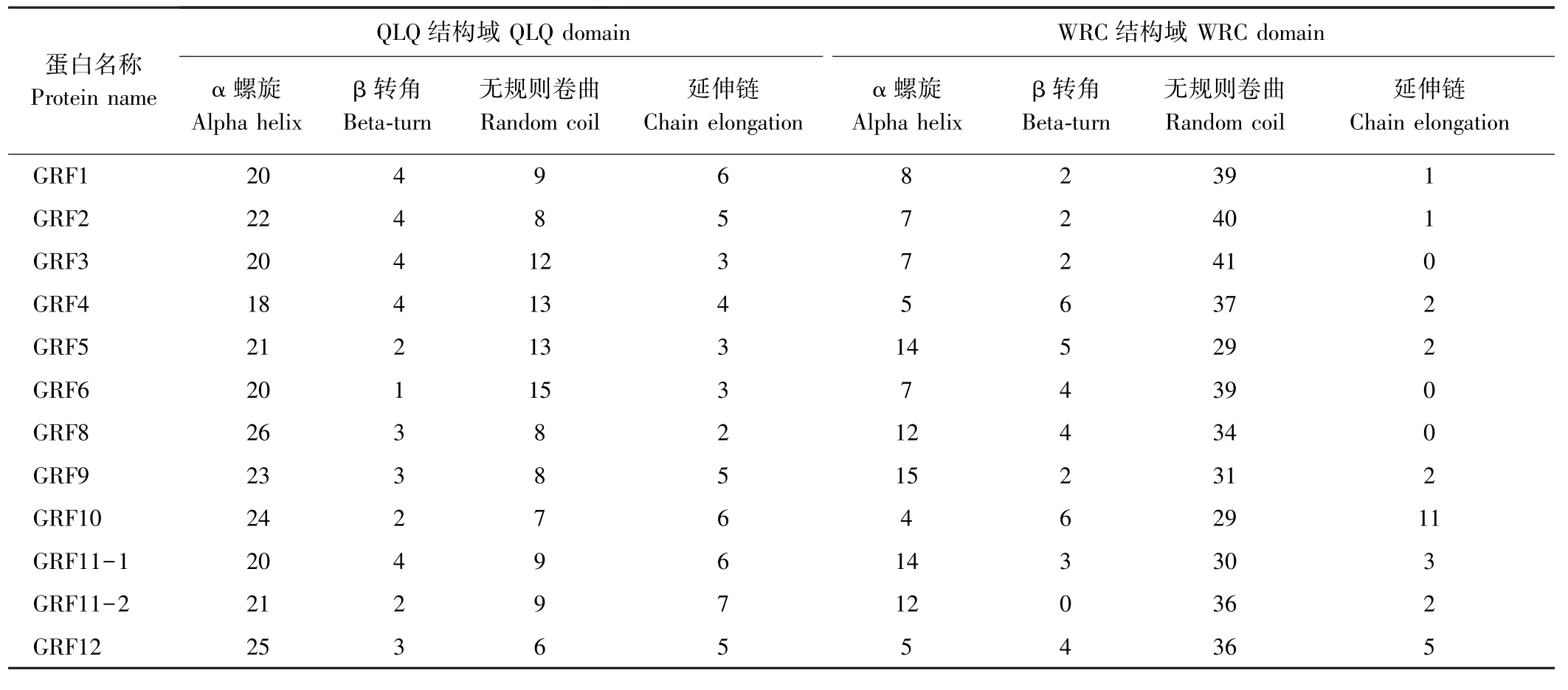
表2 二穗短柄草QLQ 结构域和WRC 结构域二级结构预测Table 2 The Secondary structure prediction of QLQ and WRC domains in Brachypodium distachyon

图2 二穗短柄草GRFs 蛋白序列的多重序列比对Fig.2 The multiple sequence alignment of GRFs proteins in Brachypodium distachyon and Arabidopsis thaliana
2.4 二穗短柄草GRFs 蛋白家族系统发育树的构建及分析
为了比较二穗短柄草等主要单子叶植物和拟南芥(双子叶植物)GRFs 蛋白家族的进化关系,以二穗短柄草、水稻、玉米、谷子和拟南芥GRFs 氨基酸序列构建系统发育树。 由图3 可知,5 个物种中GRFs 蛋白家族成员可以聚类为8 个主要的进化分支。 以最小分支树中的基因为直系同源基因[25],进一步分析了5 个物种中系统发育树的8 个进化分支的关系。 具有直系同源关系的基因共有23 组,含有二穗短柄草的共有9组,其中与水稻直系同源的家族成员数量有4 个,与谷子和拟南芥直系同源的家族数量均是2 个。
2.5 二穗短柄草GRFs 蛋白家族的保守基序分布及序列分析

图3 二穗短柄草、拟南芥、水稻、玉米和谷子GRFs 蛋白家族系统发育树Fig.3 The phylogenetic tree of GRFs protein family among Brachypodium distachyon,Arabidopsis thaliana, Oryza sativa, Zea mays and Setaria italica
二穗短柄草GRFs 蛋白家族系统进化分析表明,GRFs 蛋白家族分为5 类:Ⅰ、Ⅱ、Ⅲ、Ⅳ和Ⅴ,并且存在4 对直系同源基因。 通过MEME 在线软件对二穗短柄草12 个GRF 蛋白的保守基序进行分析(图4),结果表明,12 个GRF 蛋白具有9 个保守基序。 进一步分析了9 个保守基序在二穗短柄草GRFs 蛋白中的分布情况,GRF9 包含全部9 个保守基序;其他8 个GRF 蛋白中都存在不同保守基序的缺失,每个蛋白包含保守基序的数量在2 ~6 个之间,其中GRF11-1、GRF11-2、GRF10 和GRF12 保守基序缺失最多,只包含2 个保守基序;另外,有2个保守基序(Motif 3 和Motif 4)在所有二穗短柄草GRFs 蛋白中都是完全保守的。
通过SMART 网站提取了二穗短柄草与拟南芥GRFs 蛋白家族中所包含的QLQ 和WRC 保守结构域。在二穗短柄草中得到12 个QLQ 和WRC 保守结构域,而在拟南芥中得到9 个。 对QLQ 和WRC 结构域进行了保守区域的分析,二穗短柄草中12 个QLQ 结构域
相似度为20.5%,一致序列为T(x)Q(x)EL(x)Q(x)Y(x)P(x)L,拟南芥中9 个QLQ 结构域相似度为20.6%,一致序列为Q(x)E(x)Q(x)Y(x)VP(x)L(图5-A);二穗短柄草中12 个WRC 结构域相似度为40.0%,一致序列为P(x)RCRRTDGKKWRC(x)KYC(x)H(x)R(x)R(x)Ⅴ,拟南芥中9 个WRC 结构域相似度为37.5%,一致序列为EP(x)RC(x)RTDGKK WRC(x)KYC(x)H(x)R(图5-B)。 通过比较二穗短柄草和拟南芥中QLQ 和WRC 结构域发现,在2 个物种之间WRC 结构域在氨基酸长度和序列上均有较好的一致性,而QLQ 结构域存在较大的差异。
2.6 二穗短柄草GRFs 基因家族的组织表达模式分析

图4 二穗短柄草GRFs 蛋白家族的保守基序分布Fig.4 Distribution of conserved motifs of GRFs protein family in Brachypodium distachyon
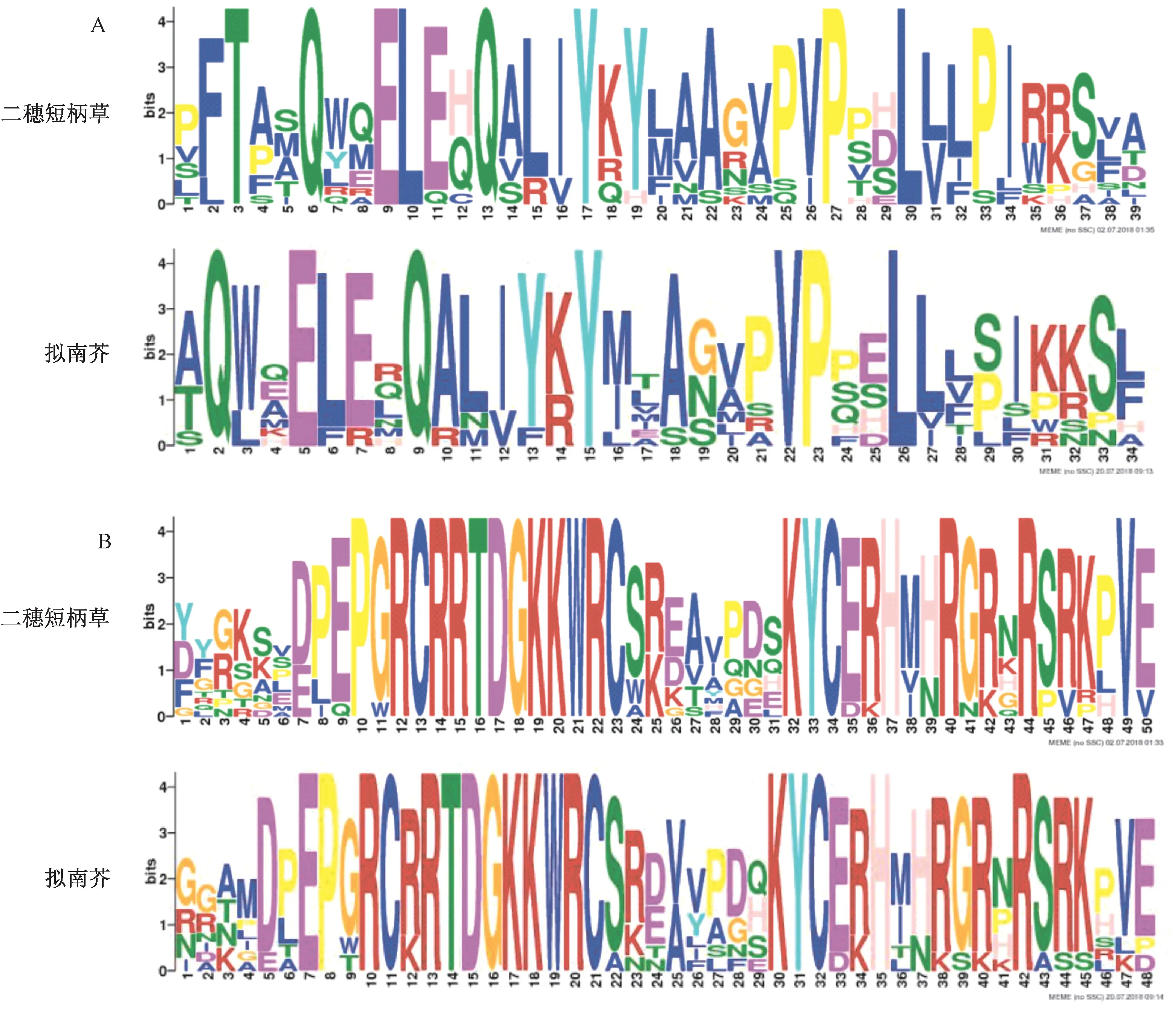
图5 二穗短柄草GRFs 蛋白家族保守结构域分析Fig.5 Analysis of conserved domains of GRFs protein family in Brachypodium distachyon
为了分析二穗短柄草GRFs基因家族在不同组织器官中的表达特征,利用RT-qPCR 技术分析了12 个GRFs家族成员在根、茎、老叶、新叶、幼穗和籽粒的表达模式。 结果发现,所有GRFs家族成员在幼穗中表达量最高,而在根中表达量最低,其中差别最大的是GRF2(23.3 倍),差别最小的是GRF6(3.89 倍),新叶的表达量普遍高于老叶(1.2 ~3.0 倍),在籽粒中表达量也较高。GRFs家族成员在幼嫩组织(特别是在幼穗中)表达丰度较高,说明GRFs家族成员在不同器官的生长和发育中的作用是不同的。
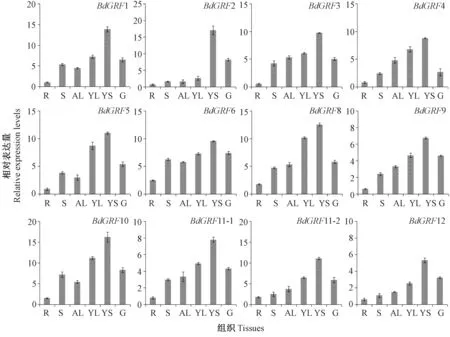
图6 二穗短柄草GRFs 基因家族的组织表达模式分析Fig.6 Expression analysis of GRFs family members of Brachypodium distachyon in different tissues
2.7 二穗短柄草GRFs 基因家族对外源激素响应的表达模式分析
由图7 可知,几乎所有的GRFs家族成员均对外源激素产生了响应。 依次有2、3、6、6 和2 个GRFs家族成员分别对外源IAA、ABA、GA3、6-BA 和BR 发生2倍以上的上调响应。 外源IAA 显著促进了7 个GRFs家族成员的上调表达,5 个GRFs家族成员显著下调表达,其中,上调表达差异倍数最大的是BdGRF1(2.4倍),其次为BdGRF3(2.3 倍),而下调倍数最高的是BdGRF10(0.2 倍)。 外源ABA 仅对BdGRF11-1 产生了显著的下调表达效果(0.4 倍),BdGRF5 与CK 相比差异不显著,其余家族成员均呈现显著上调表达的效果,上调表达差异倍数最大的是BdGRF4(2.4 倍)。外源GA3显著促进了8 个GRFs家族成员的上调表达,3 个GRFs家族成员略微上调但差异不显著,BdGRF9 下调表达差异也不显著;其中,上调表达差异倍数最大的是BdGRF2(24.0 倍),其次为BdGRF12(8.7 倍)和BdGRF1(6.6 倍)。 外源6-BA 对全部GRFs家族成员都呈现上调表达效果,其中,上调表达差异倍数最大的是BdGRF1(7.6 倍),其次为BdGRF3(5.3 倍)。 外源BR 对BdGRF10(0.7 倍)和BdGRF11-1(0.8 倍)产生下调表达效果,其余家族成员均表现为上调表达效果。
3 讨论
作为植物特有的转录因子,在基因组水平上,GRFs已经在许多物种中得到鉴定;截至目前,在苔藓中只鉴定到2 个GRFs成员;单子叶植物中鉴定到GRFs成员数量最少的是大麦,仅有8 个成员,最多的是香蕉,有19 个成员;双子叶植物中鉴定到GRFs成员数量最少的是百脉根,仅有2 个成员,最多的是大豆,有26 个成员;多数高等植物都能鉴定到8 个以上成员,而且表现为双子叶植物大于单子叶植物,多倍体大于单倍体[25]。 本研究在全基因组范围内鉴定到12个二穗短柄草GRFs基因家族成员。 二穗短柄草与拟南芥GRF 蛋白保守结构域的分析结果表明,2 个物种QLQ 结构域保守性约为20%,该结构域的差异主要表现在氨基酸偏好性的不同,这可能会导致不同家族成员在特定组织、发育阶段或特殊生理状态下发生特异性表达,而QLQ 结构域是蛋白质互作区域,这种多态性很可能是执行不同生物学功能的重要原因;WRC 结构域保守性约为40%,保守氨基酸存在较大差异,而保守氨基酸一般出现在结构域的N 端,这表明GRFs蛋白家族结构在单子叶植物和双子叶植物之间的保守性并不高。 这种由缺失和插入所造成的结构域氨基酸残基数量的变异,也是二穗短柄草GRFs呈现遗传多样性的重要原因。

图7 二穗短柄草GRFs 基因家族对外源激素响应的表达模式分析Fig.7 Expression analysis of GRFs family members in response to various hormones of Brachypodium distachyon
GRFs基因家族在植物不同生命进程中发挥着不同的功能,GRF1~5 在细胞大小和数量的调控中起着重要作用,进而影响根系生长、叶片大小和植株高度等,特别是GRF2 对穗子发育、种子大小和含油量具有重要影响[2-3,25-28];此外,GRF1、GRF3 和GRF7 通过解除对DREB2A的抑制作用来响应环境的胁迫[9];而大部分GRFs家族成员都能参与植物花器官的发育及花期的调控[5-7,29]。 本研究系统发育树结果表明,二穗短柄草、拟南芥、水稻、玉米和谷子分为Ⅰ、Ⅲ、Ⅳ、Ⅴ、Ⅵ和Ⅷ6 组,分别包含1、2、2、2、2 和3 个二穗短柄草GRFs 蛋白,表明二穗短柄草GRFs 蛋白家族成员之间存在着广泛的多样性,这可能是由QLQ 结构域保守性较低决定的,不同的DNA 结合位点可能是GRFs 蛋白家族成员功能多样性的重要原因,同时也可能出现功能冗余的现象[25]。 系统发育结果还表明,二穗短柄草GRFs 蛋白家族成员可能来自同一祖先。 此外,二穗短柄草GRFs 蛋白家族亲缘关系与水稻最近,这可能与二者都是C3 植物有关,与C4 植物的谷子亲缘关系次之,而与C4 植物的玉米较远,与双子叶植物拟南芥亲缘关系最远。 基因家族成员的分布和结构的多样性决定了功能的多样性,为研究二穗短柄草GRFs基因功能奠定了基础。 本研究还发现,二穗短柄草和拟南芥GRFs基因家族中存在8 对直系同源基因,在二穗短柄草中,未发现与拟南芥GRF7 直系同源的基因,这表明二穗短柄草在进化的过程中可能发生了基因丢失事件,同时也按照物种特异性的方式进行了扩展,该现象在植物其他基因家族的研究中也得到了广泛的验证[30-31],说明不同类型的GRFs基因家族成员存在不同的进化途径和进化速度。 此外,二穗短柄草的12 个GRFs家族基因广泛而非均匀地分布于其5 条染色体上,表明GRFs基因家族在二穗短柄草基因组中具有共同的祖先。 GRFs 蛋白家族结构域和基序的保守性及多样性都表明,GRFs 蛋白家族在二穗短柄草进化过程中具有重要且多重的作用。 然而,染色体分布和序列比对分析结果表明,二穗短柄草GRFs家族成员的扩张并未出现串联重复的现象,这与前人研究结果是一致的[32-33]。
表达模式分析可以在一定程度上预测基因的分子功能和涉及的生命过程。 本研究通过RT-qPCR 分析了GRFs基因家族在二穗短柄草不同组织器官中的表达模式,发现几乎所有GRFs家族成员表达量在幼穗和新叶等幼嫩器官中表达量较高,而在根系和老叶等器官中表达量较低。 Kim 等[34]和Choi 等[35]分别对拟南芥和水稻GRFs基因家族在全基因组范围内进行了鉴定和表达分析,结果表明,拟南芥和水稻全部GRFs家族成员在地上部分生组织中大量表达,而在9 个拟南芥GRFs基因家族成员中有7 个成员在根系分生区域有表达,在12 个水稻中GRFs基因家族成员中有2个表现出低丰度的表达模式,这与本研究结果基本一致,暗示GRFs 蛋白在植物生长发育中可能具有不同的生物学功能。GRFs基因通过正向调节细胞的伸展与分裂来促进植物叶片的生长,且GRFs基因的表达量随着植物的衰老而下降,说明GRFs基因家族广泛参与了二穗短柄草旺盛生长器官的生命过程,推断GRFs基因家族成员在分生组织功能和器官形成中具有重要作用[36-37]。 植物的第一个GRFs转录因子(OsGRF1)是在研究GA3促进水稻节间伸长中被发现的[38]。 前人研究表明,外源GA3能诱导水稻、大白菜和烟草GRFs基因的上调表达,而拟南芥GRFs家族成员对外源GA3没有响应,这可能是不同物种间进化关系不同导致的[12]。 本研究结果表明,外源GA3能够使8 个GRFs基因家族成员显著上调,其他4 个成员差异不显著,由此推断并不是所有的GRFs家族成员都参与了二穗短柄草对外源GA3的响应,这与水稻中的研究结果相似。KNOX是重要的调节因子,通过抑制GA的生物合成进而抑制细胞分化,因而能够负向调控分生组织的发育及其功能;而GRFs是KNOX的上游抑制基因,由此推测,外源GA3诱导了KNOX的表达,并导致GRFs基因的上调表达,说明二穗短柄草的GA 信号可能存在负向反馈调节机制。 本研究还发现,大部分GRFs基因家族成员对外源IAA、ABA、6-BA 和BR均产生了响应,这是因为与激素相关的顺式作用元件存在于GRFs基因家族成员的启动子区域,如ABRE、GARE、TATC-box 和P-box 元件[12]。 然而,GRFs基因家族的转录调节机制包括其启动子特异作用元件的相关研究仍需要进一步深入探索。
4 结论
本研究利用生物信息学的方法,在全基因组范围内鉴定了二穗短柄草的12 个基因家族成员;多序列比对发现它们均含有2 个保守的结构域:QLQ 和WRC结构域。 染色体定位、基因结构特征、系统发育关系分析表明,与拟南芥同源基因比对发现,二穗短柄草GRFs基因家族可能经历了不同的进化过程。 RTqPCR 分析表明,这些GRFs家族基因在二穗短柄草不同器官中表达模式类似,在幼嫩组织中表达量较高,且多数成员对外源激素特别是GA3有响应,表明GRFs家族基因广泛参与了分生组织功能和器官形成。 该结果为进一步研究GRFs家族基因在二穗短柄草生长发育和器官形成等过程中的作用奠定了基础。
