高温胁迫下硒硫互作调控西兰花芽苗生理及萝卜硫素代谢研究
2020-06-30朱振宇沈敏熙程雨薇尹永祺方维明
韩 宇 朱振宇 沈敏熙 程雨薇 尹永祺 方维明
(扬州大学食品科学与工程学院,江苏 扬州 225127)
硫代葡萄糖苷(简称硫苷)是一类含氮和硫的次生代谢产物。 西兰花中含有丰富的萝卜硫苷(glucoraphanin,GRA),其经黑芥子酶(myrosinase,MYR)作用水解生成萝卜硫素[1-2]。 萝卜硫素是目前发现最强的天然抗癌成分之一[3],它能够抑制体内阶段I 相致癌酶的产生,诱导产生阶段II 相解毒酶竞争性抑制化学致癌基因表达[4],使致癌物失活排除体外,从而保护体内大分子不受损伤。 此外,萝卜硫素还具有抗氧化[5]及抑制炎症等[6]多种生理作用。 西兰花芽苗是一种潜在的天然功能性蔬菜,富含矿物质、维生素和次生代谢物,能够降低慢性疾病的发生,对人类健康有益[7],因而受到广泛关注。
研究发现,西兰花遭受逆境胁迫时会启动防御机制及胁迫应激反应,大量积累硫苷以抵御胁迫造成的损伤[8]。 硫苷合成相关基因的表达在很大程度上也受植物生长环境因素,如温度、光照及辐射等的影响,进而影响硫苷含量[9]。 外源施硫已被证实是富集萝卜硫素的有效手段。 此外,硒是维持人体正常新陈代谢所必需的元素,如果供应不足,会导致相关病理症状[10],研究发现甲基化的含硒化合物可预防肿瘤[11]。研究显示,适当的硒处理会增加西兰花中硒代氨基酸、硫苷及萝卜硫素等含量[12]。 同时,热激、低氧及外源茉莉酸、脱落酸处理均可促进萝卜硫素的富集[8]。 然而,高温胁迫尤其是高温胁迫下硒硫互作对西兰花芽苗生理及萝卜硫素代谢的影响尚鲜见报道。
本研究以西兰花为试材,研究高温胁迫硒硫互作处理下西兰花芽苗主要生理生化和萝卜硫素代谢的变化,以期从生理生化代谢及基因水平探讨高温胁迫下硒硫互作对西兰花芽苗中GRA 和萝卜硫素的调控机制,为开发富含萝卜硫素的功能性食品提供理论依据,推动芽苗菜的工业化发展。
1 材料与方法
1.1 供试材料
西兰花(Brassica oleraceaL.)种子品种为优秀,购于2018 年,产自日本坂田公司,封装于密闭容器中,4℃保存备用;亚硒酸钠、烯丙基硫苷(纯度>95%)、萝卜硫素(纯度>99%)生化试剂、乙腈,色谱纯,均购自美国Sigma 公司;1,2-苯二硫醇(纯度>99%)生化试剂,购自东京化成工业株式会社;其余试剂均为国产分析纯。 RNA 反转录 试剂 盒(RR047A)、 TB Green Premix Dimer Eraser(RR091A),均购自日本TaKaRa公司。
1.2 试验方法
1.2.1 样品制备 称取西兰花种子24 g,置于100 mL 1%(v/v)NaClO 水溶液中,20℃浸泡消毒15 min,然后用蒸馏水冲洗种子至pH 值中性,再于蒸馏水中30℃浸泡4 h,随后置于铺有蛭石的透明盒中,于pGX-150 型智能光照培养箱(宁波海曙赛福实验仪器厂)内30℃发芽,16 h 光照/8 h 黑暗,分别设置以下处理:1)对照:4 mmol·L-1ZnSO4,记作S;2)Na2SeO3处理:0.1 mmol·L-1Na2SeO3记作Se;3)ZnSO4联合Na2SeO3处理:4 mmol·L-1ZnSO4+0.1 mmol·L-1Na2SeO3,记作SSe;4)高温联合ZnSO4处理:60℃热激20 min,4 mmol·L-1ZnSO4,记作HS;5)高温联合Na2SeO3处理:60℃热激20 min,0.1 mmol·L-1Na2SeO3,记作HSe;6)高温胁迫下ZnSO4联合Na2SeO3处理:60℃热激20 min,4 mmol·L-1ZnSO4+0.1 mmol·L-1Na2SeO3,记作HSSe。
芽苗共发芽6 d,第1 天均喷施20 mL 去离子水催芽,之后每隔24 h 将高温处理芽苗置于60℃恒温箱热激处理20 min[8,13],并对不同处理组分别喷施20 mL不同处理液至培养结束,发芽4 和6 d 时取样测定相关指标。
1.2.2 测定项目与方法
1.2.2.1 形态特征 从各处理组中随机选取10 株西兰花芽苗,摆放整齐后,用相机拍其形态特征。
1.2.2.2 芽长及鲜重 随机选取30 株西兰花芽苗,用游标卡尺测定其芽长,并用精密电子天平称量鲜重,计算单株芽苗鲜重。
1.2.2.3 硒元素含量 取5 g 芽苗,利用Delta 1-24 LSC 冷冻干燥机(德国Christ 公司)制备芽苗冻干样,再利用研钵将芽苗冻干样研磨成粉未状。 取芽苗冻干样品粉末0.1 g 于微波消解内罐中,加入5 mL 浓硝酸,加盖放置1 h,旋紧罐盖,按照MWD-520 微波消解仪(上海元析仪器有限公司)标准操作步骤进行消解,消解完成冷却后,挥发硝酸至0.5 mL,超纯水定容至10 mL 后用Optima 7300 DV 电感耦合等离子体光谱仪(美国PerkinElmer 公司)测定硒元素含量。
1.2.2.4 总抗氧化能力及丙二醛含量 利用总抗氧化能力(T-AOC)试剂盒(南京建成生物工程研究所)测定总抗氧化能力,参照硫代巴比妥酸法[14]测定丙二醛含量。
1.2.2.5 硫苷含量 参照Wei 等[15]的方法并稍做修改。 取0.2 g 芽苗,加入2 mL 75%煮沸甲醇,80℃恒温水浴中浸提15 min,10 000×g离心10 min,取上清依次加入1 mL 8 mmol·L-1氯化钯显色液、2 mL 0.15%羧甲基纤维素钠溶液,室温下显色6 h 后于540 nm 波长处测定吸光度值。
1.2.2.6 黑介子酶活性 参照Burow 等[16]的方法并稍做修改。 取0.2 g 芽苗,加3 mL 0.1 mol·L-1pH 值6.5 磷酸盐缓冲液冰浴研磨,4℃条件下10 000×g离心15 min,取上清液并利用蛋白质测定试剂盒(南京建成生物工程研究所)测定其蛋白质含量。 另取0.5 mL上清液与0.5 mL 0.25 mmol·L-1烯丙基硫苷溶液混合,于37℃水浴反应15 min 后置于沸水5 min,并利用葡萄糖测定试剂盒(南京建成生物工程研究所)测定葡萄糖含量。 以每分钟被黑芥子酶转化生成1 nmol葡萄糖为1 个酶活力单位(U·mg-1protein)。
1.2.2.7 异硫氰酸酯含量 参照Jiao 等[17]的方法并稍做修改。 取0.2 g 芽苗,加3 mL 蒸馏水研磨,匀浆液置于40℃水浴3 h,再加入3 mL 二氯甲烷震荡萃取30 min,10 000×g离心15 min,取下清液100 μL,依次加入2 mL 甲醇、1.8 mL 50 mmol·L-1硼酸缓冲液和0.2 mL 7 mmol·L-11,2-苯二硫醇的甲醇溶液,将混合液于65℃水浴反应1 h 后,于365 nm 波长处测定吸光度值。
1.2.2.8 萝卜硫素含量 参照郭丽萍[8]的方法测定。
1.2.3 萝卜硫素形成关键基因表达 按照植物RNA提取试剂盒(美国OMEGA 公司)说明书提取RNA,参考郭丽萍[8]、Ramos 等[18]进行引物设计(表1)。 参考郭丽萍[8]的荧光定量PCR 体系及反应条件,检测各基因的相对表达量。
1.3 数据统计与处理
试验设3 次重复,结果以平均值±标准差表示。试验数据采用统计分析软件18.0(SPSS 18.0)进行统计分析,均值间采用Tukey 法进行多重比较[19],在0.05 水平上进行显著检验(P<0.05),基因相对表达量采用2-ΔΔCt法[20]计算。
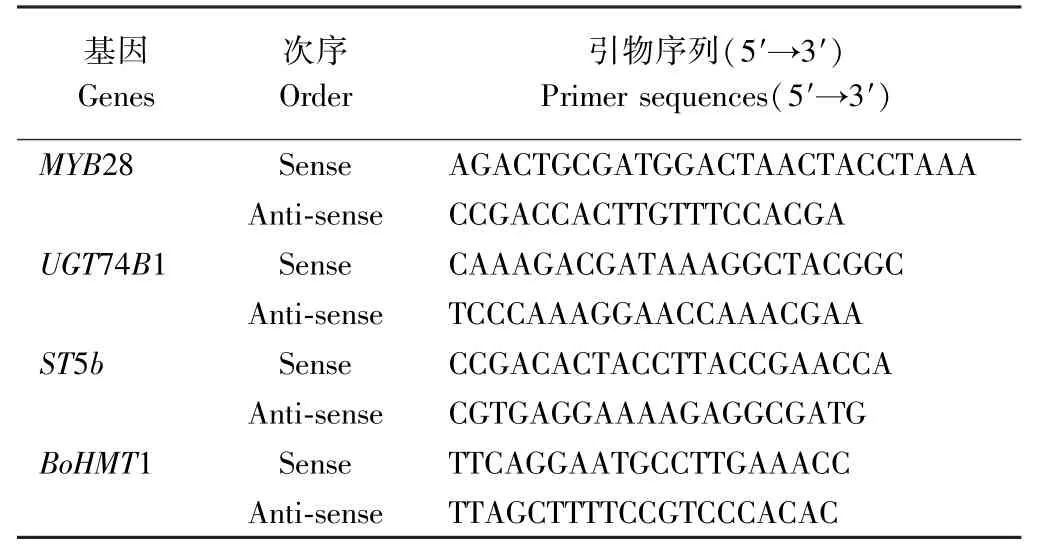
表1 西兰花芽苗相关基因引物序列Table 1 Related genes primer sequences of broccoli sprouts
2 结果与分析
2.1 高温胁迫下硒硫互作对西兰花芽苗生理代谢的影响
2.1.1 形态特征 由图1 可知,西兰花芽苗经高温处理后,其生长状较未经高温处理均受到影响,且发芽6 d 时经高温联合ZnSO4处理(HS)的西兰花芽苗受胁迫情况更严重,相较于对照(S)其芽苗及叶片大小均明显受到抑制,而经高温胁迫下ZnSO4联合Na2SeO3处理(HSSe)的芽苗及叶片大小相较于对照均无明显差异。 相较于高温联合ZnSO4处理,发芽4 d 时高温胁迫下ZnSO4联合Na2SeO3处理的西兰花芽苗叶片明显增大。

图1 高温胁迫下硒硫互作对西兰花芽苗形态表征的影响Fig.1 Effects of ZnSO4 and Na2SeO3 interaction on morphological characterization of broccoli sprouts under high temperature stress
2.1.2 芽长及鲜重 由图2 可知,发芽期间各处理组西兰花芽苗的芽长及鲜重均随着发芽时间的延长而升高,发芽6 d 时,高温联合ZnSO4处理下芽苗的芽长及鲜重均显著低于对照(P<0.05)。 发芽6 d 时,高温胁迫下ZnSO4联合Na2SeO3处理组芽苗芽长与对照无显著差异(P>0.05),但芽苗的芽长及鲜重均显著高于高温联合ZnSO4处理组(P<0.05),分别为高温联合ZnSO4处理组的1.24 和1.17 倍。 上述结果表明,Na2SeO3能在一定程度上缓解高温联合ZnSO4处理对西兰花芽苗的生长抑制作用。
2.1.3 硒元素含量 由图3 可知,发芽期间除ZnSO4及高温联合ZnSO4处理组,其他4 个处理组西兰花芽苗中硒元素含量整体均随着发芽时间的延长显著上升(P<0.05)。 发芽4 d 时,高温联合ZnSO4处理的芽苗中硒元素含量相较对照无显著差异(P>0.05);而高温胁迫下ZnSO4联合Na2SeO3处理组的芽苗中硒元素含量较对照及高温联合ZnSO4处理组均显著提高(P<0.05),其含量分别为对照和高温联合ZnSO4处理组的63.35、57.63 倍。 发芽6 d 时,各处理组芽苗中硒元素含量均较对照和高温联合ZnSO4处理组显著提高(P<0.05)。
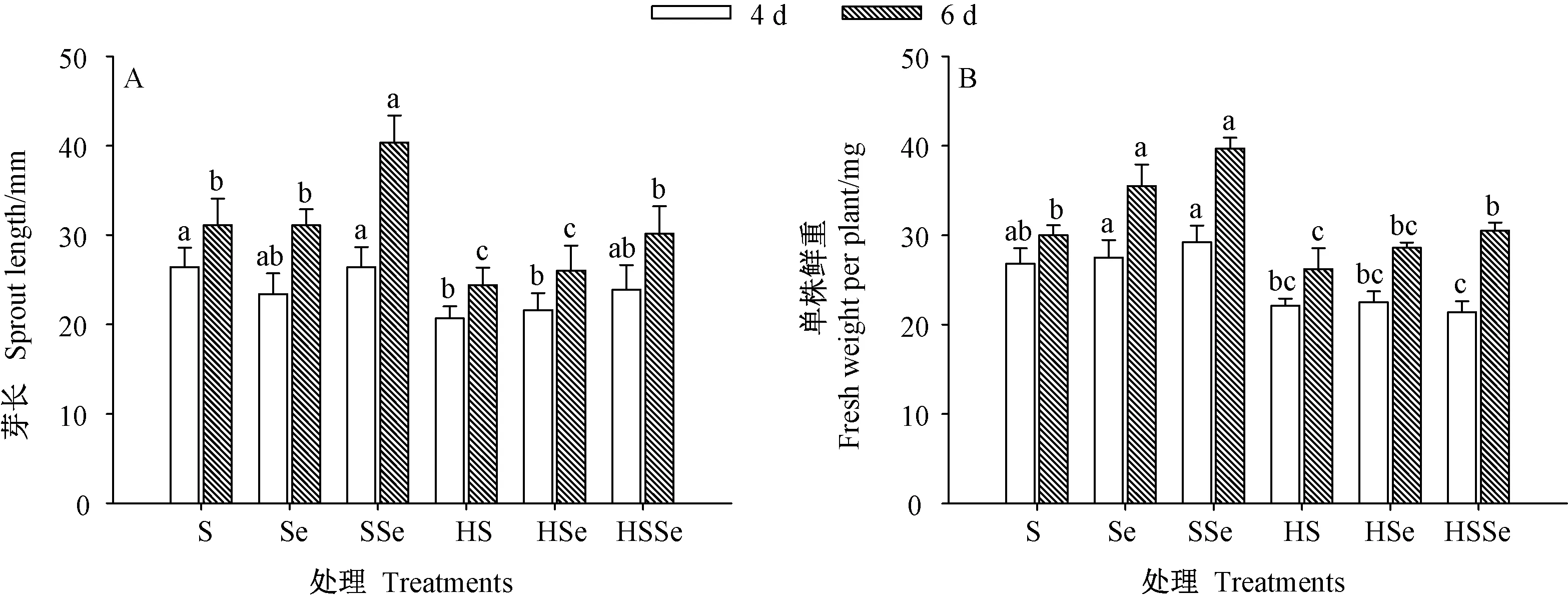
图2 高温胁迫下硒硫互作对西兰花芽苗芽长(A)及鲜重(B)的影响Fig.2 Effects of ZnSO4 and Na2SeO3 interaction on the sprout length (A) and fresh weight (B) of broccoli sprouts under high temperature stress
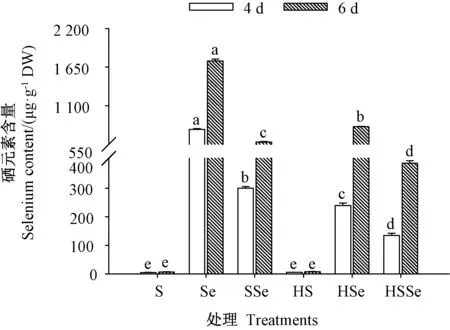
图3 高温胁迫下硒硫互作对西兰花芽苗硒元素含量的影响Fig.3 Effects of ZnSO4 and Na2SeO3 interaction on selenium content of broccoli sprouts under high temperature stress
2.1.4 总抗氧化能力及丙二醛含量 由图4 可知,发芽期间各处理组西兰花芽苗中总抗氧化能力及丙二醛含量均随着发芽时间延长而下降。 发芽4 和6 d 时,高温联合ZnSO4处理组芽苗的总抗氧化能力及丙二醛含量均较对照显著增加(P<0.05)。 发芽6 d 时,高温胁迫下ZnSO4联合Na2SeO3处理组芽苗的总抗氧化能力及丙二醛含量均较高温联合ZnSO4处理组显著下降(P<0.05)。 发芽4 d 时,高温联合ZnSO4处理组与高温胁迫下ZnSO4联合Na2SeO3处理组芽苗的总氧化能力及丙二醛含量均无显著差异(P>0.05),但均显著高于对照(P<0.05),其丙二醛含量分别是对照的1.59 和1.41 倍。 综上可知,芽苗经高温联合ZnSO4处理后其生长受到抑制,而高温胁迫下硒硫互作可在一定程度上缓解这种抑制作用。
2.2 高温胁迫下硒硫互作对西兰花芽苗萝卜硫素代谢指标的影响
2.2.1 硫苷含量 由图5 可知,发芽期间各处理组西兰花芽苗中硫苷含量均随着发芽时间的延长而下降。发芽4 d 时,高温胁迫下ZnSO4联合Na2SeO3处理组芽苗中硫苷含量较对照处理显著提高(P<0.05),而对照与高温联合ZnSO4处理组芽苗中硫苷含量无显著差异(P>0.05)。 发芽6 d 时,高温联合ZnSO4处理组与高温胁迫下ZnSO4联合Na2SeO3处理组芽苗中硫苷含量均较对照显著提高(P<0.05),其硫苷含量分别是对照的1.34 和1.35 倍。 结果表明,发芽4 d 时,西兰花芽苗经高温胁迫下ZnSO4联合Na2SeO3处理可显著提高硫苷含量。
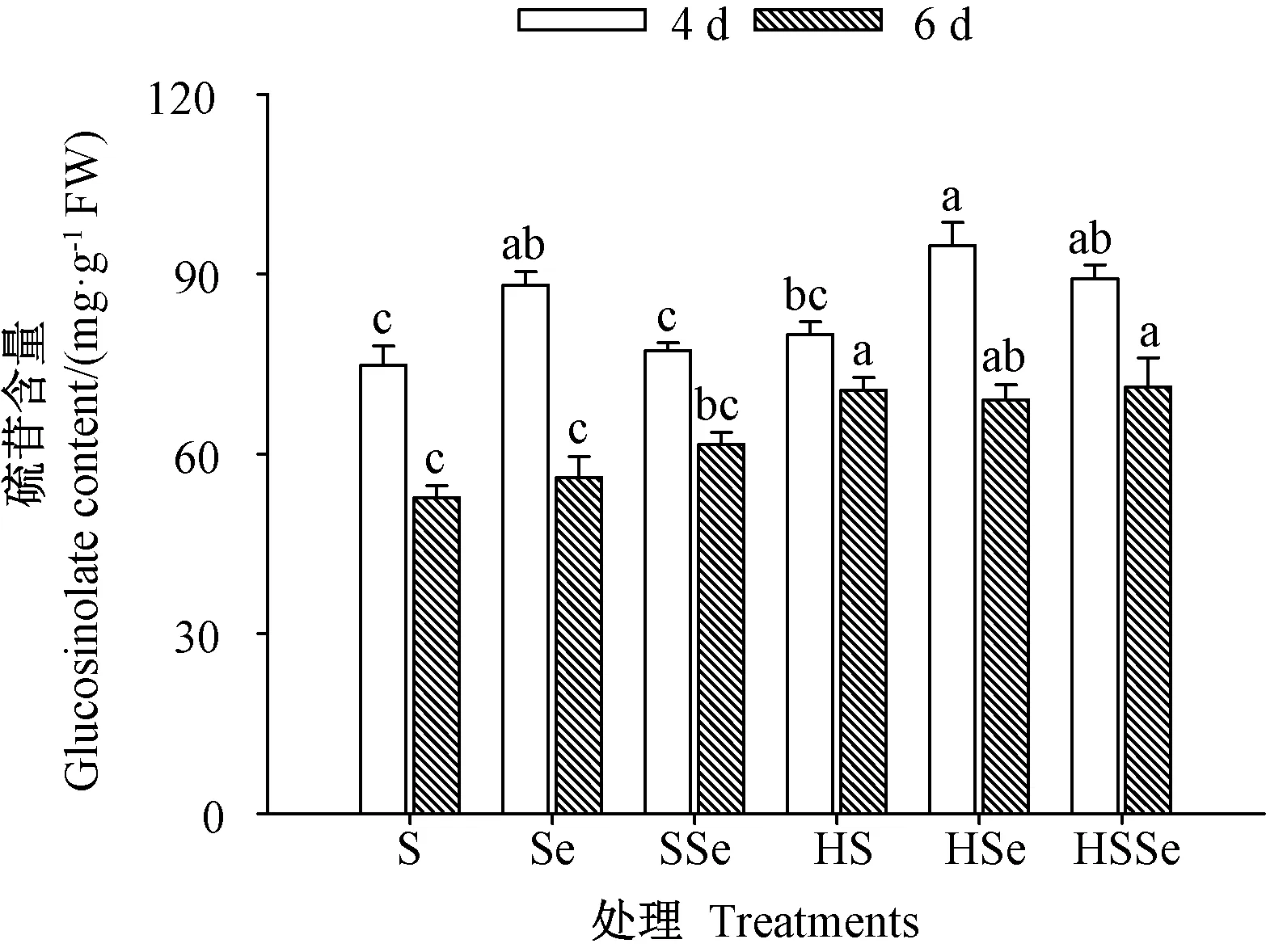
图5 高温胁迫下硒硫互作对西兰花芽苗硫苷含量的影响Fig.5 Effects of ZnSO4 and Na2SeO3 interaction on glucosinolate content of broccoli sprouts under high temperature stress
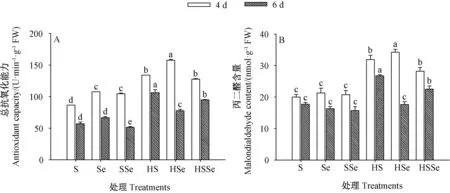
图4 高温胁迫下硒硫互作对西兰花芽苗总抗氧化能力(A)及丙二醛含量(B)的影响Fig.4 Effects of ZnSO4 and Na2SeO3 interaction on total antioxidant capacity (A) and malondialdehyde content (B) of broccoli sprouts under high temperature stress
2.2.2 黑介子酶活性 由图6 可知,发芽期间各处理组西兰花芽苗中黑介子酶活性均随着发芽时间延长而降低。 发芽4 d 和6 d 时,高温胁迫下ZnSO4联合Na2SeO3处理组芽苗的黑介子酶活性较对照及高温联合ZnSO4处理组均显著提高(P<0.05),发芽4 d 时高温胁迫下ZnSO4联合Na2SeO3处理组芽苗的黑介子酶活性达336.32 U·mg-1protein;对照与高温联合ZnSO4处理组芽苗的黑介子酶活性均无显著差异(P>0.05)。结果表明,高温处理对西兰花芽苗中黑介子酶活性无显著影响,但高温胁迫下硒硫互作有助于黑介子酶活性的提高,说明Na2SeO3能在一定程度上缓解高温联合ZnSO4处理对西兰花芽苗黑介子酶活性的抑制,提高黑介子酶活性。
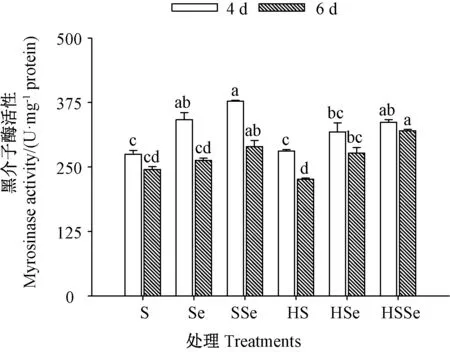
图6 高温胁迫下硒硫互作对西兰花芽苗黑介子酶活性的影响Fig.6 Effects of ZnSO4 and Na2SeO3 interaction on myrosinase activity of broccoli sprouts under high temperature stress
2.2.3 异硫氰酸酯含量 由图7 可知,发芽期间各处理组西兰花芽苗中异硫氰酸酯含量均随着发芽时间的延长而下降。 发芽4 和6 d 时,高温联合ZnSO4处理组与高温胁迫下ZnSO4联合Na2SeO3处理组芽苗中异硫氰酸酯含量均较对照显著提高(P<0.05),而高温胁迫下ZnSO4联合Na2SeO3处理组芽苗中异硫氰酸酯含量与高温联合ZnSO4处理组无显著差异(P>0.05)。发芽4 d 时,高温联合ZnSO4处理与高温胁迫下ZnSO4联合Na2SeO3处理组芽苗中异硫氰酸酯含量分别是对照的2.34 和2.37 倍,其中高温胁迫下ZnSO4联合Na2SeO3处理组芽苗中硫氰酸酯含量达222.57 mg·100g-1FW。结果表明,高温联合ZnSO4处理相较对照可显著提高西兰花芽苗中异硫氰酸酯含量,而高温胁迫下硒硫互作相较高温联合ZnSO4处理对芽苗中异硫氰酸酯含量的提高无显著作用。
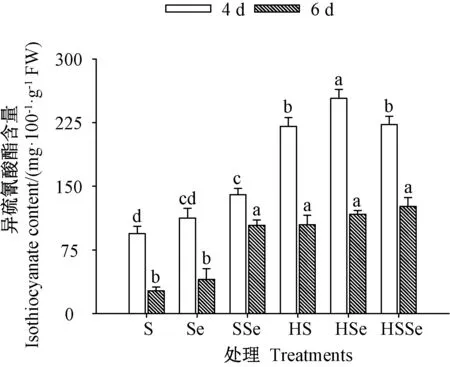
图7 高温胁迫下硒硫互作对西兰花芽苗异硫氰酸酯含量的影响Fig.7 Effects of ZnSO4 and Na2SeO3 interaction on isothiocyanate content of broccoli sprouts under high temperature stress

图8 高温胁迫下硒硫互作对西兰花芽苗萝卜硫素含量的影响Fig.8 Effects of ZnSO4 and Na2SeO3 interaction on sulforaphane content of broccoli sprouts under high temperature stress
2.2.4 萝卜硫素含量 由图8 可知,发芽期间各处理组西兰花芽苗中萝卜硫素含量均随着发芽时间的延长而下降。 发芽4 和6 d 时,高温联合ZnSO4处理组与高温胁迫下ZnSO4联合Na2SeO3处理组芽苗中萝卜硫素含量均较对照显著提高(P<0.05),且高温胁迫下ZnSO4联合Na2SeO3处理组芽苗中萝卜硫素含量显著高于高温联合ZnSO4处理组(P<0.05)。 发芽4 d 时,高温胁迫下ZnSO4联合Na2SeO3处理组与高温联合ZnSO4处理组芽苗中萝卜硫素含量分别是对照的1.39和1.31 倍。 结果表明,高温胁迫下硒硫互作可显著提高西兰花芽苗中萝卜硫素含量,且发芽4 d 时芽苗中萝卜硫素含量最高,达149 mg·100g-1FW。
2.3 高温胁迫下硒硫互作对西兰花芽苗关键基因表达的影响
由图9 可知,发芽期间各处理组西兰花芽苗中各关键基因相对表达量均随着发芽时间的延长而降低。发芽4 d 时,高温联合ZnSO4处理组与高温胁迫下ZnSO4联合Na2SeO3处理组芽苗中MYB28、UGT74B1及ST5b的表达量均较对照显著提高(P<0.05),但BoHMT1 的表达量却较对照显著下降(P<0.05)。 发芽4 d 时,高温胁迫下ZnSO4联合Na2SeO3处理组芽苗中MYB28 和BoHMT1 的表达较高温联合ZnSO4处理显著提高(P<0.05),但UGT74B1 的表达量较高温联合ZnSO4处理组显著下降(P<0.05),两处理组之间ST5b的表达量无显著差异(P>0.05)。 发芽4 d 时,高温胁迫下ZnSO4联合Na2SeO3处理组与高温联合ZnSO4处理芽苗中转录因子MYB28 的相对表达量分别是对照的3.42 和2.34 倍。 发芽6 d 时,MYB28 的相对表达量在对照、高温联合ZnSO4处理组及高温胁迫下ZnSO4联合Na2SeO3处理这3 个处理间无显著差异(P>0.05)。 结果表明,发芽4 d 时高温胁迫下硒硫互作可显著提高西兰花芽苗中相关基因表达,从而有效实现芽苗中萝卜硫素的富集。
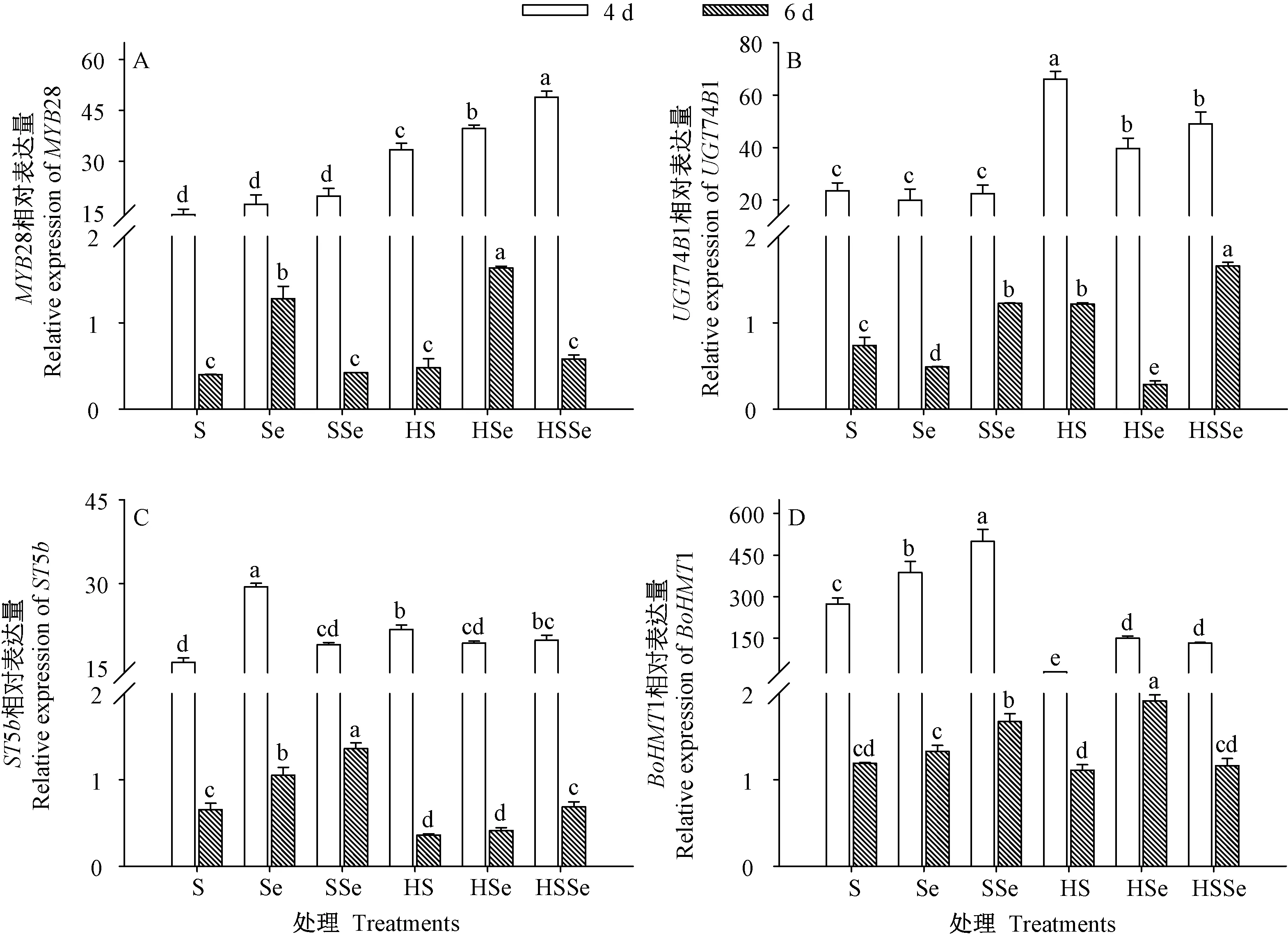
图9 高温胁迫下硒硫互作对西兰花芽苗MYB28(A)、UGT74B1(B)、ST5b(C)及BoHMT1(D)基因表达的影响Fig.9 Effects of ZnSO4 and Na2SeO3 interaction on the expression of MYB28 (A), UGT74B1 (B),ST5b (C) and BoHMT1 (D) genes of broccoli sprouts under high temperature stress
3 讨论
在盐[21]、冷害、高温、低氧等逆境胁迫下,植物的生物膜会受到严重损伤,导致活性氧代谢失衡,同时影响植物体内的大分子物质代谢,从而影响植物的正常生长和发育[22-23]。 一般陆生高等植物热害界限温度大于35℃,胁迫时间越短植物忍耐的温度越高。 本研究中,西兰花发芽期间经60℃高温联合ZnSO4处理后,芽苗生长发育受到抑制,植株生长形态较小,芽长显著降低(P<0.05),但芽苗经高温胁迫下硒硫互作处理后,其芽长和鲜重均显著提高(P<0.05),表明Na2SeO3能在一定程度上缓解高温联合ZnSO4处理对西兰花芽苗生长的抑制作用。 植物器官衰老或在逆境下遭受伤害,导致细胞膜膜脂过氧化,丙二醛是膜脂过氧化的最终分解产物,其含量可以反映植物遭受逆境伤害的程度,同时,丙二醛的产生还能加剧膜的损伤,间接反映植物组织的抗氧化能力[14]。 西兰花芽苗经高温胁迫下硒硫互作处理后,芽苗丙二醛含量均较对照显著提高(P<0.05),说明高温胁迫下硒硫互作导致西兰花芽苗膜损伤严重。 Pe~nas 等[24]和Tian 等[25]发现适宜浓度硒处理可提高西兰花芽苗抗氧化能力,本研究同样发现高温胁迫下硒硫互作处理后芽苗抗氧化能力增强。
非生物胁迫,如干旱、盐、CO2浓度增加等能够引起植物损伤,并诱导次生代谢产物的增加[26-27]。 萝卜硫素作为十字花科植物中抗癌作用最强的天然活性成分[3],备受科研工作者的关注。 本研究结果显示,高温胁迫下硒硫互作处理与高温联合ZnSO4处理后西兰花芽苗中硫苷及萝卜硫素含量均较对照显著提高(P<0.05),且高温胁迫下硒硫互作处理后西兰花芽苗中萝卜硫素含量显著高于高温联合ZnSO4处理(P<0.05),即高温联合Na2SeO3相较单独两种胁迫具有协同效应。 西兰花发芽期间经高温处理,同时联合喷施硒和硫是提高西兰花芽苗中萝卜硫素含量的有效方式。 黑介子酶是水解GRA 产生萝卜硫素的关键酶。本研究中高温胁迫下硒硫互作处理的西兰花芽苗中黑介子酶活性较对照显著提高(P<0.05),这与芽苗中萝卜硫素含量提高相一致,说明高温胁迫下硒硫互作处理可能通过提高黑介子酶活性进而促进萝卜硫素富集。 本研究还发现,高温胁迫下硒硫互作处理较对照显著降低了硒代氨基酸合成相关基因BoHMT1 的表达(P<0.05)。 转录因子MYB28 是黑芥子酶合成关键基因[28],UGT74B1 和ST5b作为主要基因参与植物中硫苷的合成[29]。 拟南芥在葡萄糖处理下通过促进MYB28 的表达从而提高了脂肪族硫苷含量[30]。 本研究结果显示,高温胁迫下硒硫互作处理显著提高了西兰花芽苗中MYB28 及UGT74B1、ST5b的转录水平,这可能是西兰花芽苗积累GRA 并实现萝卜硫素富集的原因。
4 结论
西兰花芽苗发芽期间经高温胁迫下硒硫互作,其芽苗生长发育情况较单独硫酸锌处理生长抑制得到明显缓解,硒元素含量显著增加(P<0.05),芽苗总抗氧化能力显著增加(P<0.05),MYB28、UGT74B1 及ST5b的表达量均显著提高(P<0.05),但BoHMT1 的表达量显著 下降(P<0.05)。 高 温 胁 迫 下ZnSO4联 合Na2SeO3处理后西兰花芽苗中硫苷含量、黑介子酶活性、异硫氰酸酯含量和萝卜硫素含量均较对照显著提高(P<0.05)。 西兰花芽苗经高温胁迫下硒硫互作处理4 d,其萝卜硫素含量最高,表明高温胁迫下硒硫互作是富集西兰花芽苗中萝卜硫素的有效方式。
