茶树凋落叶浸提液对菘蓝生理生化的化感效应
2020-06-30沙俊涛陈青青缪雨静屈仁军唐晓清房婉萍
沙俊涛 陈青青 缪雨静 屈仁军 唐晓清 房婉萍
(南京农业大学园艺学院,江苏 南京 210095)
化感作用是农业生产中重要的化学生态现象。 研究药用植物与其他植物之间的化感作用,建立合理的轮作、间作和套作的耕作制度,能够有效地控制田间杂草、降低作物之间的负效应,提高药材的质量、产量和土地的产出率[1]。 植物残体凋落物分解是化感物质释放的途径之一。 通过雨雾淋溶、微生物、动植物与人类活动等直接或间接参与植物残体凋落物的破碎、搬运等过程,这些植物残体在分解过程中释放出化感物质,进入土壤发挥化感作用,直接或间接对邻近的微生物、动植物及自身的生长发育产生抑制或促进作用[2]。
茶树(Camellia sinensis)为山茶科山茶属多年生常绿小灌木,是我国传统的经济作物。 我国茶园常采用单行双株,行距120 cm,间距25 ~28 cm 的种植方式[3]。 茶农往往间作种植其他植物以改变长期单一种植茶树引起的土壤酸化、土壤结构变差等问题[4]。研究发现,茶园种植银杏(Ginkgo biloba)、 紫苏(Ocimum basilicum)、龙胆(Gentiana rigescens)等药用植物,不仅可以有效地利用化感作用控制田间杂草,改善茶园的土壤物理性状及养分,增加生态系统的多样性,同时还能提高药材的质量、产量、活性成分以及茶叶的品质,这种“茶树+药用植物”组合的新发展模式正在成为发展生态茶园经济的热点[5-7]。 茶树为常绿植物,每月都会发生茶树叶片的脱离,据报道,茶树在5 月落叶量最多,约50 g·m-2,在1 月落叶量最少,约6 g·m-2[8]。 研究表明,茶树残体凋落物在分解过程中会释放多酚类、有机酸类、咖啡碱等化感物质,这些物质进入茶园土壤会导致土壤酸化,影响周围其他植物的生长[4,9-10],因此选择适宜的药用植物间作是提升生态茶园中茶叶和药用植物产量与品质的关键。 菘蓝(Isatis indigoticaFort.)为十字花科菘蓝属两年生草本植物,其干燥叶入药为大青叶,具有清热解毒、凉血消斑的功效[11]。 菘蓝适宜生长在中性或弱酸性的土壤,陈平[12]发现菘蓝-核桃林药复合系统可以改善土壤水分状况、降低耗水量、提高水分利用效率及产值,为菘蓝能够种植于茶园提供了理论基础和现实依据。 但目前尚不清楚茶树凋落叶化感作用对菘蓝生长和品质产生的影响。 为此,本研究以茶树凋落叶浸提液(leaf litter extracts ofC. sinensis,LLEC)为供体,模拟茶树残体分解和淋溶条件下的茶园微环境,通过测定LLEC处理后菘蓝细胞膜损伤率、抗氧化酶活性及其基因表达量、可溶性糖、可溶性蛋白、脯氨酸、丙二醛(malondialdehyde,MDA)、过氧化氢(H2O2)、靛玉红、靛蓝和总黄酮含量等指标,探讨茶园环境对菘蓝生长的化感作用,以期为幼龄茶园茶-药复合种植模式的推广提供科学参考。
1 材料与方法
1.1 供试材料
试验于2017 年12 月中旬,在江苏省南京中山陵茶厂雨花茶生产基地(32.05°N,118.84°E)进行。 随机收集掉落在地面的雨花茶树的干枯叶片,自然阴干,粉碎过65 目筛,于阴凉干燥处保存备用。 受试材料为安徽亳州菘蓝居群,经南京农业大学王康才教授鉴定为十字花科菘蓝(Isatis indigoticaFort.)的角果(生产中称为种子)。
1.2 茶树凋落叶浸提液的制备
水浸提法是研究植物化感作用的常用方法[13],茶树凋落叶的浸提液能较好地模拟茶园的环境。 称取50 g 茶树凋落叶粉末,置于锥形瓶中,加入1 000 mL蒸馏水,定期搅拌振荡,浸泡48 h 后用4 层灭菌医用纱布过滤,得到浓度为50 mg·mL-1的茶树凋落叶浸提液。 参照邓骛远[14]茶树叶水浸提液的浓度梯度,并通过前期预试验对茶树凋落叶浸提液浓度做出适当调整,从中筛选出5 个浓度梯度,用去离子水将母液分别配置成6.25、12.5、25 和50 mg·mL-1的处理液,记作T1、T2、T3、T4;以去离子水作对照,记作CK,置于4℃冰箱待用。 同时用pH-20+笔式pH 计(杭州齐威仪器有限公司)测定CK、T1、T2、T3、T4 5 种溶液的pH 值分别为7.0、6.1、5.8、5.5、5.1。
1.3 试验设计
试验于2018 年4 月2 日播种,选取成熟度一致的菘蓝种子,基质为蛭石和珍珠岩,比例为1 ∶2。 待幼苗长出6 片真叶时,选择长势一致的幼苗移栽至塑料盆(高15 cm,直径20 cm,基质重1 kg),每盆6 株幼苗,按CK、T1、T2、T3、T4 设置5 个处理,每个处理10 盆,置于大棚内避雨处理,每隔3 d 浇灌1 次不同浓度的浸提液,每次50 mL,保持基质湿润(根据预试验结果,每千克基质每次浇灌50 mL 浸提液可保持基质湿度基本不变,接近自然条件下雨雾淋溶后土壤湿润的状态)。 60 d 后结束浇灌(该时期与实际生产中第一茬大青叶采收期基本一致),进行形态指标、生理生化指标的测定。
1.4 测定项目与方法
1.4.1 菘蓝生长指标的测定 随机从塑料盆中选取10 株菘蓝,洗净拭干后测定其生物量、株高等生长指标,随后105℃杀青15 min,60℃烘干至恒重。 干燥叶粉碎后过65 目筛,用于总黄酮、靛蓝和靛玉红含量的测定。
叶面积:随机选取各处理相同部位平整完整的菘蓝叶片,采用LI-3000C 型便携式叶面积仪(北京力高泰科技有限公司)测定叶面积。
1.4.2 可溶性糖、可溶性蛋白和脯氨酸含量的测定 参照王学奎[15]的方法。 取菘蓝相同部位的叶片0.1 g,采用蒽酮法测定可溶性糖含量;同上,取0.5 g 叶片采用考马斯亮蓝染色法测定可溶性蛋白质含量;另取0.5 g 叶片采用茚三酮法测定脯氨酸含量。 每次试验重复3 次。
1.4.3 MDA、H2O2含量和细胞损伤率的测定 取菘蓝相同部位的叶片0.5 g, 采用硫代巴比妥酸(thiobarbituric acid,TBA)法测定MDA 含量[15]。 同1.4.2,取叶片2 g,置于40℃恒温箱内萎蔫1 h,经真空干燥机处理后在20 ~25℃恒温静置20 min,用EC-861 笔式电导仪(EXTECH,美国)测定电导率,再放入100℃沸水浴15 min,冷却后在20~25℃恒温下测定其煮沸电导率,按照公式计算细胞膜损伤率:
细胞膜损伤率=处理电导率/煮沸电导率×100%。
同上,取叶片0.1 g,利用南京建成生物研究所提供的试剂盒测定H2O2含量。 每次试验重复3 次。
1.4.4 抗氧化酶活性的测定 取菘蓝相同部位的叶片0.5 g,利用南京建成生物研究所提供的试剂盒测定超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(peroxidase,POD)、过氧化氢酶(catalase,CAT)和抗坏血酸氧化物酶(ascorbate peroxidase,APX)活性。每次试验重复3 次。
1.4.5 抗氧化酶基因表达量分析 利用EASY spin植物RNA 快速提取试剂盒(北京百奥莱博科技有限公司)提取菘蓝叶片的RNA,并以1.6%琼脂糖凝胶电泳检测RNA 的完整性,测定其浓度和纯度;cDNA 的合成和荧光定量表达量参照试剂盒说明书操作。 定量PCR 反应体系为20 μL:Real-time PCR Master Mix 10 μL,ddH2O 5.6 μL,template DNA 2 μL,Primer 2 μL,50×ROX1 0.4 μL。 PCR 扩增程序:94℃预变性5 min;94℃变性30 s,50℃退火30 s,72℃延伸2 min,循环15次;72℃延伸5 min,15℃保存。 采用primer premier 5设计引物序列(表1)。

表1 实时荧光定量PCR 引物序列Table 1 Real-time PCR primer sequences
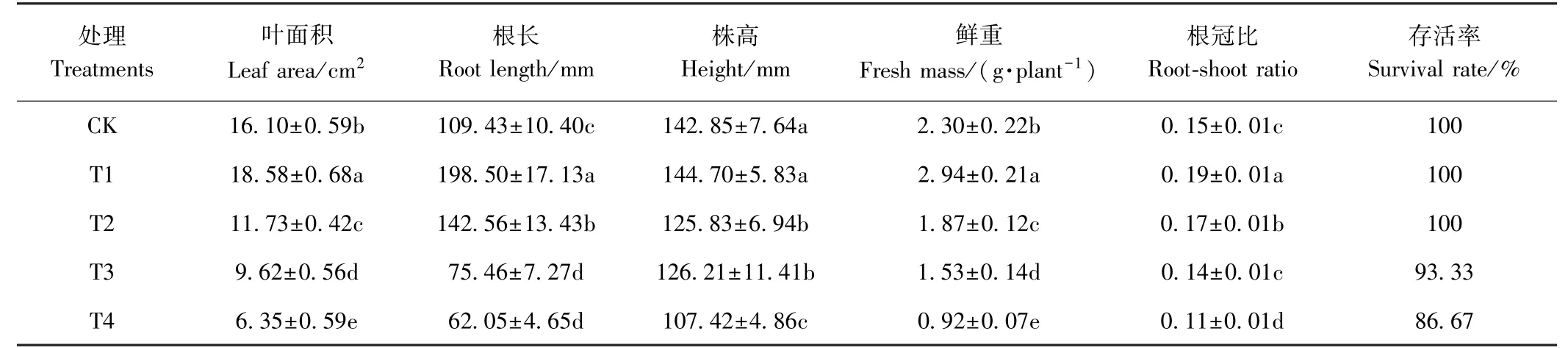
表2 茶树凋落叶浸提液对菘蓝生长的影响(n=10)Table 2 Effect of LLEC on growth of I. indigotica (n=10)
1.4.6 靛蓝和靛玉红含量的测定 取0.1 g 干燥菘蓝叶片粉末,参照《中华人民共和国药典》 (2015版)[11]略作修改, 采用超高效液相色谱(ultra performance liquid chromatography, UPLC)法测定靛玉红和靛蓝的含量。 色谱条件:分析柱(Aglient ZORBA×Eclidise Plus C18)柱温30℃;流动相为v(甲醇) ∶v(水)=72 ∶28;流速0.30 mL·min-1;检测波长289 nm;进样体积2 μL。 以靛玉红和靛蓝的色谱峰面积为纵坐标,其对应的含量为横坐标作标准曲线,计算回归方程。 靛玉红的回归方程为:y=158.39x-72.629,R2=0.997(n=3),线性范围:0 ~10 μg·mL-1;靛蓝的回归方程为:y=16.55x+84.195,R2=0.998(n=3),线性范围:0~2 μg·mL-1。 每次试验重复3 次。
1.4.7 总黄酮含量的测定 取0.1 g 干燥菘蓝叶片粉末,参照Liu 等[16]的方法提取菘蓝叶粉末中的总黄酮,并通过AlCl3比色法[17]以芦丁为对照品绘制得到标准曲线来计算总黄酮含量。 每次试验重复3次。
1.5 数据处理与分析
采用Excel 2017 进行数据处理,采用SPSS 19.0对结果进行方差分析和相关性分析。 采用Pearson 相关性分析法对抗氧化酶及其基因表达量进行双变量相关分析。
2 结果与分析
2.1 茶树凋落叶浸提液对菘蓝生长的影响
由表2 可知,经茶树调落叶浸提液处理后,菘蓝的叶面积、根长、株高、鲜重和根冠比均呈先上升后下降的趋势,各项生长指标均在T1 时达到最大值。 这是因为茶树凋落叶中少量的化感物质能够刺激菘蓝根系生长,增加植株的根冠比,保障地上部生长所需的养分供给,进而促进叶面积、株高、鲜重增加。 随着茶树调落叶浸提液浓度的升高,其对菘蓝生长的化感抑制作用逐渐增强,其中T4 受到的化感抑制作用最强,与CK相比,T4 叶面积、根长、株高、鲜重和根冠比分别下降了60.56%、43.30%、24.80%、60.00%、26.67%。 当茶树调落叶浸提液浓度小于12.5 mg·mL-1(T2)时不会影响菘蓝的存活率,而浸提液浓度超过25 mg·mL-1(T3)时植株出现死亡现象,存活率下降。
2.2 茶树凋落叶浸提液对可溶性糖、可溶性蛋白、脯氨酸含量的影响
由表3 可知,随着茶树调落叶浸提液浓度的升高,菘蓝叶片中的可溶性糖含量呈先上升后下降的趋势,T3 的可溶性糖含量最高,为CK 的1.41 倍,T4 的可溶性糖含量与其他处理相比显著降低(P<0.05)。 T1 的可溶性蛋白含量与CK 间无显著差异(P>0.05),而T2、T3、T4 的可溶性蛋白含量持续降低,较CK 分别显著下降了12.35%、21.61%、40.14%。 叶片的脯氨酸含量随着茶树调落叶浸提液浓度的升高整体呈增加趋势,且浸提液处理组的脯氨酸含量均显著高于CK(P<0.05),T1、T2、T3、T4 的脯氨酸含量分别是CK 的1.10、1.08、1.59 和2.10 倍。

表3 茶树凋落叶浸提液对菘蓝可溶性糖、可溶性蛋白、脯氨酸含量的影响(n=3)Table 3 Effects of LLEC on the content of soluble sugar, soluble protein and proline in I.indigotica(n=3)
2.3 茶树凋落叶浸提液对菘蓝细胞膜损伤率、MDA、H2O2 含量的影响
T1 菘蓝叶片中的MDA 含量与CK 相比无显著差异(P>0.05),而随着茶树凋落叶浸提液浓度的升高,T2、T3、T4 的MDA 含量均较CK 显著增加(P<0.05),增幅分别为27.82%、28.85%、44.84%(图1-A)。 与CK 相比,T1、T2 菘蓝叶片的细胞膜损伤率和H2O2含量差异不显著(P>0.05),而T3、T4 的细胞膜损伤率和H2O2含量均显著升高(P<0.05)(图1-B、C)。
2.4 茶树凋落叶浸提液对菘蓝抗氧化酶系统的影响
2.4.1 抗氧化酶活性及其基因表达量 由图2 可知,不同浓度茶树凋落叶浸提液处理后,菘蓝的抗氧化酶系统受到了不同程度的损伤。 与CK 相比,T1 的SOD活性差异不显著(P>0.05),而T2、T3、T4 的SOD 活性均显著降低(P<0.05)。 T1 的POD 和APX 活性最高,与CK 相比分别提高了12.93%、13.81%。 T1 与T2 的CAT 活性高于CK,其中T2 活性显著高于CK(P<0.05),T3 与T4 的CAT 则显著低于CK(P<0.05)。当浸提液浓度大于25 mg·mL-1(T3)时,茶树凋落叶浸提液对菘蓝抗氧化酶活性的抑制作用增强,T3、T4 的4 种抗氧化酶活性均显著低于CK(P<0.05)。
由图3 可知,茶树凋落叶浸提液会影响菘蓝的抗氧化酶基因表达,总体上,随着浸提液浓度的升高,4种抗氧化酶基因表达量均呈先上升后下降的趋势。T1 的Pod、Cat、Apx基因表达量最高,而其Fesod基因表达量与CK 相比差异不显著(P>0.05)。 T2 的Fesod和Pod基因表达量均显著高于CK(P<0.05),而Cat、Apx基因表达量与CK 相比差异不显著(P>0.05)。 T4的4 种抗氧化酶基因表达量均最低,且显著低于CK(P<0.05)。
2.4.2 抗氧化酶活性及其基因表达量的相关性 由表4 可知,POD 活性与其基因表达量的相关系数为0.92,呈著正相关性(P<0.05)。 SOD、CAT 和APX 活性与其基因表达量相关性不显著。

表4 抗氧化酶活性及其基因表达量的相关系数Table 4 Correlation coefficients of antioxidant enzyme activities and gene expressions

图1 茶树凋落叶浸提液对菘蓝MDA 含量(A)、细胞膜损伤率(B)、H2O2 含量(C)的影响(n=3)Fig.1 Effects of LLEC on MDA content(A), cell membrane damage(B), H2O2 content(C) of I. indigotica(n=3)

图2 茶树凋落叶浸提液对菘蓝SOD(A)、POD(B)、CAT(C)和APX(D)活性的影响(n=3)Fig.2 Effects of LLEC on the activities of SOD(A), POD(B), CAT(C) and APX(D) in I. indigotica (n=3)

图3 茶树凋落叶浸提液对菘蓝Fesod(A)、Pod(B)、Cat(C)、Apx(D)基因相对表达量的影响(n=3)Fig.3 Effects of LLEC on relative expression level of Fesod(A)、Pod(B)、Cat(C)、Apx(D)in I. indigotica (n=3)
2.5 茶树凋落叶浸提液对菘蓝叶内靛玉红、靛蓝和总黄酮含量的影响
随着茶树调落叶浸提液浓度的升高,菘蓝叶内的先上升后下降的趋势,与CK 相比,T1、T2 的靛蓝含量显著增加(P<0.05),增幅分别为29.65%、33.82%,T3、T4 的靛蓝含量显著减少(P<0.05),靛蓝含量呈降幅分别为13.90%、42.64%(图4-A);菘蓝叶片内靛玉红含量,T1 最高,T1 和T4 均显著高于CK(P<0.05),而T3 与CK 相比差异不显著(P>0.05)(图4-B);叶片总黄酮含量随着浸提液浓度的升高持续增加,T4 的总黄酮含量最高,较CK 显著增加了32.97%(图4-C)。
3 讨论
3.1 菘蓝生长对茶树潜在化感物质的响应
菘蓝分布广,对环境适应性强,是发展林药复合种植模式的重要药用植物,目前核桃林[12]、油茶林、侧柏林、落叶松林[18]等均能复合种植菘蓝。 在林药复合种植模式下,药用植物的化感作用是判断其适应性的重要指标。 王道金等[19]通过分析知母、桔梗、白术、板蓝根和紫丹参的光响应参数,并对其根部浸提液进行生物测定,发现菘蓝、知母、紫丹参较适宜在杨树林下种植。 由于化感物质的双重质量浓度效应,同一化感物质对受体植物的生长,可能会出现“低促高抑”的现象[20]。 如低浓度的核桃叶水浸提液对白术幼苗的生物量、地径、株高等生长指标有促进作用,而高浓度则抑制其生长[21]。 本研究同样发现,LLEC 对菘蓝生长表现出低浓度促进、高浓度抑制的作用特征,当浸提液浓度为6.25 mg·mL-1(T1)时,菘蓝的单株鲜重、叶面积、株高、根长和根冠比高于CK,说明茶树凋落叶分解过程中,少量的化感物质有利于菘蓝的根系伸长和根冠比增加,保障地上部生长所需的养分供给,促进植株生长;而浸提液浓度大于12.5 mg·mL-1(T2)时,菘蓝的生物量和形态指标都受到不同程度的抑制。 研究发现,茶树化感物质的产生与种植密度、土壤、温度、光照等环境因子有关,释放的酚类、有机酸类、醛类、单萜烯醇和芳香族醇等化感物质会影响周围其他植物的生长[22-23]。 因此,结合茶园的实际情况,在种植菘蓝时,可通过调整种植密度、勤采茶叶、清理落叶等田间管理,减少化感物质的产生,创造有利于菘蓝生长的环境条件。
3.2 茶树凋落叶浸提液对菘蓝渗透调节的影响

图4 茶树凋落叶浸提液对菘蓝叶内靛蓝(A)、靛玉红(B)和总黄酮(C)含量的影响(n=3)Fig.4 Effects of LLEC on indigo content(A), indirubin content(B) and total flavonoid content (C) in leaves of I. indigotica (n=3)
逆境胁迫条件下,植物细胞内的可溶性糖、可溶性蛋白、脯氨酸等渗透调节物质含量增加,细胞液浓度升高,以维持细胞膨压的正常,增强植物的抗逆性[24]。本研究结果表明,T1、T2 菘蓝叶片中的可溶性糖、和脯氨酸含量与CK 相比显著增加,说明在轻度化感胁迫时,菘蓝可通过增加渗透调节物质的方式,提高细胞溶质浓度,降低渗透势,稳定膨压,维持体内水分和细胞生理过程的正常进行。 T4 的可溶性糖和可溶性蛋白含量达到最低值,而脯氨酸含量达到最大值,可能是因为可溶性糖的渗透调节作用具有一定的局限性,重度化感胁迫使菘蓝的渗透调节能力降低,导致可溶性糖的合成量减少。 可溶性糖是蛋白质合成过程中提供碳架和能量的来源,同时也能间接转化为脯氨酸,在重度化感胁迫下,当可溶性糖和可溶性蛋白合成受阻时,菘蓝叶片中一部分可溶性糖转化为脯氨酸,导致其含量显著增加[25]。
3.3 菘蓝抗氧化酶防御系统对茶树凋落叶浸提液的应答
化感物质进入植物体内将打破活性氧生成与清除的平衡状况,导致植物体活性氧增多,加剧膜质过氧化,从而破坏膜结构,增加膜透性,其中间产物自由基和最终产物MDA 会对抗氧化酶系统产生影响[26-27]。研究表明,少量活性氧能够诱导抗氧化酶基因表达量上调,提高抗氧化酶活性[28];而过量活性氧会破坏抗氧化酶系统,导致抗氧化酶基因表达量下调,降低抗氧化酶活性[29-30]。 陈斌等[28]发现在土荆芥的挥发油及其2 种主要成分(α-萜品烯和伞花素)的化感胁迫下,玉米幼根抗氧化酶基因的表达受到影响,抗氧化酶活性下降。 本研究中,T1 菘蓝的Pod、Cat和Apx基因表达量上调,POD、CAT 和APX 活性均高于CK,说明低浓度浸提液能够诱导菘蓝体内抗氧化酶基因表达量上调,提高抗氧化酶活性,以清除菘蓝体内的活性氧,减轻过氧化伤害,维持植株正常的生长发育。 随着浸提液浓度的进一步提高,T2、T3 和T4 菘蓝的抗氧化酶活性及其基因表达量总体呈下降趋势,菘蓝植株的长势也逐渐变差。 T4 的浸提液浓度超过了菘蓝的耐受阈值,H2O2、MDA 含量增加、细胞膜损伤率上升,菘蓝抗氧化系统的调控机制遭受破坏,Fesod、Pod、Cat和Apx基因表达量均较CK 显著下调,4 种抗氧化酶活性也显著降低,这可能是茶树凋落叶中的化感物质积聚在菘蓝植株体内,抗氧化酶系统遭受不同程度的破坏,活性氧大量产生,且未能得到及时清除,导致细胞膜严重受损,膜电阻和膜流动性下降,胞内物质外渗,造成其代谢紊乱[31-32],最终出现萎蔫甚至死亡的现象。
抗氧化酶基因的表达水平复杂,基因转录和表达水平受到植物种类、胁迫类型与强度、组织部位等多种因素的影响[33]。 本研究发现,在化感胁迫下,POD 活性与基因表达量呈显著正相关,二者变化趋势基本一致;而SOD、CAT 和APX 活性与其基因表达量的相关性不显著,二者变化趋势不一致,这可能是因为抗氧化酶基因的mRNA 在翻译成蛋白质的过程中,化感胁迫产生的过量活性氧,使蛋白质翻译后修饰受到影响,导致蛋白质的功能、结构和稳定性发生改变,影响了抗氧化酶的活性[34];此外,抗氧化酶活性并不是直接由转录水平控制,而是由转录后抗氧化酶系统的调控作用所决定,多种因素影响抗氧化酶活性及其基因表达量,因此它们的变化趋势存在差异[35]。
3.4 茶树凋落叶浸提液对菘蓝非酶类抗氧化防御系统的影响
植物次生代谢产物(如类黄酮、生物碱等)是非酶类抗氧化防御系统中清除活性氧的物质[36]。 在环境胁迫下(如盐胁迫、高温、干旱等),药用植物体内将发生一系列变化以适应环境,类黄酮、生物碱等次生代谢产物在植物体内积累防止植物被氧化损伤,提高对环境胁迫的适应和竞争能力[37-38]。 前人研究结果表明,在中度水分胁迫下,菘蓝的靛玉红含量增加[39];在水分胁迫下,黄芩叶中总黄酮含量明显增加,根中总黄酮、黄芩素含量显著提高[40]。 本研究中,T1 的吲哚类生物碱(靛蓝和靛玉红)、总黄酮含量均高于CK,说明在受到轻度化感胁迫时,可通过增加次生代谢产物含量的方式来提高菘蓝对环境胁迫的适应能力。 本研究还发现,随着浸提液浓度的升高,T2、T3、T4 的靛玉红含量均较T1 显著降低,说明茶树凋落叶中的化感物质进入菘蓝体内会影响其次生代谢途径,进而影响靛玉红的合成。 T4 的靛玉红、总黄酮含量较T2、T3 有上升趋势,说明高浓度的化感物质可在一定程度上刺激靛玉红和总黄酮的积累,其原因可能是高浓度的化感物质破坏了菘蓝体内的抗氧化系统,使得菘蓝的抗氧化酶活性及其基因表达量降低。 菘蓝通过增加黄酮和靛玉红含量的方式来维持植物体内活性氧的平衡,黄酮和靛玉红是天然的非酶抗氧化剂,能够与氧自由基直接发生反应,从而清除自由基[41],维持植株的正常生长,提高植株对化感胁迫的适应能力。
4 结论
本研究结果表明,菘蓝可通过渗透调节机制、抗氧化酶系统和非抗氧化酶系统的共同协作,以应对茶树凋落叶的化感作用,在低浓度化感物质作用下,菘蓝生长可能不会受到较大的影响,因此,在茶园种植菘蓝时可通过调整种植密度、勤采茶叶、清理落叶等措施加强田间管理,减少茶树化感物质的产生,以创造有利于菘蓝生长的环境条件。
