不同厂家盐酸索他洛尔片在4种介质中的溶出曲线比较
2020-06-29杨东萍
杨东萍
(德宏州食品药品检验所,云南 德宏 678400)
盐酸索他洛尔别名4'-(1-羟基-2-异丙胺乙基)甲磺酰苯胺盐酸盐,是β受体阻滞剂和钾通道阻断特性的抗心律失常药物,对于无器质性心脏病的房颤,盐酸索他洛尔是维持窦性心律的一线药物。由于其具有β受体阻滞功能,尤其适用于合并冠心病的房颤患者,并可有效降低心室率,减轻房颤发作时的症状。介于其作用机制明确,半衰期长,生物利用度好,疗效稳定,不良反应少,在临床中获得广泛使用。它的原研药由美国百时美施贵宝(Bristol-Myers Squi bb,BMS)研发,盐酸索他洛尔片按BCS分类属于Ⅰ类。本试验溶出曲线比较,参照《中国药典》2015年版二部盐酸索他洛尔片含量测定项下的HPLC法,溶出介质选取参照《普通口服固体制剂溶出曲线测定与比较指导原则》。选择原研厂家(Bristol-Myers Squi PHARMACEUTICALS 1批样品)作为参比制剂,和2家生产企业共6个批次样品,分别在4种不同pH值溶出介质中的溶出行为,绘制实时溶出曲线。进行各企业制剂和原研厂家及各企业的批次间差异比较,为考察药品的内在质量提供依据。
1 仪器与试药
1.1 仪器
R C Z-8 M 溶出试验仪,R Z Q-8 D 取样收集系统,Agilent1260高效液相色谱仪,ME2002E梅特勒电子天平,SevenEasy S20型酸度计。
1.2 试药
盐酸索他洛尔对照品(批号100737-200501,中国生物制品检定所);A厂盐酸索他洛尔片(规格80 mg,批号分别为01171201,01181003,01190301);B厂盐酸索他洛尔片(规格80 mg,批号18091212,18121615,19121616)。0.2%辛烷磺酸钠(色谱纯);乙睛(色谱纯);盐酸、(分析纯);磷酸(分析纯);磷酸二氢钾(分析纯);氢氧化钠(分析纯)。
2 溶液的制备
2.1 对照溶液的制备
精密称定标准品盐酸索他洛尔适量,用流动相稀释并制成0.2 mg/ml盐酸索他洛尔对照溶液,即得。
2.2 供试品的制备
使用浆法,溶出介质体积为900 ml,转速为50 r/min,温度36.5℃~37.5℃,取样时间分别为:5 min、10 min、15 min、35 min、45 min、60 min 6个时段,取出溶液经0.45 um微孔滤膜过滤,作为供试溶液待测。
3 方法与结果
3.1 色谱条件
色谱柱C18(规格:4.6×150 mm);流动相0.2%辛烷磺酸钠溶液(用磷酸调节pH值至3.0)-乙腈(79:21);检测波长228 nm;进样体积:20 ul;柱温30℃。
3.2 溶出度测定
3.2.1 溶出介质的选择及配制:参考《普通口服固体制剂溶出曲线测定与比较指导原则》选取配制。配制pH1.2盐酸溶液、pH4.5磷酸盐缓冲液、pH6.8磷酸盐缓冲液和水四种介质作为溶出介质,分别测定不同厂家、不同批号的制剂在不同溶出介质中的实时溶出曲线,对盐酸索他洛尔片实时溶出曲线进行分析。
3.2.2 溶出曲线的考察:分别取供试品盐酸索他洛尔片六粒,分别以水、pH1.2盐酸溶液、pH4.5磷酸盐缓冲液、pH6.8磷酸盐缓冲液作为溶出介质,体积为900 ml,转速为50 rpm,以浆法进行,于5 min、10 min、15 min、35 min、45 min、60 min取样过滤进行HPLC测定。在4种介质样品溶出曲线见图1~图4。

图1
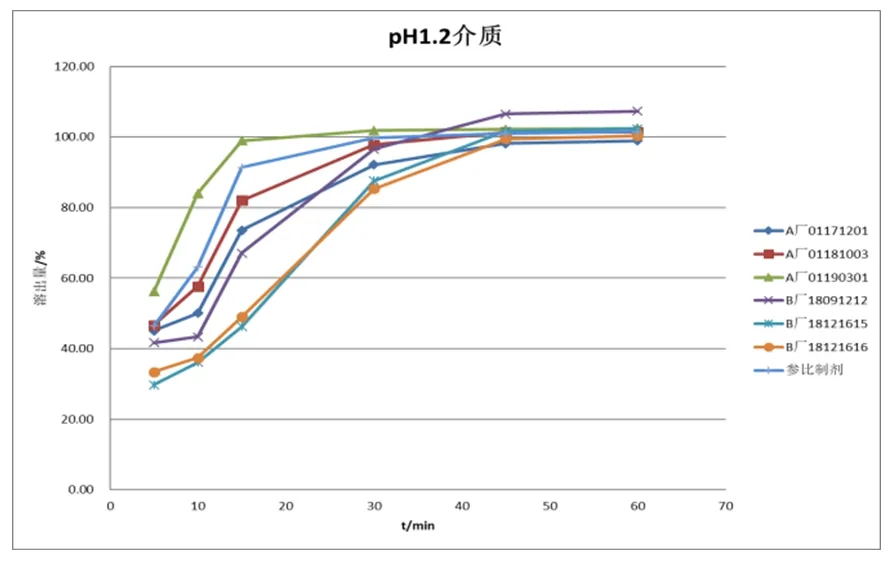
图2
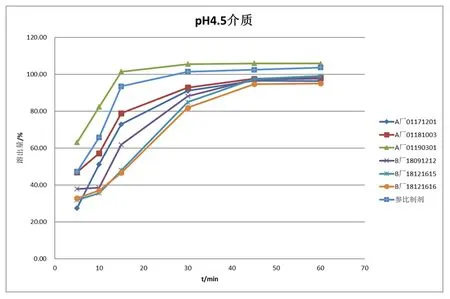
图3
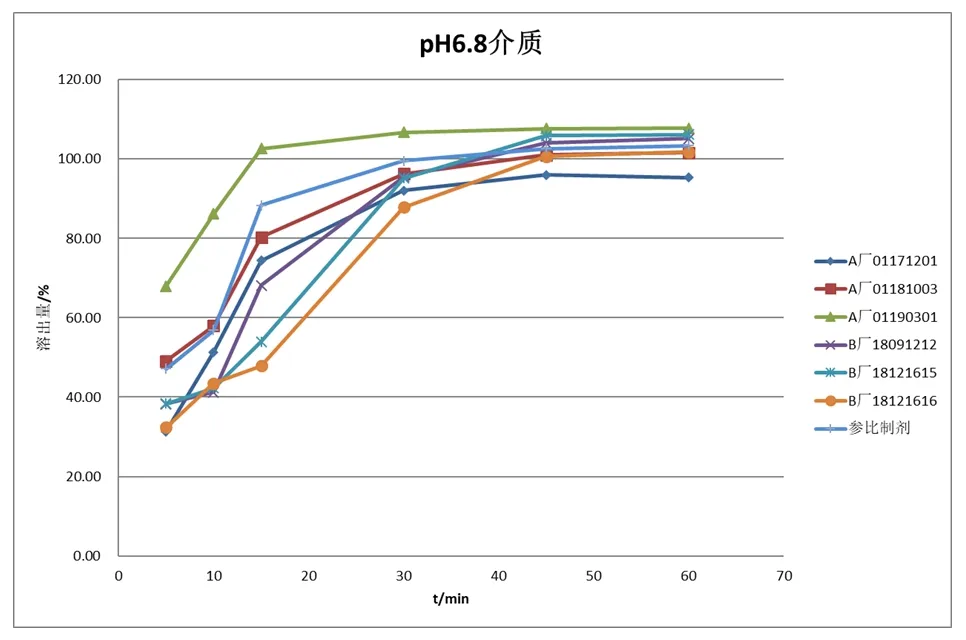
图4
3.3 A厂01181003在四种介质中的溶出行为(见图5)
4 方法学考察
4.1 线性关系考察
取盐酸索他洛尔对照品适量,精密称定,配成对照品溶液浓度10,20,50,100,150,200μg/ml测定,峰面积进行线性回归测定。通过测定得回归方程:y=0.7187x+3.0305(R2=0.998),结果表明呈良好的线性关系。
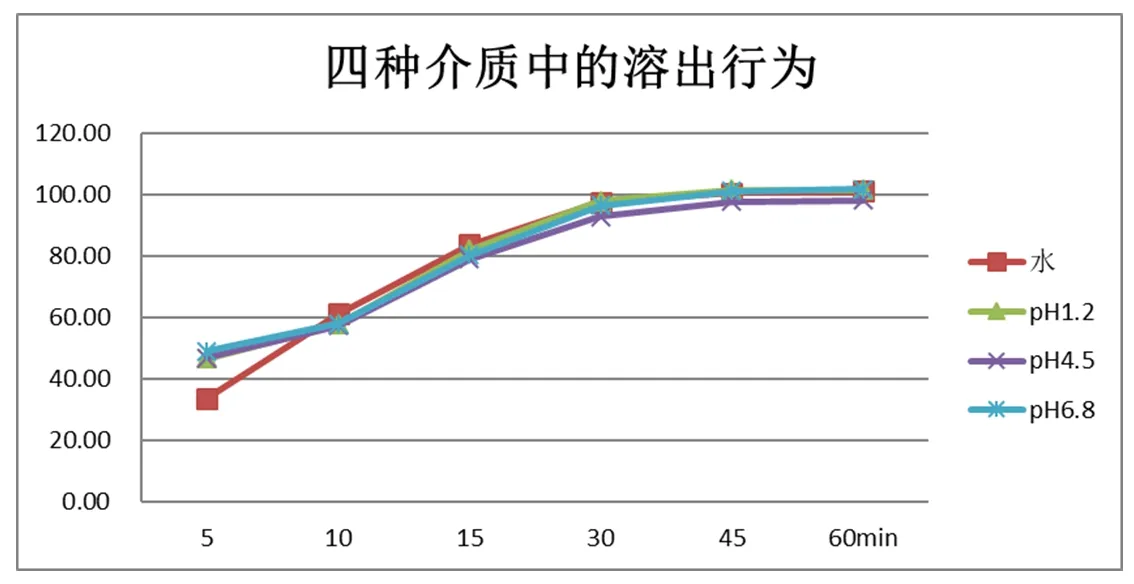
图5
4.2 精密度实验
取“3”项下对照品溶液,连续进样5次。测定结果如下表(表1),表明精密度良好。

表1 精密度实验结果
4.3 稳定性实验
取“3”项下pH1.2、pH4.5、pH6.8和水为溶出介质的供试品溶液,分别于0,1,2,4,8,12 h时依法进行测定。结果如下(表2),RSD均小于2.0%(n=6),表明供试品溶液在12 h内稳定性良好。
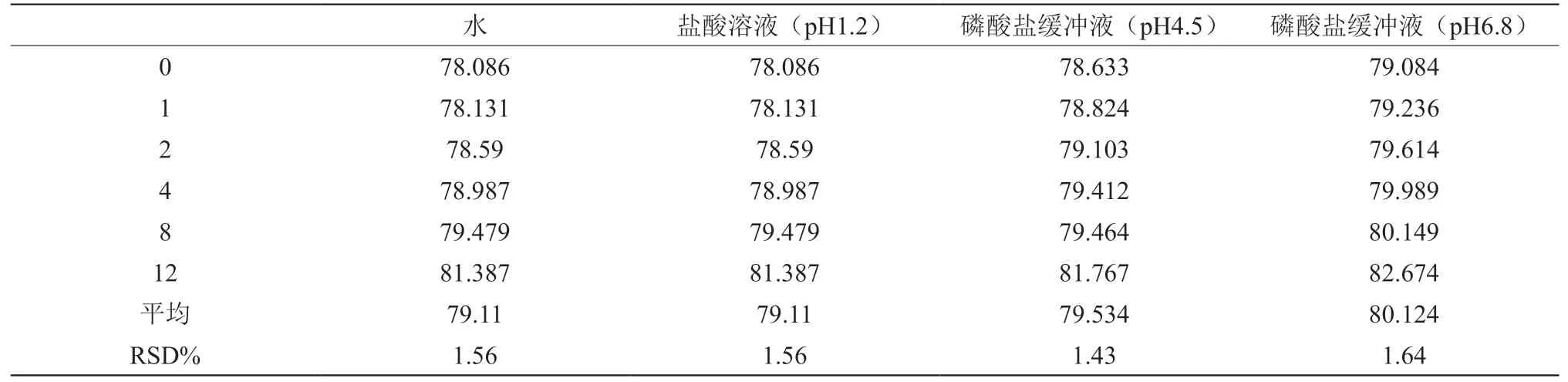
表2 稳定性实验结果
5 结 果
以水为介质时的溶出曲线(见图1),A厂和B厂的溶出行为有差异,在15分钟时参比制剂、A厂01181003和A厂01190301的溶出量以达85%以上,其中A厂01190301已达100%。其余供试品的溶出量还未达到85%。在30分钟时全部都达到85%以上。
以盐酸溶液pH1.2为介质时的溶出曲线(见图2),A厂和B厂的溶出与参比制剂的溶出有差异,A厂和B厂的批次间的溶出也存在差异。在15分钟时只有参比制剂和A厂01190301的溶出量达到85%以上,其余供试品的溶出量还未达到85%。在30分钟时供试品的溶出量全部达到85%以上。
以pH4.5磷酸盐缓冲液为介质时的样品溶溶出曲线(见图3),A厂和B厂的溶出行为与参比制剂的溶出行为有差异,A厂和B厂的批间的溶出曲线也存在差异。在15分钟时参比制剂和A厂01190301的溶出量达到85%以上,其中,A厂01190301的溶出量已达100%。其余供试品的溶出量还未达到85%。在30分时B厂18121615和B厂18121616达到80%,其余供试品的溶出量已达到85%以上。
以pH6.8磷酸盐缓冲液为介质时的溶出曲线(见图4),A厂和B厂的溶出与参比制剂的溶出有差异,A厂和B厂的批次间的溶出也存在差异。当15分钟内参比制剂和A厂01190301的溶出量已达到85%以上,其余供试品的溶出量还未达到85%。在30分钟溶出量全部都达到了85%以上。
同批号在四种介质中的溶出行为(见图5),A厂01181003在四种介质中的溶出行为存在差异。5分钟时,在水介质中的溶出量比在其他三个介质中的溶出量少。10分钟时,在水介质中的溶出量比在其他三个介质中的溶出量多。30分钟时,四种介质中的溶出量全部达到85%以上
6 讨 论
盐酸索他洛尔片按BCS分类属I类,它的溶出受PH影响不大,溶出检查结果可见A厂和B盐酸索他洛尔片溶出度在水、PH1.2盐酸缓冲溶液、PH4.5磷酸盐缓冲液和PH6.8磷酸盐缓冲液介质中均符合2015版中国药典溶出度的判定标准,30 min溶出量达80%以上,但在4种溶出介质中只有A厂01190301在4种介质中全部15 min以内溶出量达到85%,其溶出曲线与参比制剂可判为相似。其余都存在差异。虽然15 min内有差异,但在30 min以后差异不大,总体不影响生物利用度。
为避免同一种药物在不同厂家,甚至同一厂家不同批号,药物制剂溶出曲线出现差异,而影响药物的生物有效性和药物疗效,对药物制剂进行体外溶出度的一致性评价就非常有必要,根据盐酸索他洛尔按BCS分类,可制造一个不受PH影响的优良制剂。让药物的吸收释放不受溶出环境影响,并很好发挥疗效。据不完全统计,目前国内生产盐酸索他洛尔片的厂家已达15个之多,16个批准文号。各个厂家所采用的原料及处方和生产工艺也不尽相同,所以这些药物制剂内在质量有可能存在差异。影响溶出度的主要因素主要处方和工艺,可以建议企业注意原料质量的选取,改善处方,提高制剂工艺。对于处方辅料,要明确特性,优化种类与用量;控制参数与步骤。要各方面综合考虑、平衡取舍。提高质量控制手段,使不同厂家生产的药品,在不同人群中具有相同的体外生物等效性。制造出和原研药物一致的制剂,为用药者提供安全有效的优良制剂。
