家兔软骨细胞复合藻酸盐体外培养的实验研究
2020-06-29赵智君
刘 义,杨 浩,吴 迪,李 骅,赵智君
(1.昆明医科大学第一附属医院,云南 昆明 650032;2.重庆渝北区人民医院骨科,重庆 401120)
关节软骨缺乏血供,基质中软骨细胞稀疏,缺乏分裂增生能力,其自身修复能力有限,关节软骨损伤通常会引发严重的关节软骨退变。在关节软骨损伤的治疗中,临床采用的技术包括骨髓刺激术(软骨下骨钻孔、微骨折等)、同种骨软骨移植、马赛克软骨移植及基于自体软骨细胞移植的ACI和MACI。骨髓刺激术通常在局部形成纤维软骨,而结合ACI或者MACI,可以形成透明软骨样组织,具有较好的远期效果[1]。MACI基于组织工程技术,将体外扩增的自体软骨细胞种植于支架材料中进行移植,其关键技术在于软骨细胞的分离培养及制备理想的支架材料。
1 材 料
1.1 实验动物
取昆明医科大学实验动物中心提供的6只成年新西兰大白兔,周领34~37周,体重1.8~2.2 kg。
1.2 主要试剂和仪器(见表1)

表1 主要仪器和试剂
2 方 法
2.1 软骨细胞获取
取6只成年新西兰大耳白兔(昆明医科大学实验动物中心提供),体重1.8~2 kg,空气栓塞处死,切取股骨内、外侧髁软骨,置入装有生理盐水的培养皿中。
生理盐水冲洗软骨块三遍,使用手术刀片将其切为0.5 mm³大小的碎粒,用吸管移入离心管中1000 rpm离心10 min,去上清液,加入十倍左右的0.1﹪Ⅱ型胶原酶置入培养箱消化8小时,可见软骨颗粒大部分消化,取出后,放入恒温摇床中,37℃ 120 r/min消化1小时,可见软骨颗粒完全消化。l000 rpm离心10 min,弃上清,沉淀用30倍的PBS平衡液清洗、离心3遍后,在高糖DMEM完全培养基中加入,其含谷氨酰胺292 mg/L+维生素C 50 mg/L+10%胎牛血清+1%双抗液,混匀后,转移至25 ml普通培养瓶中,在37℃、5﹪CO2的培养箱内进行培养。
2.2 细胞培养的观察与传代
(1)软骨细胞的活性检测及传代培养:将10 g/L的台盼盘蓝液与原代细胞悬液以1:9的比例滴入离心管中,混匀后放置2~3 min,取一滴均匀分散于计数板,计算活细胞数。
(2)倒置显微镜下观察原代细胞贴壁时间,各代细胞的形态和生长状况差异等。
(3)传代培养:软骨细胞融合达80~90%时,使用0.125%的胰蛋白酶消化,以1:2的比例传代。
2.3 软骨细胞的鉴定
2.3.1 细胞爬片
将第二代软骨细胞制成1×106/ml浓度,滴加至盖玻片(硅化处理)上,置于培养箱中,6小时后,细胞完成贴壁,再向培养板中加入完全培养基,继续置于培养箱中。24小时后取出盖玻片,用PBS液洗两次后4%多聚甲醛室温固定30分钟,吸水纸吸干残留液体,中性树胶粘贴于载玻片上等待染色。
2.3.2 Mallory特染
将1%Triton-x-100滴加至爬片,室温下作用30分钟,PBS液洗三次,共5分钟。苏木素染色2~3分钟。蒸馏水洗,0.5%盐酸乙醇分化。蒸馏水洗,至返蓝为止。蒸馏水洗,滴加酸性复红水溶液,作用5分钟。不经水洗,直接滴加Mal1ory苯胺蓝-橘黄G溶液,作用10分钟。过95%乙醇及无水乙醇分化兼脱水。中性树胶封片,镜下观察。
2.3.3 甲苯胺蓝染色
PBS液漂洗细胞爬片2次,95%酒精固定15分钟,PBS液漂洗3次,每次1分钟。滴加1%甲苯胺蓝染液。蒸馏水洗。经70%、80%、90%酒精各1次,95%酒精2次和100%酒精3次逐级脱水,每次1分钟。二甲苯透明3次,每次1分钟。中性树胶封片,镜下观察。
2.3.4 II型胶原免疫组化染色
滴加1% Triton-x-100至细胞爬片,室温下作用30分钟,予PBS液洗三次,共5分钟。滴加3%H2O2,室温下孵育10分钟,PBS液冲洗3次,3分钟/次。吸去PBS,滴加Ⅱ型胶原单克隆抗体,湿盒内4℃冰箱过夜。PBS液冲洗3次,5分钟/次,吸去PBS后滴加聚合物增强剂,室温下孵育20分钟,PBS冲洗3次,3分钟/次。吸去PBS,滴加酶标抗羊/兔聚合物,室温下孵育30分钟,PBS冲洗3次,3分钟/次。吸去PBS,滴加DAB溶液,显微镜下观察3~5分钟,显色效果满意时终止染色。自来水冲洗后苏木素复染,梯度酒精逐级脱水干燥,中性树胶封固,镜下观察。
2.4 组织工程软骨检测
2.4.1 藻酸钠凝胶的制备
分析纯低粘度藻酸钠溶于含有0.15 mol/l的NaCl的溶液中,使藻酸钠的质量分数为1.2℅,磁力搅拌机搅拌,pH值调为7.4。0.22 μm滤网过滤除菌,4℃保存备用。
2.4.2 种子细胞的准备
第二代软骨细胞消化后,吹打制成细胞悬液,细胞计数后将细胞悬液置入50 ml尖底离心管,待全部细胞收集完后,1000 r/min×10 min离心,去上清后等待接种。
2.4.3 藻酸钙-软骨细胞凝珠及空白藻酸钙凝珠的制备
第二代软骨细胞消化后,1000 rpm离心10 min,去上清液后进行细胞计数。用1.2%藻酸钠溶液调至细胞密度为5×106/ml,吸入10 ml注射器中,以较慢的速度在40 ml CaCl2溶液中滴入该混合溶液,CaCl2溶液浓度为102 mMol/l,第一时间交联促进凝珠的形成,室温下进行12 min反应,从而将最佳的交联效果获取过来。将CaCl2溶液吸出来,用0.15 mol/l NaCl溶液反复冲洗4次,高糖DMEM完全培养液冲洗1次。将凝珠移入6孔培养板中,每孔植入8~10枚凝珠为宜,加入高糖DMEM完全培养液,37℃、5%CO2及饱和湿度条件下培养,每三天换液一次,共4周(图1)。以同样方法制备不含软骨细胞的空白藻酸钙凝珠。
2.4.4 细胞-载体复合物及空白载体倒置相差显微镜下观察、冰冻切片HE染色、II型胶原免疫组化染色
在细胞培养无菌操作实验台中,从6孔培养板中取出2枚藻酸钙-软骨细胞凝珠于无菌25ml培养瓶中,置于倒置相差显微镜下观察藻酸钙-软骨细胞凝珠内部成分。将培养4周的藻酸钙-软骨细胞凝珠随机取出,行冰冻切片HE染色、Ⅱ型胶原免疫组化染色。
2.4.5 II型胶原mRNA RT-PCR检测
取单层培养的第二代软骨细胞和支架内培养至1、4周的软骨细胞进行II型胶原mRNA RT-PCR检测,空白藻酸钙支架作为对照。使用Primer Express 3.0软件(美国ABI公司)设计家兔Ⅱ型胶原基因引物,由上海生工合成,从NCBI GeneBank寻找家兔Ⅱ型胶原基因的mRNA序列,基因编号D83228.1。引物序列:上游、下游分别为5’-CCA AGA AGA ACT GGT GGA GC-3’、5’-TAG GTG ATG TTC TGG GAG CC-3’。长度、退火温度分别为178 bp、60℃,根据Trizol说明书提取RNA,PCR条件为在95℃、94℃、61℃、72℃的温度下分别进行10 min的预变性、15 s的变性、20 s的退火、50 s的延伸,35个循环,最后在72℃的温度下进行2 min的延伸。用2%凝胶电泳鉴定PCR产物。
3 结 果
(1)原代细胞接种后24小时开始贴壁,之后逐渐有细胞从团块中爬出贴壁,为三角形或多角型,7~10天后融合达80~90%,成铺路卵石状。传代细胞贴壁加快,约接种后2小时开始贴壁,12小时完成贴壁,3天融合达80~90%,传代至第四代后,细胞形态发生改变,有较多伪足伸出,细胞生长减慢。
(2)台盼蓝拒染测得活性率为95.8﹪。
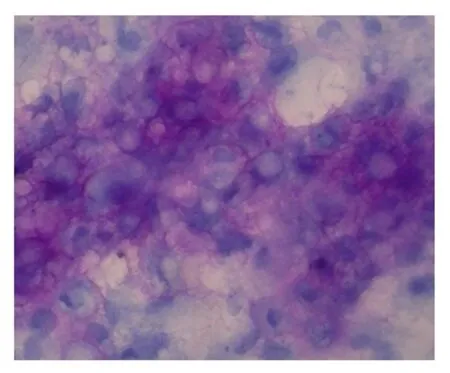
第三代软骨细胞爬片甲苯胺蓝染色图×100
(3)软骨细胞爬片甲苯胺蓝染色,可见胞质中有紫红色异染颗粒。
(4)Mallory染色可见软骨细胞胞浆呈深蓝色。
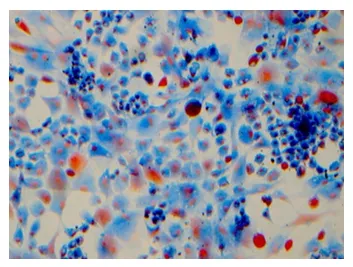
第三代软骨细胞Mallory染色呈阳性×100图
(5)软骨细胞爬片II型胶原染色见胞浆呈棕黄色,细胞核蓝染。
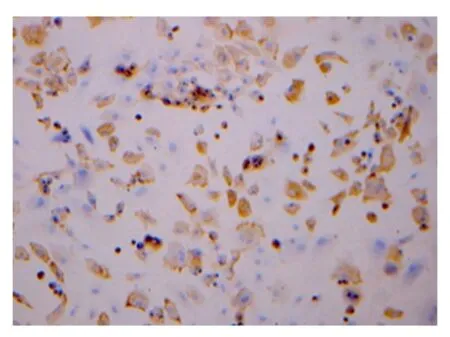
第三挖潜软骨细胞II型胶原免疫组化染色阳性×100图
(6)空白藻酸钙凝珠载体呈水滴状,白色半透明,有一定的强度和韧性。直径约为3 mm。冰冻切片经HE染色,可见蓝染纤维状结构交织成网状,网眼较均匀一致。
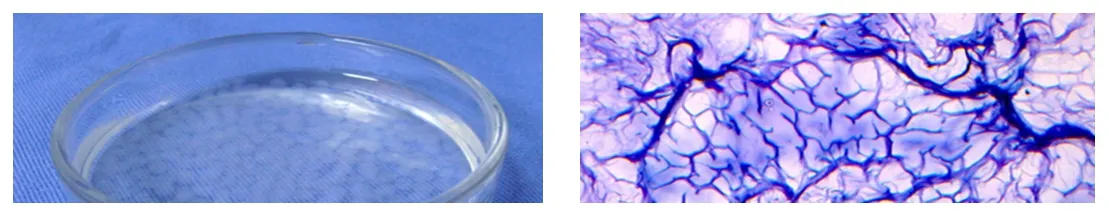
藻酸钙凝珠外观,直径约3mm;空白藻酸钙凝珠冰冻切片HE染色×100
(7)藻酸钙复合软骨细胞悬液制成藻酸钙-软骨细胞凝珠后,直径约3 mm,倒置相差显微镜下观察,发现凝珠内部软骨细胞呈圆形,单个散在分布。培养4周后,倒置相差显微镜下可见大量软骨细胞单个或团状散在分布在藻酸钙载体中,单个细胞呈圆形且透亮,细胞泽光性好,分布密集、均匀,培养4周后材料内部软骨细胞数目明显较培养前多。HE染色可见载体材料被染成淡蓝色,蓝染的软骨细胞位于材料的网状空隙中,数目较多。培养4周后的藻酸钙-软骨细胞凝珠Ⅱ型胶原免疫组化染色,可观察到载体中软骨细胞胞浆及载体材料内部均被染成棕黄色,细胞核染为淡蓝色。

倒置相差显微镜下观察×100;4周后倒置相差显微镜下观察×100;冰冻切片HE染色×100;II型胶原免疫组化染色×100
(8)第二代单层培养的软骨细胞和复合藻酸钙后培养至1、4周的软骨细胞,经凝胶电泳鉴定,II型胶原mRNA RT-PCR产物均在178bp处出现阳性条带,空白支架处未出现条带。

4 讨 论
在本实验中,软骨细胞在复合海藻酸钠水凝胶材料后第一时间将其原形恢复过来,终呈椭圆形或圆形。HE染色可见蓝染的软骨细胞散在分布于类似软骨陷窝的网状晶格中。Ⅱ型胶原免疫组织化学显示细胞具有旺盛的Ⅱ型胶原分泌,说明海藻酸钠载体培养极好地维持了软骨细胞表型。在软骨细胞的培养中,将海藻酸钠充分利用起来一方面不会引发去分化现象,另一方面还能够对细胞的球形形态进行长期维持,而在软骨细胞表型的稳定中,维持球形结构具有极为重要的作用。本实验也表明,海藻酸钠中软骨细胞呈球形,生长呈丛状,免疫学、组织学染色发现有Ⅱ型胶原、蛋白聚糖出现在细胞周围,其为软骨细胞所特有,分泌主体为软骨细胞,随着时间的延长逐渐增多,软骨细胞海藻酸钠凝胶强度也随着这些软骨基质数量的增加而提升。从这里我们可以看出,经体外培养的功能正常的海藻酸钠复合兔软骨细胞进行体外短期培养,软骨细胞支架复合物形成后进一步体内实验的条件具备。
5 结 论
酶消化结合振荡培养消化法具有较高的软骨组织消化率,实验构建的组织工程软骨具有软骨组织的特征。
