CDK9在动脉粥样硬化组织中的表达及其敲低对血管平滑肌细胞增殖的影响
2020-06-29
(青岛大学附属医院,山东 青岛 266003 1 心内科; 2 急诊内科)
动脉粥样硬化(AS)是血管壁的一种慢性、进行性炎性疾病,是心血管系统疾病发生、发展的病理生理基础[1-3]。由于其高发病率及慢性病程等特点,对患者自身、家庭和社会都造成了严重负担[4-5]。血管平滑肌细胞(VSMCs)作为动脉壁的主要成分,在正常血管中增殖率极低,但在AS早期及血管损伤后却表现出较高的增殖率。研究表明,VSMCs异常增殖在AS的发病及进展中发挥着关键作用[6-8]。因此,如何控制或逆转VSMCs异常增殖对AS的防治有着重要意义。CDK9是一种丝氨酸/苏氨酸蛋白激酶,作为细胞周期蛋白依赖性激酶(CDKs)家族中重要的一员,在细胞转录过程中发挥着重要的作用。和其他主要调控细胞周期的CDKs不同,CDK9主要通过与细胞周期蛋白T1结合形成正性转录延长因子b复合物(P-TEFb),增强RNA聚合酶Ⅱ的转录活性,促进RNA合成以促进细胞的生长和分化[9-11]。越来越多的研究表明,CDK9与艾滋病、肿瘤以及心血管疾病等多种疾病相关。在肿瘤治疗中,已有以CDK9为靶点的抑制剂的相关报道[12-14]。根据上述研究可以推测抑制CDK9的表达可能会降低VSMCs的增殖。本研究旨在探索CDK9对VSMCs增殖的影响、调控机制及其相关临床意义。现将结果报告如下。
1 材料与方法
1.1 材料
人主动脉VSMCs购自美国ATCC公司。
1.2 仪器与试剂
CDK9小干扰RNA(CDK9-siRNA)及CDK9阴性对照(CDK9-NC)由上海吉玛制药技术有限公司设计并合成,所需引物由青岛华大基因研究院合成,TRIzol试剂、Lipofectamine 2000试剂购自美国Invitrogen公司,cDNA反转试剂盒(PrimeScriptTMRT reagent Kit)购自日本Takara公司,SYBR以及CCK-8试剂盒购买于上海翊圣生物科技有限公司,EDU试剂盒购买于广州锐博生物科技有限公司,PAGE凝胶制备试剂盒(12.5%)购自上海雅酶生物科技有限公司,CDK9一抗购自美国CST公司,PCNA一抗购自美国Protein tech公司。多功能酶标仪、PCR扩增仪及实时荧光定量PCR仪购自美国Bio-Rad公司,荧光倒置显微镜购自日本Nikon公司,Fusion SoloS 化学发光成像系统购自法国Vilber公司。
1.3 对象及分组
选取2018年3月—2019年2月于我院体检中心体检健康者外周静脉血(A组)及住院冠心病患者外周静脉血(B组)各20例为研究对象。A组纳入标准:未发现任何疾病的健康体检者。B组纳入标准:冠状动脉造影显示任一主要心外膜冠状动脉(包括左主干、左前降支、左旋支或右冠状动脉)狭窄≥50%者。A组男9例,女11例,平均年龄(24.45±2.61)岁;B组男11例,女9例,平均年龄(67.80±9.08)岁。于清晨空腹采集肘静脉血,分离血清,置于-80℃冰箱储存备用。同期收集遗体捐献者的正常颈动脉内膜组织(C组)及行颈动脉内膜切除术患者的颈动脉粥样硬化斑块组织(D组)各6例,组织标本收集后立即放入液氮保存。C组男3例,女3例,平均年龄(34.00±5.40)岁;D组男5例,女1例,平均年龄(61.17±4.83)岁。本研究获我院伦理委员会批准,并遵循赫尔辛基宣言原则。所有研究对象或委托人均签署了知情同意书。
1.4 研究方法
1.4.1细胞培养、分组及转染 VSMCs在常规复苏后,置于含体积分数0.10胎牛血清的DMEM/高糖培养基中于37 ℃、含体积分数0.05 CO2的恒温培养箱中培养。观察细胞生长状态,48 h后待细胞融合达95%时传代。按实验需要取生长至对数期的细胞分为阴性转染组(E组)和CDK9敲低组(F组),其中E组转染CDK9-NC和转染试剂Lipofectamine 2000,F组转染CDK9-siRNA和转染试剂Lipofectamine 2000。
1.4.2实时荧光定量PCR(RT-qPCR)方法检测CDK9、PCNAmRNA表达 以Trizol法提取A、B、C、D、E、F组中总RNA,采用吸光度测定法检测所有样本A260/A280比值,以A260/A280比值1.8~2.0为满足实验要求。然后使用PrimeScriptTMRT reagent Kit反转录试剂盒进行cDNA合成。同时按照SYBR试剂盒说明书配制20 μL反应体系,使用RT-qPCR仪进行扩增。分别检测A、B、C、D、E、F组样本中CDK9 mRNA表达量及E、F组样本中PCNAmRNA表达量。以GAPDH作为内参照,采用2-△△CT法计算CDK9及PCNAmRNA相对表达量。GAPDH上游引物序列:5′-GTCTCCTC-TGACTTCAACAGCG-3′,GAPDH下游引物序列:5′-ACCACCCTGTTGCTGTAGCCAA-3′;CDK9上游引物序列:5′-CCATTACAGCCTTGCGGGAGA-T-3′,CDK9下游引物序列:5′-CAGCAAGGTCAT-GCTCGCAGAA-3′;PCNA上游引物序列:5′-CA-AGTAATGTCGATAAAGAGGAGG-3′,PCNA下游引物序列:5′-GTGTCACCGTTGAAGAGAGTGG-3′。
1.4.3EDU及CCK-8实验检测细胞增殖情况 取对数生长的细胞,接种于96孔板中(1 000个细胞/孔),置于恒温培养箱培养12 h,待细胞贴壁生长后,E、F组分别转染CDK9-NC及CDK9-siRNA,恒温培养箱内培养,每组设3个复孔。EDU实验:转染24 h后,将100 μL EDU染液加入到每孔中,室温避光,脱色摇床孵育30 min后,再于每孔中加入100 μL Hoechst染料试剂,室温避光,脱色摇床孵育30 min;1×PBS洗去染液,于荧光倒置显微镜下观察细胞EDU摄取情况并照相,使用ImageJ 1.5.1软件测量E、F组吸光度值。CCK-8实验:转染24 h后,加入10 μL CCK-8溶液加于各孔中,37 ℃下孵育1 h,采用多功能酶标仪测量每孔在450 nm处的吸光度值。
1.4.4Western blotting方法检测E、F组中CDK9和PCNA蛋白的表达 转染24 h后提取E、F组蛋白,使用BCA法测定蛋白浓度。按照PAGE凝胶制备试剂盒说明制胶,每孔上样40 μg蛋白,120 V恒压电泳1.5 h,取出凝胶100 V恒压转膜1.5 h,然后使用体积分数0.05脱脂牛奶(TBST配制)室温封闭PVDF 膜1 h,TBST洗涤1次后置于CDK9、PCNA一抗(1∶1 000)室温孵育2 h,TBST洗涤3次(每次10 min),后置于二抗(1∶5 000)中室温孵育1 h,再次用TBST洗涤3次(每次10 min),最后使用ECL化学发光法显影,采用Fusion SoloS 化学发光成像系统扫描蛋白条带,使用ImageJ 1.5.1软件测量CDK9、PCNA蛋白相对表达量。
2 结 果
2.1 临床样本中CDK9 mRNA表达量的比较
本研究RT-qPCR检测结果显示,A、B、C、D组中CDK9 mRNA表达量分别为0.59±0.22、1.66±0.56、1.23±0.55、3.23±0.89。A组与B组、C组与D组中CDK9 mRNA表达量比较差异均有统计学意义(t=7.94、4.79,P<0.05)。
2.2 转染CDK9-NC、CDK9-siRNA对VSMCs中CDK9表达的影响
本研究RT-qPCR检测结果显示,E组、F组中CDK9 mRNA表达量分别为1.03±0.03、0.079±0.05,两组比较差异有显著性(t=30.33,P<0.05)。Western blotting检测结果显示,E、F组中CDK9蛋白相对表达量分别为0.96±0.07、0.12±0.05(图1),两组比较差异有显著性(t=16.39,P<0.05)。
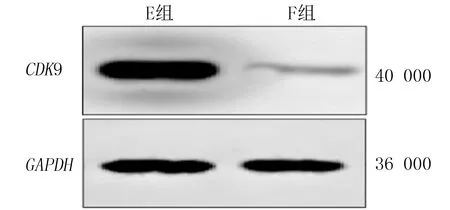
图1 转染CDK9-siRNA后对VSMCs中CDK9蛋白表达的影响
2.3 敲低CDK9对VSMCs增殖的影响
EDU实验结果显示,E组和F组平均吸光度值分别为0.13±0.01、0.05±0.01,F组较E组EDU摄取能力明显减弱(图2),两组比较差异具有显著性(t=13.13,P<0.05)。CCK-8实验结果示E组和F组450 nm处吸光度值分别为2.56±0.31、1.29±0.09,两组比较差异有显著性(t=6.78,P<0.05)。
2.4 敲低CDK9对PCNA表达的影响
RT-qPCR结果显示,E、F组中PCNAmRNA相对表达量分别为1.01±0.04、0.65±0.07,差异有显著性(t=8.14,P<0.05)。Western blotting检测结果显示,E、F组中PCNA蛋白相对表达量分别为0.97±0.05、0.28±0.08,同E组相比F组中PCNA蛋白的表达量显著下降,差异具有显著统计学意义(t=12.62,P<0.05)。
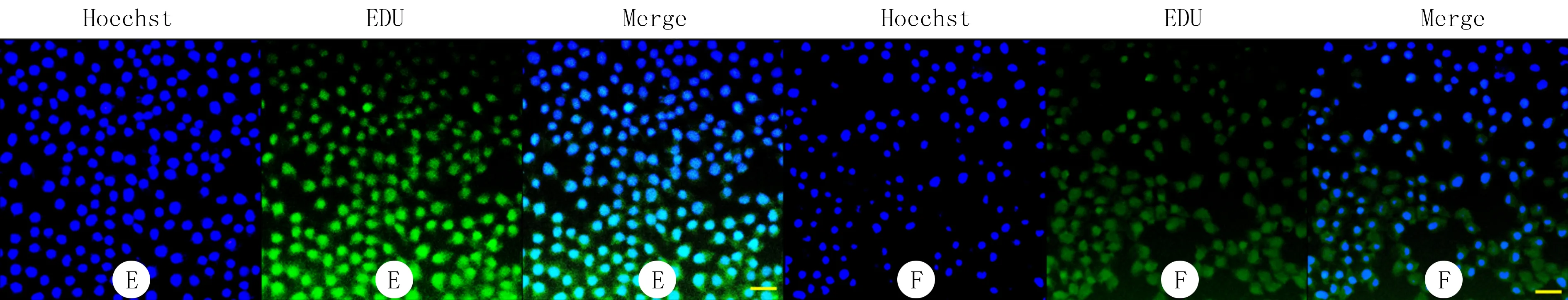
E:E组,F:F组,100倍
图2 CDK9敲低对VSMCs增殖的影响
3 讨 论
在我国由于人口老龄化趋势等因素的影响致使心血管病患病率持续上升,其中以AS为基础病变的脑卒中和冠心病死亡率居于首位,远远超过了肿瘤及其他疾病[15-17]。许多研究发现VSMCs与AS疾病有密切相关性,对VSMCs生物学功能的研究越来越引起临床关注。在正常生理状态下,动脉中的VSMCs形态呈纺锤形,表现为收缩表型,然而在病理条件刺激下可向合成表型转换,产生促炎递质以促进其增殖,VSMCs的异常增殖和慢性炎症反应的反复刺激最终致使血管管腔的狭窄,产生相关并发症[18-19]。因此,研究调控VSMCs增殖的靶分子及其机制对AS的防治具有重要意义。
本研究结果显示,A与B组以及C与D组相比较,CDK9 mRNA在B组和D组中显著升高,推测在AS的病理过程中CDK9可能发挥了调控作用。CDK9在哺乳动物细胞中广泛存在,在多种人类疾病中发挥着关键调控作用。CDK9可通过促进原癌基因MYC转录而参与多种肿瘤的发生[20-21]。有研究表明,在髓系白血病中抑制CDK9可导致髓样细胞白血病-1(Mcl-1)和X连锁凋亡抑制蛋白的表达下降,从而促进癌细胞凋亡。同时,CDK9也可通过调控p53基因磷酸化而促使肿瘤发生。目前,已有多种小分子CDK9抑制剂进入了临床研研究,并显示出良好的治疗效果[22-24]。除肿瘤外,CDK9还参与其他疾病的发病,如HIV、炎症和心肌肥大[25]。研究显示,在炎症中CDK9可通过调控Mcl-1蛋白的表达而影响中性粒细胞凋亡,进而影响炎症的结局[26]。对小鼠和斑马鱼动物模型的研究结果显示,CDK9的激活会导致心肌细胞肥大。在心脏胚胎发育过程中,使用CDK9抑制剂适度抑制CDK9的表达可使心室变小和心室射血分数降低,并显著减少心肌细胞的数量,这表明CDK9抑制剂可能会成为治疗心血管疾病的潜在药物[27-28]。但CDK9与VSMCs之间的调控关系目前尚不清楚。
VSMCs的异常增殖一直被认为是AS发生的重要因素。在AS早期,VSMCs从收缩表型向合成表型转换,并分泌细胞外基质及释放炎症信号的能力增强,进而促进AS的进展[29]。在本研究中,使用CDK9-siRNA在VSMCs中敲低CDK9,实验结果显示F组中CDK9蛋白和mRNA表达水平均较E组明显下降,提示在转染CDK9-siRNA后CDK9被显著敲低。进一步通过EDU和CCK-8实验证明,在CDK9敲低后VSMCs增殖受到了明显抑制。以上实验结果均表明,CDK9在AS中可能通过参与VSMCs增殖的调控而影响AS进程。本研究进一步探讨了CDK9可能的下游调控机制。PCNA作为DNA复制的分子标记,在细胞生长、维持细胞基本功能等过程中发挥着重要调控作用,被认为是维持细胞增殖必不可少的调控蛋白,可以作为细胞增殖能力的检测指标[30]。本研究检测了CDK9敲低后VSMCs中PCNA的表达量,研究结果显示在CDK9敲低后PCNAmRNA和蛋白的表达量显著降低,提示CDK9可能是通过调控PCNA表达而发挥对VSMCs增殖的调控作用,CDK9可能是VSMCs增殖调控的潜在靶点。
综上所述,本研究证实了CDK9在冠心病患者血清及人颈动脉粥样硬化斑块组织中表达上调。体外实验结果显示,转染CDK9-siRNA可显著下调VSMCs中CDK9的表达;在CDK9敲低后,VSMCs增殖受到显著抑制并使PCNA的表达量下降。据此得出结论,在AS中CDK9可能通过调控PCNA的表达而参与VSMCs增殖的调控。这些结果可能为VSMCs异常增殖性疾病的精准治疗提供新的靶点和新的思路。
