SATB2在乳腺癌组织中的表达及其对乳腺癌细胞生物学特性影响
2020-06-26郎洁孙强张超
郎洁, 孙强, 张超
近年来,乳腺癌的发病率逐年上升,已成为我国及全世界最常见的严重影响女性身心健康的恶性肿瘤之一,居我国女性恶性肿瘤首位[1]。乳腺癌发生、发展过程中,受到多种基因、蛋白的调控[2-3],是一个复杂的,涉及肿瘤与宿主间相互作用的多步骤的过程[4]。近年来的研究显示,SATB2为组织特异性表达的核基质序列特异性结合蛋白,与肿瘤的侵袭转移密切相关,但SATB2在乳腺癌中的表达水平及对乳腺癌细胞增殖、迁移、侵袭能力的影响尚未见报道[5]。基于此,本研究选择北京市隆福医院收治的80例乳腺癌患者为研究对象,从分子、蛋白水平观察SATB2在乳腺癌中的表达情况,观察转染SATB2基因对乳腺癌细胞生物学特性的影响,结果报道如下。
1 材料与方法
1.1 研究对象
选择本院2017年1月至2018年6月收治的80例乳腺癌患者为研究对象,均为女性,年龄30~60岁,平均年龄(45.17±6.84)岁;TNM分期:0期14例,Ⅰ期38例,Ⅱa期17例,Ⅱb期11例;病理类型:导管原位癌7例,浸润性导管癌42例,浸润性小叶癌17例,黏液癌10例,乳头状癌4例。所有患者均对研究知情同意,自愿签署知情同意书。研究经医院伦理委员会批准同意。收集80例新鲜乳腺癌组织及对应的癌旁组织临床样本,手术切除后立即投入液氮保存。分别取部分新鲜组织分离组织蛋白、制作免疫组化切片。
1.2 主要试剂与仪器 详见表1。
表1 主要试剂与仪器
1.3 研究方法
1.3.1 免疫组化 ①固定、脱水、包埋。取组织放入4%多聚甲醛里面固定3~4 h,取适当大小组织放入包埋盒中,进行脱水。打开包埋机,将脱水后的组织连同包埋盒依次放入机器组织槽中,进行包埋。②切片、制片。打开切片机,固定蜡块,用力均匀,右手摇动切片,左手用毛笔接片,制片。③组织化学染色。60 ℃干烤2 h脱蜡,二甲苯、梯度酒精、PBS冲洗净残余石蜡。以柠檬酸钠,微波抗原修复,温度控制在96 ℃~98 ℃。然后将切片放入热锅中15 min,最后自然冷却室温。以免疫组化笔圈围住组织,并将切片放入湿盒中,盒中加入少量蒸馏水,滴加3%H2O2溶液室温孵育10 min。甩干水分,吸干水珠,加山羊血清封闭液,放入湿盒内,室温10 min。滴加一抗盖住组织,浓度为1∶200,然后放入湿盒内4 ℃过夜。第二天,4 ℃冰箱取出湿盒,室温复温30 min,PBS冲洗,甩干水分,滴加二抗,室温孵育10 min。每张片子滴加50 μl链霉菌抗生物素-过氧化物酶溶液,室温孵育10 min,PBS冲洗净后,100 μl DAB溶液,显微镜下观察3~10 min。染色合适即可终止染色,自来水冲洗。苏木素复染,1~2 min,细胞核变蓝色即可终止,0.5%氨水反蓝,1%盐酸酒精分化3 s,自来水冲洗3 min。梯度酒精脱水,晾干片子后滴加适量中性树胶封片,盖上盖玻片,封片,显微镜下拍照保存。
1.3.2 组织标本总RNA提取 取100 mg乳腺癌、癌旁组织置于研钵中,加入少量液氮后快速研磨。研磨充分后,加入2 ml Trizol试剂,混匀并转移至离心管。电动匀浆2 min后,以12 000 g/min离心5 min,弃沉淀,转移上清。加入1/5体积的氯仿,振荡混匀,室温静置15 min后,以12 000 g/min 4 ℃离心15 min。转移水相至新离心管,加入1/2体积异丙醇,混匀后,室温静置10 min。12 000g/min 4 ℃离心10 min。弃上清,加入等体积的75%乙醇,溶解沉淀。9 000 g/min离心5 min,弃上清,室温干燥,加入50 μl DEPC处理的无菌H2O溶解RNA样品。
1.3.3 逆转录合成cDNA 采用Titan One Tube RT-PCR Kit试剂盒,按表2比例配置反转录反应液,将RNA及反应液于37 ℃反应15 min,98 ℃酶失活5 min。结束反应,产物4 ℃保存备Real-time PCR使用。

表2 逆转录反应液(10 μl体系)
1.3.4 Real-time PCR 采用PowerUpTMSYBRTMGreen试剂盒,引物序列见表3。反应体系见表4。以荧光定量PCR仪进行扩增,扩增程序如下:95 ℃ 10 s×1次;(95 ℃ 5 s,60 ℃ 20 s)×40次。以β-actinCt值标准化目的基因Ct值,2△t法计算样品扩增倍数。
表3 PCR引物序列
表4 Real-time反应体系(50 μl)
1.3.5 Western-blot 以研磨法匀浆乳腺癌组织,加400 μl单混有蛋白酶抑制剂的去污剂裂解液裂解组织,置于冰上操作。裂解30 min后,将裂解液转移至1.5 ml EP管中,4 ℃ 12 000 rpm/min离心5 min,取上清分装于0.5 ml离心管,-20 ℃保存。以BCA法检测蛋白浓度。将蛋白样品加10×上样缓冲液,水浴煮沸5 min。以每孔30 μg蛋白的上样量行聚丙烯酰胺凝胶电泳,恒压80 v,溴酚蓝进入分离胶后调整电压为120 v继续电泳,至溴酚蓝迁移至分离胶底部,终止电泳。以4 ℃,300 mA恒流,70 min,将蛋白转移至PVDF转膜上,丽春红染色观察转膜效果。5%BSA封闭PVDF膜2 h,洗涤后,滴加兔抗SATB2溶液,4 ℃过夜孵育。第二天加入TBST洗涤去除多余一抗,与HRP标记的二抗室温孵育2 h。TBST清洗后,加入ECL化学发光底物,在化学发光仪上显影,拍照保存。
1.3.6 CCK8检测增殖 pGV141-SATB2质粒构建参考文献报道[6]。将处于对数生长期的人乳腺癌细胞MCF-7,以胰酶消化后,用DMEM培养基调整细胞浓度至1×105个/ml,每孔100 μl接种至96孔板。将细胞分为3组,1组pGV141空载组,1组pGV141-SATB2组,未加质粒的空白对照组。每组在培养的0 h,24 h、48 h加入CCK8溶液,每孔20 μl,4 h后终止培养。以酶标仪在450 nm处检测各孔吸光度值。
1.3.7 Transwell试验检测迁移、侵袭能力迁移试验
以0.2%BSA的无血清的DMEM培养基重悬制备单细胞悬液,细胞数为5×105个/ml,取200 μl铺于8 μm transwell小室上层,加500 μl含10%胎牛血清的DMEM培养基于24孔板底部,培养24 h后取走Transwell板,计数穿孔细胞数。侵袭试验:将300 μl无血清DMEM培养基加入8 μm Transwell小室上层,室温下水化基质胶20 min,弃去剩余液体。以0.2%BSA的无血清DMEM培养基配制浓度5×105个/ml的单细胞悬液,其余步骤同迁移试验。
60年来,盐湖股份秉承“为用户提供绿色镁锂钾”的愿景目标,以“深化改革、提升管理、做专做精、持续发展”16字为指导方针,按照“走出钾、抓住镁、发展锂、整合碱”的战略布局,体现“循环利用,产业报国”盐湖人的使命和担当精神,不断改革创新。5年来,四川盐湖化工坚定不移地执行盐湖股份的战略决策,崇尚“勤奋、谦虚、奉献、责任、干净、担当”的企业文化,不断完善营销网络,在国际国内市场上塑造了良好的“盐花”品牌形象。
1.4 统计学方法
采用SPSS22.0软件对数据进行统计学分析,计数资料以例(%)表示,组间比较采用χ2检验。P<0.05表示差异有统计学意义。
2 结果
2.1 SATB2在乳腺癌及癌旁组织中的表达情况
Real-time PCR检测结果显示,乳腺癌组织中SATB2 mRNA水平高于癌旁组织,差异有统计学意义(P<0.05)。Western-blot检测结果显示,乳腺癌组织中SATB2蛋白表达水平高于癌旁组织,差异有统计学意义(P<0.05)。见图1、图2。
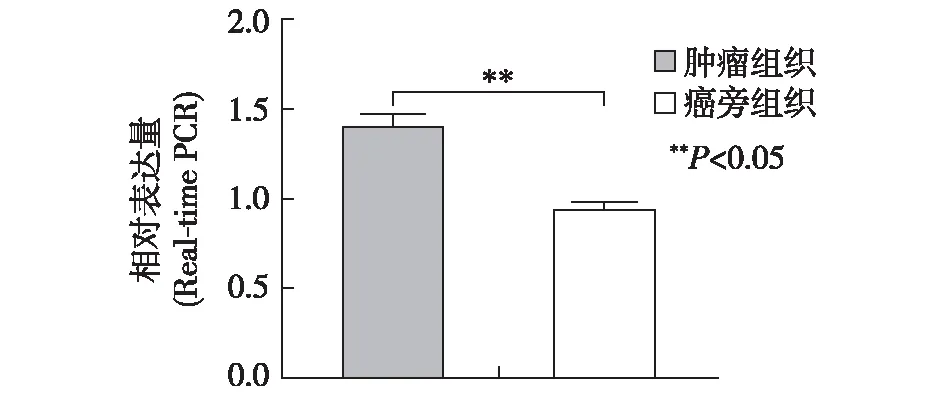
图1 Real-time PCR检测乳腺癌及癌旁组织SATB2表达情况
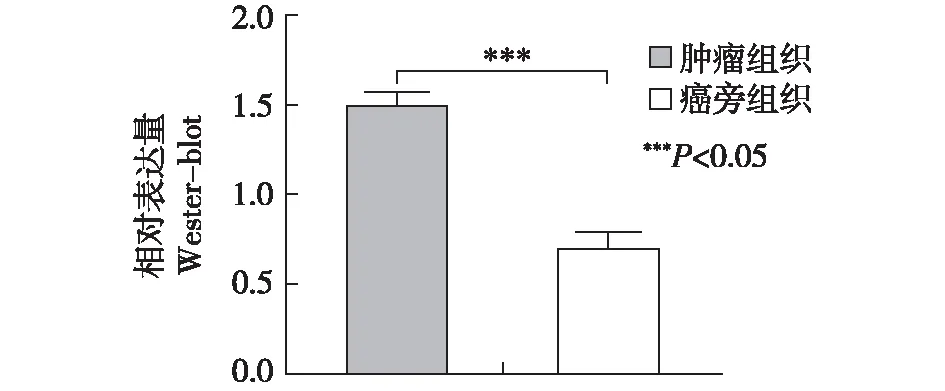
图2 Western-blot检测乳腺癌及癌旁组织中SATB2表达情况
2.2 SATB2免疫组化结果
80例乳腺癌组织中,65例呈阳性表达(81.25%),15例呈阴性表达。80例癌旁组织中,20例呈阳性表达(25.00%),60例呈阴性表达。乳腺癌组织中SATB2阳性表达率高于癌旁组织(P<0.05)。见图3、图4。

图3 乳腺癌组织中3ATB2免疫组化阳性例数比较
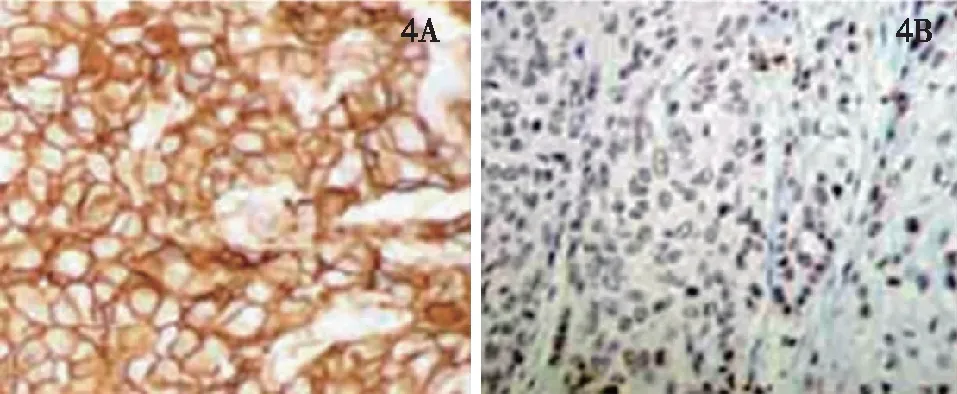
图4 乳腺癌组织(4A)及癌旁组织(4B)中SATB2表达情况(STAB法×400)
2.3 MCF-7细胞中SATB2转染效率
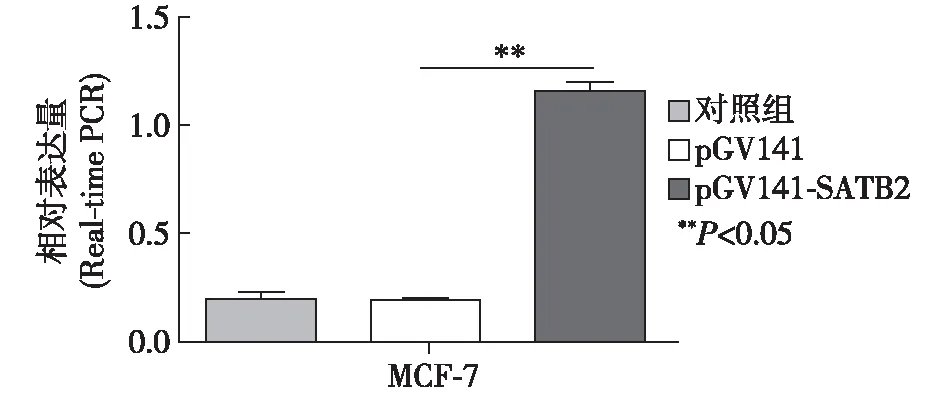
图5 Real-time PCR检测SATB2转染效率
2.4 MCF-7细胞转染SATB2后细胞增殖的影响
在MCF-7细胞中,转染pGV141-SATB2组细胞增殖率高于空白对照组及空载组(P<0.05)。见图6。
2.5 MCF-7细胞转染SATB2后迁移、侵袭的影响
MCF-7细胞中,转染pGV141-SATB2后迁移细胞数、侵袭细胞数均多于转染pGV141及空白对照组(P<0.05)。见图7。
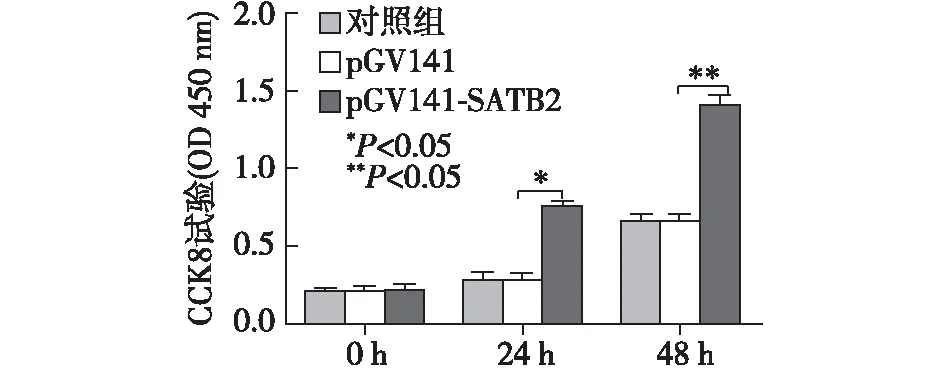
图6 MCF-7细胞中转染SATB2对细胞增殖的影响
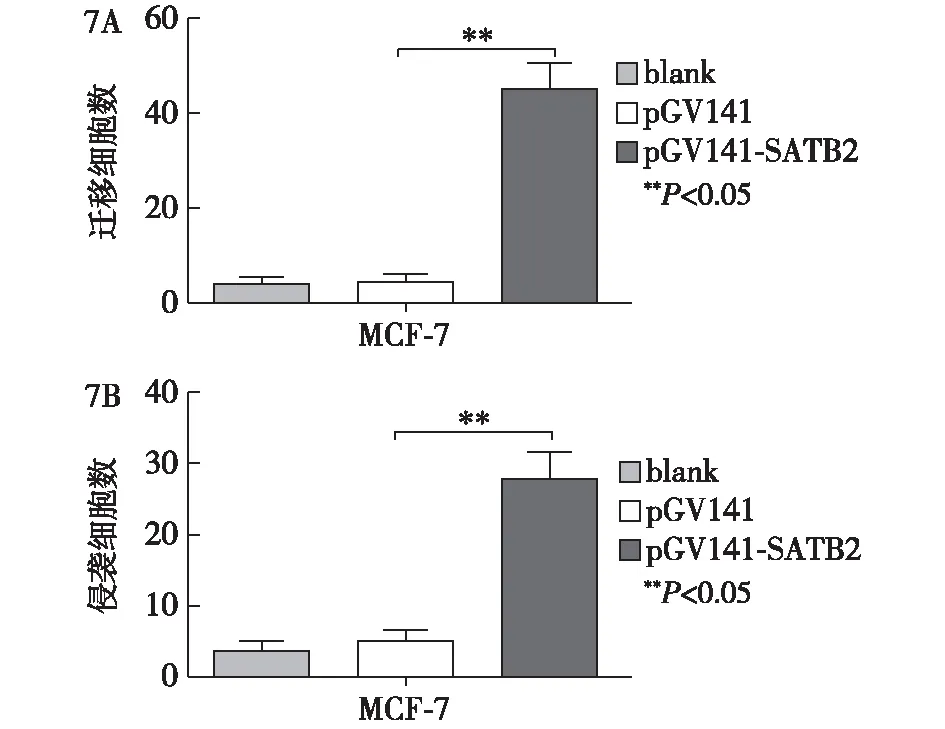
图7 MCF-7细胞中转染SATB2对细胞迁移(7A)、侵袭(7B)的影响
3 讨论
乳腺癌为世界范围内常见的恶性肿瘤,我国每年女性乳腺癌发病16.9万人[7],为女性第二位最常见的恶性肿瘤。乳腺癌的发生与环境、遗传、生活方式等密切相关[8-9],在肿瘤发生、发展过程中,受到多种相关基因的调控。SATB2基因位于人类2号染色体2q33区,编码SATB2蛋白,为核基质结合区结合蛋白,可通过影响染色质结构[10],实现对目标基因表达的特异性调控,从而调节细胞分化、凋亡、肿瘤生长及转移等[11]。在牙周疾病、骨髓疾病、肿瘤等的发生、发展中具有重要的作用[12]。Zhang等[13]的报道显示,特殊富含AT序列结合蛋白SATB2在颅面部发育、成骨细胞分化中起关键作用,可与核基质结合区结合,并以MAR依赖的方式激活多种基因转录过程,直接或间接调控主要的骨基因表达。SATB2的表达与非小细胞肺癌增殖、转移相关[14]。在乳腺癌组织中表达水平降低,SATB2的表达水平与临床分期、组织分化呈负相关;与患者总生存率和无疾病生存期呈正相关。多因素分析提示SATB2的表达水平可以作为独立的预后分析因素[15]。
SATB2基因被证实在多种肿瘤组织中高表达[16-17],表达水平与肿瘤恶性程度密切相关,但在乳腺癌中表达的报道尚不多见。本研究结果显示,乳腺癌组织中SATB2阳性表达率高于癌旁组织,提示SATB2与乳腺癌的发生关系密切。通过Western-blot、PCR等方法观察乳腺癌组织与癌旁组织中SATB2的相对表达量的结果显示,SATB2在乳腺癌中的表达量高于癌旁组织,也证实了免疫组化的结果,这与Xu等[18]的研究结论一致。
增殖、转移为恶性肿瘤发生、发展的主要特征,抑制肿瘤细胞增殖对提高肿瘤患者预后意义重大。为进一步探讨SATB2在乳腺癌发生、发展中的作用,笔者从乳腺癌细胞增殖、迁移、侵袭等生物学行为入手,观察转染SATB2基因后,上述生物学行为改变情况。通过构建了pGV141-SATB2质粒,以脂质体转染技术,观察转染SATB2基因至MCF-7细胞后,对乳腺癌细胞增殖、迁移、侵袭等生物学特性的影响。结果显示,转染SATB2基因后,乳腺癌细胞增殖率显著增加,迁移、侵袭至下层细胞数显著增多。说明转染SATB2基因可促进MCF-7细胞增殖、迁移及侵袭,提示SATB2可能为原癌基因。肿瘤的侵袭、转移是多步骤、多因素相互作用的复杂过程,涉及多种信号转导通路、相关蛋白分子的异常表达及肿瘤血管形成等多个生物学过程[19]。诱导肿瘤血管生成为肿瘤生长、浸润、发生转移的重要前提,肿瘤细胞可通过调节细胞表面不同黏附分子的表达,降低细胞间黏附性,细胞外基质间粘附性增加,此即为肿瘤侵袭转移的起始[20]。在乳腺癌细胞系MCF-7迁移、侵袭的结果表明,转染SATB2基因后,MCF-7细胞迁移、侵袭能力均显著增强,表现为通过Transwell小室的细胞数明显增多。
综上所述,本研究初步证实了SATB2基因在乳腺癌中表达量高于癌旁组织。在乳腺癌细胞系MCF-7中,转染SATB2基因可促进MCF-7细胞增殖、迁移、侵袭,但SATB2促进MCF-7细胞增殖、迁移、侵袭的具体机制尚未阐明。下一步需筛选乳腺癌中高表达的信号转导通路或离子通道、血管生成相关基因,观察SATB2是否通过激活信号转导通路或离子通道,促进血管生成,使得乳腺癌细胞MCF-7的增殖、迁移、侵袭能力增强。
