营养支持治疗对肝癌患者术后应激指标、营养状况、远期生存率的影响
2020-06-26陈怡曾玲杨沁吴蓓曾义岚
陈怡, 曾玲, 杨沁, 吴蓓, 曾义岚
肝癌是临床上较为常见的恶性肿瘤之一。近年来,我国肝癌的临床发病率、病死率越来越高,居恶性肿瘤第2位[1]。目前,早期肝切除术是肝癌治疗最有效的根治性手术,但是因手术存在一定程度的创伤,患者术后往往出现白蛋白合成降低,营养缺乏,免疫功能降低,抗感染能力低下,组织的再生和修复能力降低,术后并发症、复发、远处转移的发生风险增加,尤其是术后远期生存率低的现状依然困扰临床[2-3]。研究显示,肝癌切除术后应用营养支持在改善患者的营养状态、促进患者术后转归与恢复方面具有良好的效果[4]。但营养支持的方式有肠内营养支持(enteral nutritional,EN)和肠外营养支持(parenteral nutrition,PN)。临床上多将早期肠内营养支持作为外科手术后的首选营养支持方案,文献报道多侧重于研究其在改善肝癌术后患者肝功能、营养状况等方面的效果,而对于营养支持治疗对患者手术创伤所引起的应激反应、远期生存率、术后并发症等方面的影响报道较少。本文着重以术后应激创伤指标、营养学指标、远期生存率、术后并发症等方面的观察为切入点,就肠内营养支持与肠外营养支持对肝癌术后患者的影响进行对比研究,旨在为肝癌术后患者营养支持提供合理方案。
1 资料与方法
1.1 一般资料 成都市公共卫生临床医疗中心选取2015年1月至2016年6月收治的肝癌患者作为研究对象。纳入标准:①经临床检查明确诊断为肝癌;②表述清楚,意识清晰;③由同一组手术医师完成手术,均行肝癌根治术治疗;④无重要脏器疾病,无合并感染性、免疫性、代谢性疾病;⑤术前无腹部手术史;⑥术前1个月内无免疫抑制剂使用史;⑦无肿瘤转移,未放化疗;⑧能长期坚持完成营养治疗,对营养治疗耐受者,可保持随访;⑨自愿加入本次研究,并签署知情同意书。排除标准:①合并心、肺、肝、肾等严重器官功能障碍;②存在精神疾病,无法正常沟通者;③合并其他恶性肿瘤者;④合并代谢性疾病、免疫功能、凝血功能疾患者;⑤合并肝功能Child-Pugh 分级为C级、远处转移等无法行肝癌根治术者。根据纳入和排除标准,本研究共纳入肝癌患者112例。将患者按随机数字表法分为对照组和治疗组,每组56例。对照组中男35例,女21例;平均年龄(57.45±3.60)岁;平均体质量指数(23.76±1.33)kg/m2;病理类型:胆管细胞癌者9例,肝细胞癌者47例;TNM分期:Ⅰ期者30例,Ⅱ期者23例,Ⅲa期者3例;肝功能Child-Pugh分级:A级者51例,B级者5例;手术方案:右半肝切除术者17例,左半肝切除术术者12例,中肝切除术者6例,1个肝段切除术者9例,2个肝段切除术者12例;观察组中男32例,女24例;平均年龄(57.50±3.48)岁;平均体质量指数(23.85±1.42)kg/m2;病理类型:胆管细胞癌者7例,肝细胞癌者49例;TNM分期:Ⅰ期者32例,Ⅱ期者20例,Ⅲa期者4例;肝功能Child-Pugh分级:A级者55例,B级者1例;手术方案:右半肝切除术者20例,左半肝切除术术者11例,中肝切除术者5例,1个肝段切除术者7例,2个肝段切除术者13例;两组的性别、年龄、BMI、病理类型、TNM分期、肝功能Child-Pugh分级、手术方案等一般资料比较,差异均无统计学意义(P>0.05),具有可比性。本研究经成都市公共卫生临床医疗中心伦理委员会审批通过。
1.2 治疗方法 对照组患者术前实施中心静脉置管,术后24 h在常规处理的基础上给予静脉营养输注,非蛋白质热量的60%~70%由葡萄糖供给,非蛋白质热量的30%~40%由脂肪乳供给,氮源由8.5%复方氨基酸注射液供给,0.14g·kg-1·d-1,输注时间12~16 h/d。并常规补充微量元素、水溶性维生素、电解质。
观察组患者则给予早期肠内营养输注治疗,术中辅助将术前经鼻留置的肠内营养管远端送入Treitz韧带以下20 cm的空肠内。术后24 h输注肠内营养乳剂(TPF-T)(国药准字H20040723,华瑞制药有限公司生产),热氮比为131∶ 1,保输入量为20 kcal·kg-1·d-1,保持营养液温度40 ℃左右,输注时间不少于20 h,两组患者均连续干预7 d。
1.3 观察指标 ①术后胃肠功能恢复情况:记录首次肛门排气时间、首次排便时间、早期进食时间。②术后创伤应激指标检测:分别于术前、术后2 d、术后7 d采用放射免疫法检测应激反应指标皮质醇(cortisol,Cor)、醛固酮(aldosterone,ALD)水平,采用高效液相色谱联合电化学法检测去甲肾上腺素(norepin ephrine,Ne)水平;以酶联免疫吸附法ELISA测定血清肿瘤坏死因子-α(tumor necrosis factor alpha,TNF-α)白细胞介素-6(interleukin-6,IL-6)水平。③ 营养状况:分别于术前、术后7 d用全自动血液分析仪检测营养学指标血红蛋白(hemoglobin,Hb) 、白蛋白(albumin,Alb)、转铁蛋白(transferrin,TRF)、前白蛋白(prealbumin,PA)、红细胞(red blood cell,RBC)水平。④并发症及生存率:观察术后发热、切口愈合不良、胸腔积液、胸腔感染、低蛋白血症、胆瘘等并发症的发生率,随访3年统计生存率。
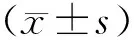
2 结果
2.1 两组术后患者恢复情况对比 与对照组组间比较,观察组患者术后恢复更快,首次肛门排气时间、首次排便时间、早期进食时间均缩短,差异均有统计学意义(均P<0.05)。见表1。
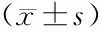
表1 两组术后患者恢复情况对比
2.2 两组患者术后创伤应激指标比较 两组患者术前的应激指标Cor、Ne、ALD、TNF-α、IL-6相比,差异无统计学意义(P>0.05);术后两组的应激指标Cor、Ne、ALD、TNF-α、IL-6均先升高,与术前相比,差异有统计学意义(P<0.05);后随着时间的推移,两组的的创伤应激指标Cor、Ne、ALD、TNF-α、IL-6逐渐降低,但相同时间点组间比较,观察组患者的各应激指标均低于对照组,差异有统计学意义(P<0.05)。见表2。
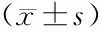
表2 术后创伤应激指标在两组间比较
2.3 两组患者营养状况比较 两组患者术前的Hb、Alb、TRF、PA、RBC指标相比,差异无统计学意义(P>0.05);术后观察组Hb、Alb、TRF、PA、RBC指标优于对照组,差异有统计学意义(P<0.05)。见表3。
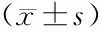
表3 两组患者营养状况比较
2.4 两组患者术后并发症发生率及生存率比较 术后观察组出现发热2例,切口愈合不良I级3例、胸腔积液1例,并发症的发生率为8.93%(7/56);对照组患者术后出现发热5例、切口愈合不良 I级6例、胸腔积液2例、低蛋白血症1例、胆瘘1例,并发症的发生率为26.79%(15/56),观察组并发症发生率降低,差异有统计学意义(χ2=4.747,P=0.029)。
观察组中位生存期为26个月,对照组中位生存期为21个月,经Log-Rank检验,差异有统计学意义(χ2=14.519,P<0.001)。见图1。
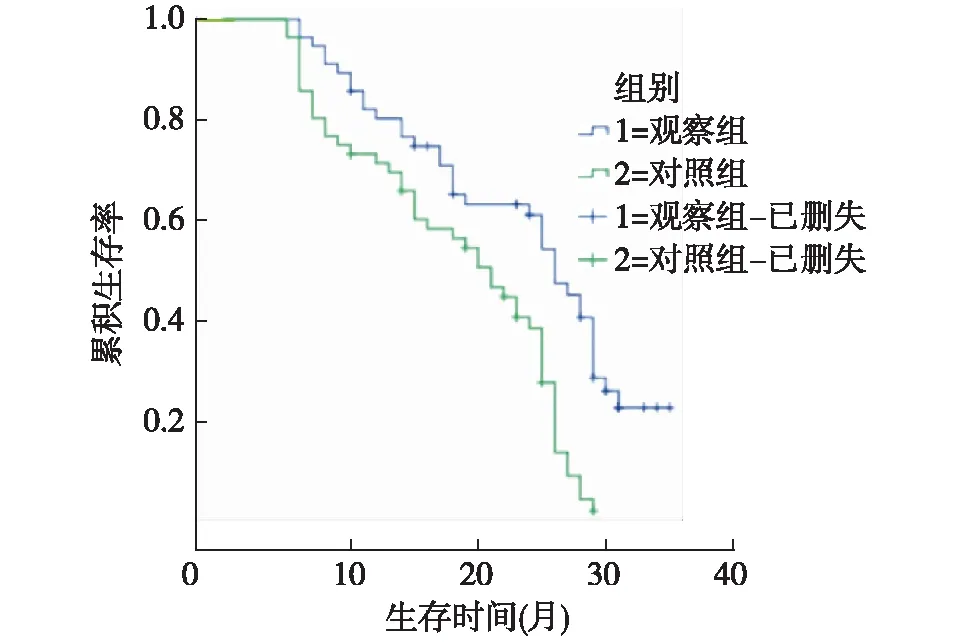
图1 两组患者的生存曲线比较
3 讨论
近年来,肝癌的发病率逐年上升,且趋于年轻化,临床尚无根治方法,大部分患者发现时已至晚期,预后差,肿瘤细胞已发生远端转移,5年生存率仅26.1%[5]。肝切除术为肝癌首选治疗方法,然而,肝癌患者术前营养状态差,加之手术切除会导致患者肝功能损伤加重,造成机体蛋白质分解加快,血浆蛋白降低,免疫功能受到抑制、机体修复能力下降,增加术后并发症的发生率,影响预后[6-8]。
本研究中,考虑到肝癌手术后胃、大肠功能可在24~48 h逐渐恢复正常,故患者自肝癌术后24 h开始给予营养支持治疗,结果表明,肠内营养支持治疗的患者比静脉营养输注治疗的患者术后恢复更快,首次肛门排气时间、首次排便时间、早期进食时间均缩短,术后患者的营养状况更好,随访3年的生存率更高,术后患者并发症的发生率更低(P<0.05)。提示肠内营养支持治疗更利于促进术后患者的机体恢复,改善患者术后营养状况,能有效的延长患者的中远期生存率,降低并发症的发生率。分析原因为肠内营养乳剂(TPF-T)属于高能量密度(5.46 kJ/ml)、高蛋白含量(18%)的肠内营养制剂,其能及时补充蛋白质,促进了机体蛋白质的生成,促进营养学指标的提升;另外,肠内营养支持治疗过程中营养元素经肠道吸收进入肝脏,有助于改善肝切除术后门静脉和肝脏的血流灌注,从而恢复肝功能,促进胃肠蠕动和胆囊收缩,且该治疗方式能较好保护肠黏膜细胞结构和功能,通过肠道为患者机体提供充足的营养需求,随着患者消化吸收的营养物质逐渐增多,机体免疫能力逐渐提高,营养状态好转,有效防治术后感染等并发症的发生,与王剑彬等[9]报道结果一致。
肝癌手术作为一种侵入性操作,因手术强烈刺激,可致患者机体出现一定的应激反应,兴奋交感神经-肾上腺髓质系统、下丘脑-垂体-肾上腺皮质系统,从而分泌大量促肾上腺皮质激素,进而促进皮质醇和肾上腺素水平上升[10-11]。应激反应持续存在会引起代谢紊乱,增加术后感染、出血等并发症的发生率,影响术后患者机体恢复速度及程度[12]。本研究结果显示,术后两组患者的创伤应激指标Cor、Ne、ALD均先升高,后随着时间的推移而逐渐降低,相同时间点组间比较,以观察组患者的各应激指标变化低于对照组(P<0.05)。这进一步说明,肝癌手术创伤会増强机体的应激反应,但早期肠内营养支持治疗的患者术后应激反应相对较轻,可避免肝癌术后患者产生过度应激反应,减轻手术创伤,且持续时间较短,患者术后恢复较快,有利于患者预后。炎性因子TNF-α是一种由巨噬细胞、单核细胞活化产生的炎性细胞因子,可以直接杀伤、抑制肿瘤细胞的细胞因子,与感染密切相关[13];IL-6可刺激肝细胞合成急性期蛋白,刺激活化的B细胞增殖合成分泌抗体,直接参与炎症反应的发生[14]。本研究通过检测炎性反应指标发现,术后两组患者的TNF-α、IL-6等炎性反应指标均先升高,后逐渐降低,相同时间点组间比较,以观察组患者的各炎性反应指标变化低于对照组(P<0.05)。说明早期肠内营养支持治疗能够发挥免疫调节作用,增加机体抵抗力,调控促炎、抗炎细胞因子的产生,减少患者术后发生炎症损伤的风险,与徐林等[15]报道结果一致。
综上所述,肝癌术后及时给予营养支持可直接经肠胃吸收、利用,可尽早恢复胃肠功能,给机体补充足够的营养物质,改善机体的营养状态,降低术后并发症的发生,考虑机制可能与其可提高机体免疫功能、减轻手术对机体的应激性损伤、抑制机体炎症损伤有关,有利于促进患者术后机体的快速恢复,延长患者的中远期生存率,且具有给药方便、费用低廉的优点,其推广及应用有很好的发展前景。
