维生素B6修饰四氧化三铁纳米酶活性及其抗变异链球菌作用
2020-06-24丁黎明高利增许卓斌
成 荣, 王 萧, 程 璐, 张 唯, 丁黎明, 高利增, 2, 许卓斌, 2
( 扬州大学, 1. 医学院; 2. 转化医学研究院; 江苏 扬州, 225001)
纳米酶是一类新型的似天然酶催化活性的纳米材料, 能够模拟生理条件下的催化行为[1]。对比天然酶,纳米酶具有突出的催化活性、优异的稳定性以及低廉的制备成本等优点[2-3], 可广泛应用于肿瘤诊疗、抗菌抗病毒、抗氧化与抗衰老以及检测诊断等生物医学领域[4-8]。目前,根据纳米酶的化学成分进行分类,主要包括金属氧化物材料、贵金属纳米材料和非金属纳米材料[9-10]。四氧化三铁纳米酶(IONzymes)是目前应用较为广泛的纳米酶,于2007年被发现具有过氧化物酶催化活性,在颜色底物存在下,其能够催化过氧化氢(H2O2)产生颜色反应[11], 此后又陆续发现其具有过氧化氢酶催化活性、氧化物酶催化活性和超氧化物歧化酶催化活性。
近年来,有关IONzymes的修饰与改造的相关研究[12-13]越来越多,出现了大量催化活性更高、催化底物种类更多的新型纳米酶,进一步丰富了IONzymes在生物医学领域的应用。维生素是维持生命的必需物质,与机体代谢密切相关。维生素B6参与机体抗氧化、抗炎反应,能够提高血清中谷胱甘肽(GSH)过氧化物酶和超氧化物歧化酶活性,维持机体正常的生长、代谢、发育过程。本研究通过溶剂热法合成了维生素B6修饰的四氧化三铁纳米酶(VB6-IONzymes),并通过不同理化手段对其进行表征,期望获得催化活性更高、更为稳定有效的纳米酶,并探索通过发挥高效过氧化物酶活性在抗口腔变异链球菌(S.mutans)以及龋齿防治方面的应用价值,现报告如下。
1 材料与方法
1.1 实验材料
六水合三氯化铁(FeCl3·6H2O)、乙二醇、3, 3′, 5, 5′-四甲基联苯胺(TMB)和醋酸钠均购自Sigma有限公司(美国),维生素B6和二甲基亚砜(DMSO)均购自生物工程股份有限公司(上海),过氧化氢购自阿拉丁试剂有限公司,蛋白胨、琼脂粉和酵母提取物均购自Thermo Fisher 有限公司,磷酸二氢钠、磷酸二氢钾、氯化钠、氯化钾均购自中国医药集团有限公司,葡萄糖和蔗糖购自上海国药集团,苯甲基磺酰氟(PMSF)购自索莱宝科技有限公司(北京)。
1.2 VB6-IONzymes的制备
材料由溶剂热法合成制备得到。称取1.35 g FeCl3·6H2O并加入到40 mL乙二醇中,磁力搅拌使FeCl3· 6H2O溶解,得到澄清液体。在快速搅拌下缓慢加入3.60 g无水醋酸钠,得到均匀混悬液。加入2.00 mmol维生素B6继续搅拌,超声10 min, 使维生素B6与上述溶液充分混匀。将搅拌得到的液体转移至50.00 mL聚四氟乙烯反应釜中, 200 ℃烘箱加热12 h。反应完全后将反应釜取出,自然冷却至室温,用乙醇和水交替洗涤产物3次,得到黑色沉淀物。最后,将黑色沉淀物放入60 ℃烘箱烘干即可。
1.3 VB6-IONzymes的电镜表征
利用场发射扫描电子显微镜(SEM)与透射电子显微镜(TEM)对本材料的体积和形貌进行观察。称取适量VB6-IONzymes粉末配置成乙醇溶液,于TEM下观察。将乙醇溶液少量多次地滴加在光滑硅片表面,烘箱烘干液体,硅片表面喷金,于SEM下观察。
1.4 VB6-IONzymes的酶活测定与电子顺磁共振波谱(ESR)测试
利用多功能酶标仪对VB6-IONzymes的过氧化物酶活性进行检测。反应总体系200.00 μL, 在96孔板中进行。在0.10 mol/L、pH值为4.50的醋酸钠缓冲体系下,每孔加入样品溶液(终浓度10.00 μg/mL)、一定浓度的TMB和H2O2。当以H2O2为变量时,加浓度梯度为0、18.63、37.13、74.25、148.50、297.00、594.00和1 188.00 mmol/L的H2O2, 此时TMB终浓度为833.00 μmol/L。37 ℃条件下,用酶标仪扫描652.00 nm下每孔吸光度,扫描时间持续300 s, 使用GraphPad Prism软件分析数据获得米氏方程并比较催化效率。
采用电子顺磁共振波谱仪对实验中羟基自由基的产生情况进行检测。反应总体系100.00 μL, 加入5.00 μL VB6-IONzymes溶液(2.00 mg/mL)、20.00 μL自由基捕获剂BMPO(0.01 mol/L)、65.00 μL醋酸钠(pH值为4.55)和10.00 μL H2O2(3.33 mol/L), 对照组不加VB6-IONzymes溶液,振荡混匀,取样,电子顺磁共振波谱仪检测样品中羟基自由基特征峰。
1.5 VB6-IONzymes抗变异链球菌测试
将变异链球菌UA159接种于经过滤的含2.50%蛋白胨、1.50%酵母提取物和1.00%葡萄糖的超滤胰蛋白胨酵母抽提液(UFTYE)的液体培养基上, 37 ℃、5% CO2培养箱内过夜培养。次日,按比例转接细菌并培养至600.00 nm波长处吸光值(OD600)达到1.00。1.50 mL离心管中加入800.00 μL PBS缓冲液(pH值为7.40)和100.00 μL菌液,再分别加入100.00 μL PBS缓冲液、100.00 μL IONzymes(终浓度0.50 mg/mL)或VB6-IONzymes(终浓度0.50 mg/mL), 混匀并作用30 min。以10倍梯度稀释混合液,并取100.00 μL适宜梯度的稀释液在含2.50%蛋白胨、1.50%酵母提取物、1.75%琼脂和1.00%葡萄糖的UFTYE固体培养基表面均匀涂布。将琼脂板倒置于37 ℃、5% CO2培养箱中培养,约36 h后取出计数。
1.6 VB6-IONzymes抗变异链球菌生物膜测试
将变异链球菌UA159接种于UFTYE液体培养基, 37 ℃、5% CO2培养箱内过夜培养,次日转接细菌并培养至对数生长期(OD600=1.00)。早晨空腹取唾液与1.00 mmol/L苯甲基磺酰氟(PMSF)混匀, 4 ℃下6 500转/min离心10 min, 取上清液过滤除菌备用。将高压灭菌后的生物膜培养装置放入无菌24孔板,每孔加入2.80 mL无菌唾液, 37 ℃培养箱中静置1 h。将与唾液孵育过的羟基磷灰石圆片(sHA)用无菌水蘸洗3次,然后分别与VB6-IONzymes溶液(终浓度0.50 mg/mL)、H2O2(终浓度1.00%)和VB6-IONzymes溶液+H2O2(VB6-IONzymes终浓度0.50 mg/mL, H2O2终浓度1.00%)充分接触30 min。
另取一无菌24孔板,每孔加入2.80 mL含1.00%蔗糖的UFTYE液体培养基(其中含浓度为105CFU/mL的变异链球菌),将经过处理的羟基磷灰石圆片放入,实验时始终保持圆片与孔板垂直。37 ℃、5% CO2培养箱内恒温培养,培养总时长43 h。在19、29 h时需更换新鲜无菌UFTYE液体培养基,并将圆片与上述各组溶液再次充分接触30 min后用清水洗涤3次。将羟基磷灰石表面培养至43 h的变异链球菌生物膜用刮刀小心刮下,超声使其完全均匀破碎,取100.00 μL液体梯度稀释,在UFTYE固体培养基表面均匀涂布,倒置于37 ℃、5% CO2培养箱中培养,培养约36 h后取出计数。最后将剩余的生物膜悬液转移至烘箱中, 60 ℃烘干,称重即得干重。
1.7 统计学分析
采用 Excel与GraphPad Prism 5数据分析软件进行数据输入、整理及统计,采用t检验比较不同组数据的差异,P<0.05为差异有统计学意义。
2 结 果
2.1 VB6-IONzymes的制备与表征
通过溶剂热法,本研究首先合成了IONzymes。扫描电镜显示,未修饰的IONzymes呈现出规则的球形(图1B), 粒径约为200.00 nm, 体积均一。通过在合成过程中加入2.00 mmol的维生素B6(图1A)对其进行修饰,获得VB6-IONzymes。扫描电镜结果显示,纳米酶形貌发生显著变化,呈现不规则形态,粒径减小至100.00 nm以下(图1C)。透射电镜结果也显示, VB6-IONzymes失去球体形态而变得不规则(图1D)。
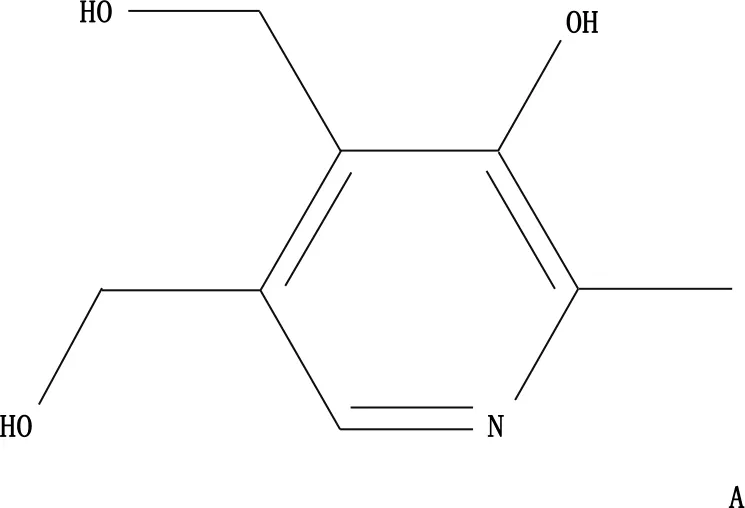


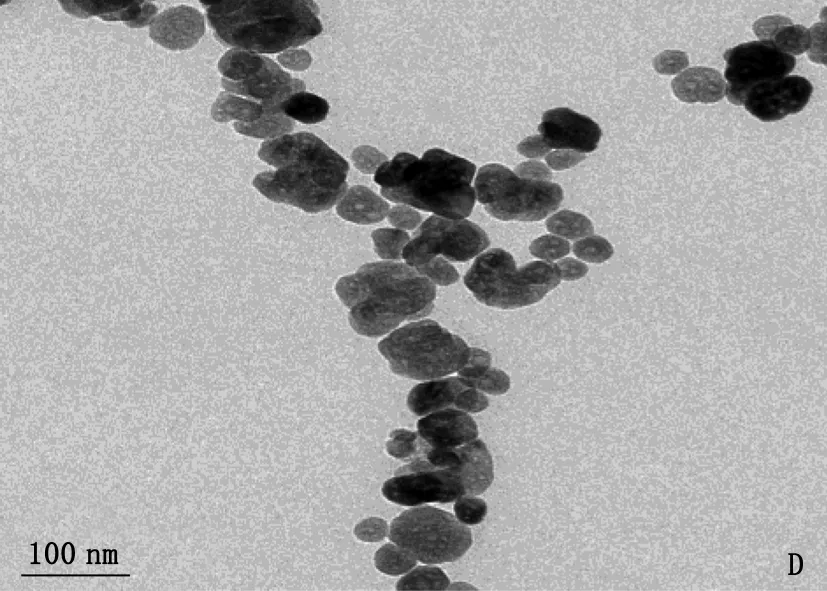
A: 维生素B6结构; B: IONzymes扫描电镜表征; C: VB6-IONzymes扫描电镜表征;D: VB6-IONzymes透射电镜表征。
图1 维生素B6结构及其修饰IONzymes前后电镜表征
2.2 VB6-IONzymes酶活性显著增强
通过检测IONzymes在维生素B6修饰前后的过氧化物酶活性发现,未修饰IONzymes的拟过氧化物酶活性较低,其Vmax/Km在以过氧化氢为变量时为3.21×10-7/s。经维生素B6修饰后, VB6-IONzymes的过氧化物酶活性明显提高,Vmax/Km达到6.99×10-7/s(图2A)。Vmax指最大反应速度,Km指米氏常数。
为了进一步确定经维生素B6修饰的IONzymes对H2O2的催化能力,本研究用电子顺磁共振波谱仪检测了VB6-IONzymes催化H2O2产生羟基自由基的能力。由于在自然状态下短时间内H2O2是无法产生大量的羟基自由基,而过氧化物酶则可以加速这一反应生成。结果显示,在0.10 mol/L、pH值为4.50的醋酸钠溶液中,在H2O2和BMPO存在情况下, VB6-IONzymes可以快速催化H2O2产生明显的羟基自由基信号(图2B), 这是由于VB6-IONzymes在酸性环境下具有拟过氧化物酶活性,能够催化过氧化氢分解产生羟基自由基。
2.3 VB6-IONzymes对变异链球菌杀伤作用
本研究对比了经维生素B6修饰前后IONzymes对变异链球菌的抑制情况。在实验条件下,未经修饰的IONzymes对变异链球菌无明显作用,而0.50 mg/mL VB6-IONzymes对变异链球菌抑制效果接近50%, 差异有统计学意义(P<0.001)。见图3。

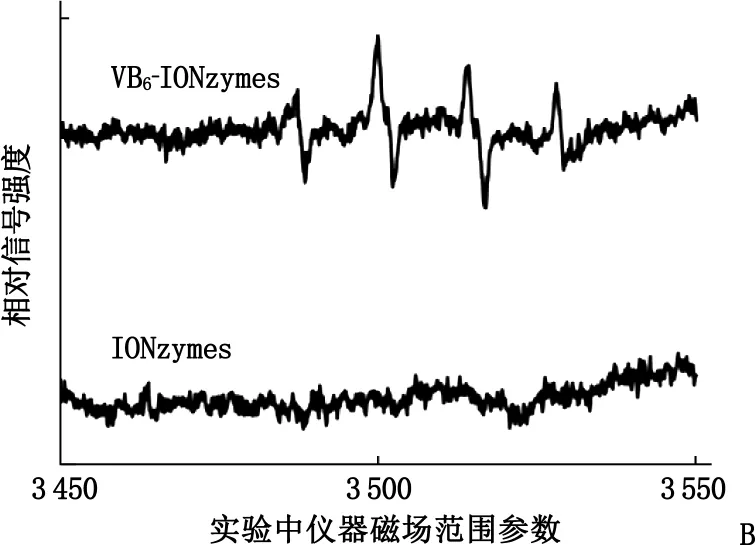
A: VB6-IONzymes拟过氧化物酶动力学拟合曲线; B: VB6-IONzymes EPR测定。
图2 VB6-IONzymes拟过氧化物酶动力学曲线与电子顺磁共振波谱图
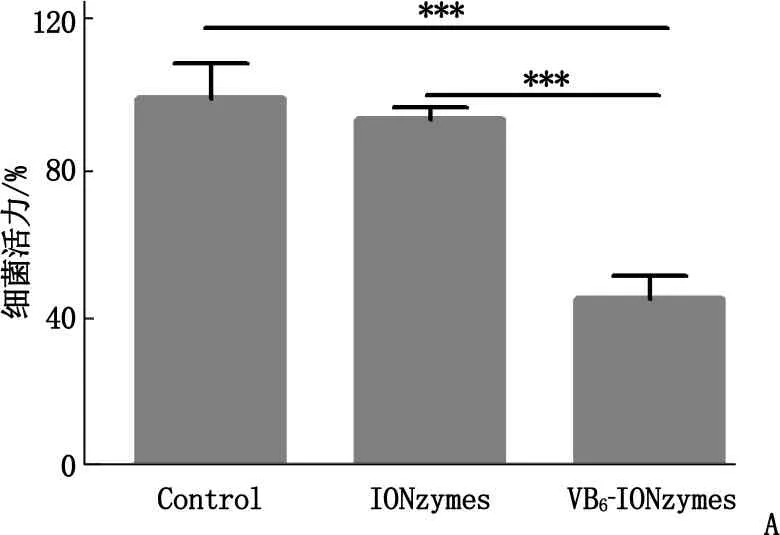

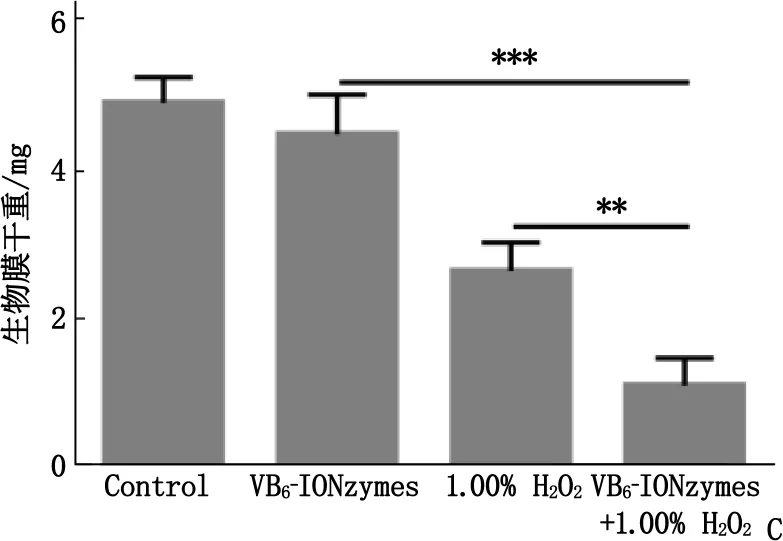
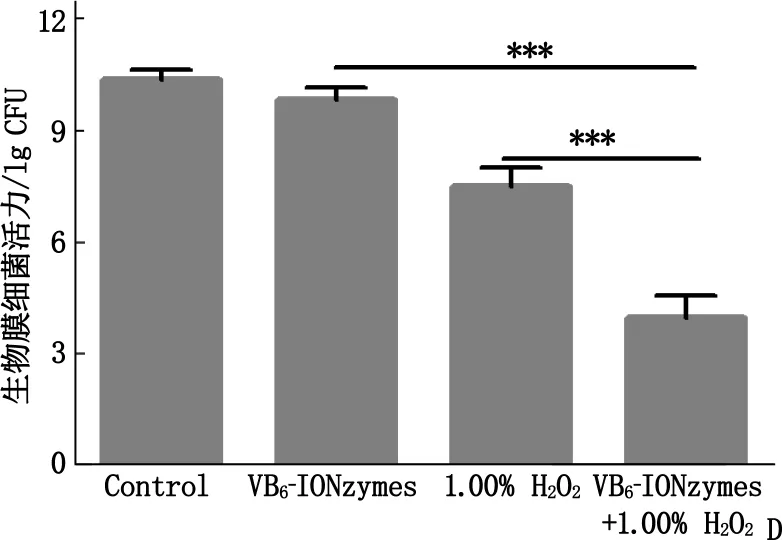
A: IONzymes与VB6-IONzymes对S.mutans抑制作用,与VB6-IONzymes比较, ***P<0.001; B:S.mutans生物膜培养装置;C: VB6-IONzymes协同1.00% H2O2抑制S.mutans生物膜干重,与VB6-IONzymes+1.00% H2O2比较, **P<0.01, ***P<0.001;D: VB6-IONzymes协同1.00% H2O2抑制S.mutans生物膜内细菌增殖,与VB6-IONzymes+1.00% H2O2比较, ***P<0.001。
图3 VB6-IONzymes抗变异链球菌与生物膜效果
2.4 VB6-IONzymes促进低浓度H2O2对变异链球菌形成生物膜的抑制作用
本研究评估了VB6-IONzymes协同1.00% H2O2对变异链球菌生物膜的清除效果,在特定条件下分别对形成生物膜的变异链球菌数目以及生物膜干重进行统计。
经过19、29、43 h这3个时点的处理后,在43 h时对各实验组进行统计。结果显示,药物协同组处理过的生物膜的干重显著降低(P<0.01或P<0.001), 相比于阴性对照组下降了77.28%, 相比于单纯使用1.00% H2O2组下降了46.16%, 表明VB6-IONzymes协同1.00% H2O2能够显著抑制变异链球菌形成的生物膜。同时, VB6-IONzymes协同1.00% H2O2也能明显抑制生物膜内变异链球菌的数量。在经过3次给药后,生物膜内变异链球菌残留量骤减,增殖速度以及形成生物膜的能力显著下降(P<0.001), 具有从根本上抑制生物膜形成的作用。见图3。
3 讨 论
纳米酶作为过氧化物酶的模拟物,能够在低浓度H2O2存在时,将其催化生成高活性的羟基自由基,目前被用于抗肿瘤与抗菌领域[14]。众所周知,口腔细菌被包裹在具有保护作用的细胞外基质,因此很难处理或除去。纳米酶因具有过氧化物酶催化活性,能够在酸性条件下催化H2O2转化生成羟基自由基,降解生物膜并且快速有效地杀死生物膜中的细菌。
本研究主要利用羟基自由基的高抗菌活性,拟开发具有更好的抗口腔生物膜效果和口腔微环境稳定性的新型抗菌材料[15-16]。本研究利用溶剂热法成功地将IONzymes进行维生素B6修饰得到VB6-IONzymes。本研究结果表明, IONzymes经过维生素B6修饰后体积明显变小,且酶反应动力学实验分析表明VB6-IONzymes过氧化物酶催化活性得到显著增强。此外,对比IONzymes, VB6-IONzymes协同H2O2可发挥更强的抗口腔生物膜的效果,口腔生物膜干重与生物膜内部残留细菌均得到有效减少。
