免疫检测点抑制剂治疗后“超进展”的晚期肺腺癌患者2例及文献复习*
2020-06-23葛俊郑敏田雨可李娟
葛俊,郑敏,田雨可,李娟
610041 成都,四川省肿瘤医院·研究所,四川省癌症防治中心,电子科技大学医学院 肿瘤内科
肺癌是世界范围内发病率和死亡率最高的恶性肿瘤[1-2]。近年来,肺癌在中国人群中展现出了发病率上升的趋势,对国民健康构成了极大的威胁。新诊断的肺癌患者中,80%以上是非小细胞肺癌(Non-small-cell lung cancer,NSCLC),且大部分患者是晚期[3-4]。免疫检测点抑制剂已在多种肿瘤中被证实具有改善总生存的作用。多种抗程序死亡蛋白1(programmed death protein 1,PD-1)或其配体PD-L1的抗体药物已经被美国食品药品监督局批准用于治疗NSCLC[5-16]。然而,PD-1或PD-L1抗体单药治疗的客观缓解率仅仅10%~30%[11,17]。值得注意的是,约10%的患者在治疗中表现出肿瘤加速生长的情况,临床上将其称为超进展(hyper-progressive disease,HPD)。这一现象说明,少部分患者接受免疫检测点抑制剂治疗不仅不能获益,甚至可能缩短其生存时间[18-20]。但是目前关于HPD的报导基本都来自于外文文献。国内肿瘤医生仍然需要对中国人群中的这一现象及患者的临床病理特征进行更多的研究。因此,本文希望通过报导两例在免疫检测点抑制剂治疗后发生HPD的NSCLC患者,增强肿瘤医生对于HPD现象的认识。
1 临床资料
本研究包含2例晚期肺腺癌患者。患者甲,男性,50岁,因“腰背痛1年”首次入院,有30年吸烟史。完善颅脑及颈部增强MRI、胸腹部增强CT提示:左肺下叶肿瘤、颈7椎体、腰2~5椎体、胸骨柄及双侧多根肋骨、骨盆转移。腰3椎体软组织穿刺活检后行免疫组化提示肺腺癌,肿瘤细胞PD-L1(90%阳性,Ventana SP142试剂盒)、ALK-V(D5F3,-)、ROS-1(-)。采用石蜡切片行二代基因测序提示:未检测到EGFR敏感突变;肿瘤突变负荷检测结果:2.54个突变/Mb (Low)。患者于2018年1月15日起行颈椎、肋骨、腰椎转移灶放疗(30Gy/10f),2018年1至7月行6周期培美曲塞+顺铂方案化疗及3周期培美曲塞单药维持化疗。2018年8月19日复查CT提示:隆突下淋巴结、左锁骨上淋巴结较前明显增大,多处骨转移灶较前明显。疗效评估为PD。遂于2018年9月12日开始针对隆突下淋巴结放疗(2.4Gy/f,计划照射25次,实际完成10次)。为缓解癌性骨痛及左锁骨上转移淋巴结压迫,患者于2018年9月20日行右半骨盆转移灶放疗(45Gy/15f),于2018年9月26日行左侧锁骨上淋巴结放疗(30Gy/10f)。
患者一线治疗后进展,一般情况良好,ECOG PS评分1分,于2018年9月27日起使用帕博利珠单抗(pembrolizumab)治疗3次(200 mg,每21天1次)。2018年11月26日复查颅脑、颈胸腰椎增强MRI,与旧片对比:1.双侧大脑及左侧小脑半球多发转移瘤,较大者位于右顶叶,较前新增(图1a、b);2.颈胸腰骶椎及部分附件骨质破坏,较前明显增多。颈胸部CT平扫,与旧片对比:1.左肺下叶外基底段小结节影,同前相似;2.左锁骨上及左颈部稍大及增大淋巴结(图1c、d),隆突下淋巴结较前缩小(图1e、f);3.肝内多发低密度结节影,考虑转移(图1g、h)。根据实体瘤免疫治疗疗效评估标准(iRECIST),疗效评估为:疾病进展。因患者临床情况未出现恶化,暂评估为:待证实的疾病进展。

图1 患者在帕博利珠单抗治疗前(左)及3周期治疗后(右)的CT图像
Figure 1. Computed Tomography Images of the Patient before (Left) and after (Right) 3 Cycles of Pembrolizumab Treatment (White Arrows Indicate the Lesions)
a: No intracranial metastasis was detected; b: Intracranial metastasis was detected; c-d: Supraclavicular lymph-node metastasis; e-f: Subcarinal lymph node metastasis; g: No liver metastasis was detected; h: Liver metastasis was detected.
患者二线治疗后进展,一般情况良好,ECOG PS评分1分,于2018年12月4日行 “紫杉醇+卡铂”化疗一周期,于2018年12月13日至27日行头部放疗(30Gy/10f)。此后患者一般情况不断恶化,2019年2月9日因“乏力、意识障碍伴皮肤巩膜黄染”入重症监护室,急诊 CT提示:左肺结节;纵隔内、双颈部(图2a)、锁骨上多个增大淋巴结,多系转移;全身多发骨转移;肝内多发占位,肝左右叶交界区可见范围约12cm×8cm较大占位病变(图2b),肝右叶可见大小约4cm×4cm占位病变(图2c)。患者因全身多器官功能衰竭,于2019年2月14日死亡。该患者使用帕博利珠单抗治疗的PFS为2个月,OS为4.6个月。
患者乙,男性,65岁,主因“右侧胸壁疼痛”首次入院,45年吸烟史。2019年8月全身骨扫描提示:右侧约第8后肋、骶骨代谢增高灶。2019年8月6日我院胸腹部CT:1.左肺下叶肿块;双肺多发结节影,部分多系转移;2.左肺门、纵隔多个增大淋巴结转移;3.右侧第7后肋骨质破坏;4.左侧肾上腺转移。头部增强MRI未见肿瘤转移。左下肺叶占位穿刺活检后病理诊断:左肺腺癌(未行PD-L1检测)。采用石蜡切片行基因检测(ARMS法)提示:未检测到EGFR基因敏感突变;未检测到ALK-EML4融合基因突变、ROS-I融合基因突变。患者于2019年8至9月行2周期培美曲塞+顺铂方案化疗后拒绝继续化疗。2019年11月12日颈胸腹增强CT,与2019年8月14日旧片对比:左肺下叶不规则软组织肿块,较前稍缩小;双肺多发结节影,部分增大,部分新增,转移可能性大;左肺门、纵隔多个增大淋巴结,右侧第7后肋骨质破坏,较前相似;双侧肾上腺肿块,均较前明显增大。
患者一线治疗后病情进展,一般情况良好,ECOG PS评分1分,于2019年11月15日、2019年12月5日予以阿特珠单抗(atezolizumab)治疗2次, 2019年12月25日复查颈胸腹CT提示:左肺下叶不规则软组织肿块,较前稍增大(图3a-b);双肺散在结节影,较前增多、增大;左肺门、纵隔多个小及增大淋巴结,部分较前稍增大(图3c-d);右侧第7后肋骨质破坏伴软组织增厚影,较前明显;双侧肾上腺肿块占位,均较前明显增大(图3e-f);约T3~4椎体棘突及左旁见不均软组织肿块,较前新增,考虑转移。疗效评定为:疾病进展。
患者二线治疗后病情进展,一般情况恶化,ECOG PS评分2分,于2019年12月27日行1周期白蛋白结合型紫杉醇+顺铂化疗后予以对症支持治疗,未行进一步抗肿瘤治疗。2020年2月5日复查CT提示肿瘤较前增大。该患者使用阿特珠单抗治疗的PFS为1.5个月。
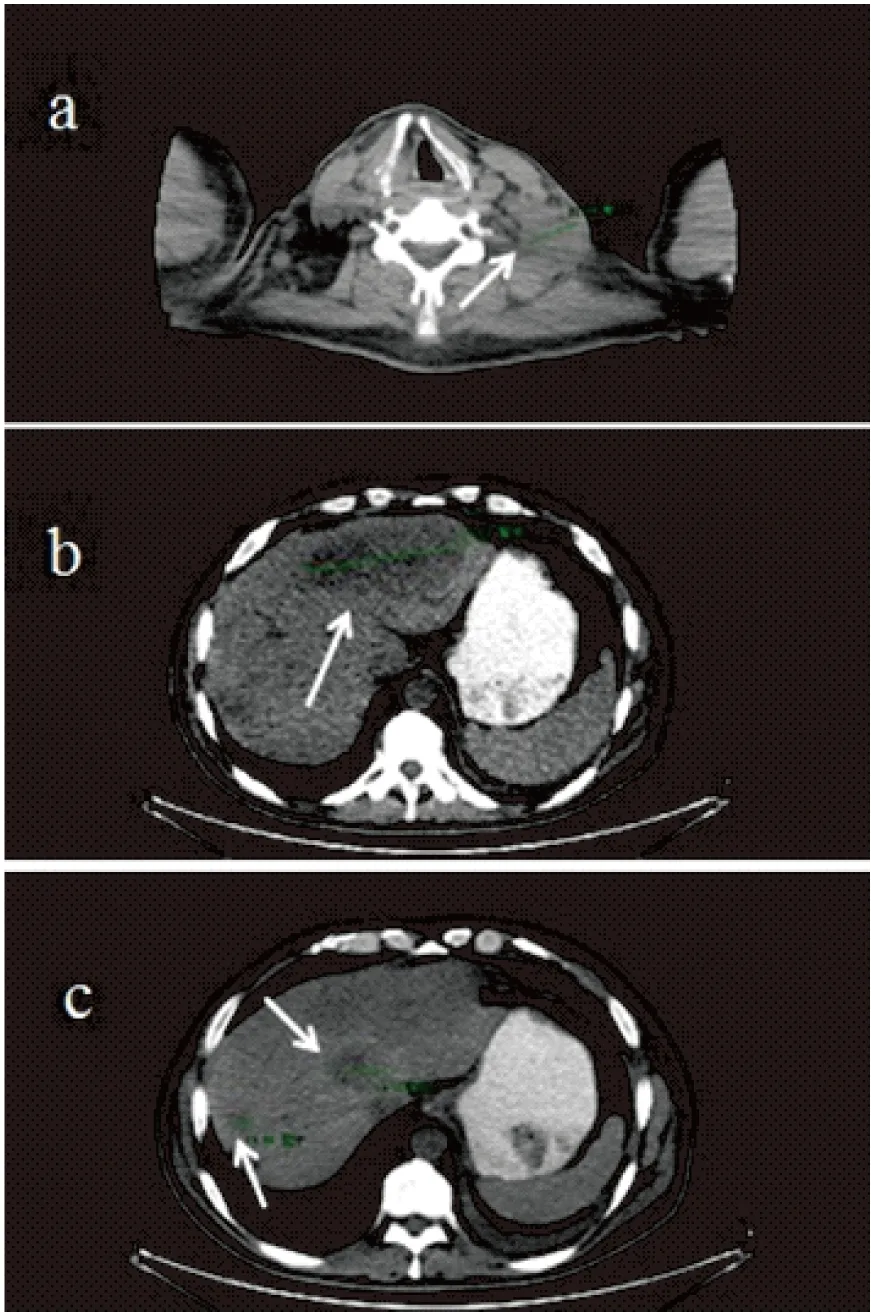
图2 患者在末次使用帕博利珠单抗治疗后2+月的CT图像
Figure 2. Computed Tomography Images of the Patient (over 2 Months after the Last Pembrolizumab Treatment, White Arrows Indicate the Lesions)
a: Supraclavicular lymph-node metastasis; b: A massive tumor in liver; c: Multiple liver metastases.

图3 患者在阿特珠单抗治疗前(左)及2周期治疗后(右)的CT图像
Figure 3. Computed Tomography Images of the Patient before (Left) and after (Right) 2 Cycles of Atezolizumab Treatment (White Arrows Indicate the Lesions)
a-b: Tumor in the left lung; c-d: Subcarinal lymph node metastasis; e-f: Bilateral adrenal metastasis.

本研究中,我们将新发的可测量病灶也纳入评估。患者甲在免疫治疗前3个月和免疫治疗后2.2个月期间的靶病灶长径(淋巴结以短径计算)之和分别增长63%和146%。治疗前肿瘤生长率(tumor growth rate-0, TGR-0)和治疗后肿瘤生长率(tumor growth rate-1,TGR-1)分别为23.3和70.4,TGR-1和TGR-0的比值为3.02,疗效判定为HPD。患者乙在免疫治疗前2.9个月和免疫治疗后1.4个月期间的靶病灶长径(淋巴结以短径计算)之和分别增长12%和38%,TGR-0和TGR-1分别为5.2和34.1,TGR-1和TGR-0的比值为6.26,疗效判定为HPD。
2 讨 论
虽然HPD的概念已经被很多肿瘤医生广泛认同,但是它的定义仍然存在一定的争议。Champtiat等[18]分析131例接受PD-1/PD-L1抑制剂治疗的实体瘤患者的研究中,发现约9%的患者存在肿瘤加速生长的情况,并将免疫治疗后和免疫治疗前的肿瘤生长率比值≥2定义为HPD。这一定义被大多数肿瘤医生所接受。然而,Kato等[19]人则定义HPD至少需要包含3个方面的内容:治疗失败的时间在2个月之内,肿瘤负荷增长大于50%以及肿瘤增长速率大于治疗前的2倍。无论如何,HPD都体现了与治疗前相比,肿瘤加速生长的趋势。但是,这些评估方法大多都是基于RECIST标准,纳入的是基线可测量的靶病灶进行评估,可能会低估了以新发病灶这种形式出现的肿瘤快速进展。因此,正如本文中的患者甲一样,由于免疫治疗前对部分病灶进行了放疗,虽然放疗部位的肿瘤较前缩小(图1e-f),但疾病进展的主要形式为多发的新病灶。采用传统的RECIST标准不能评价为HPD,但采用免疫治疗疗效评估的实体瘤免疫疗效评价标准,将新发的可测量病灶纳入计算则让评估结果更加准确[21-22]。另外,虽然部分研究也证实了有少数患者在免疫检测点抑制剂治疗中存在假性进展[23-24],但是假性进展的患者临床症状稳定,肿瘤增大后再次缩小。而本研究中两例患者在再次评估时均提示肿瘤进一步增大,对免疫治疗后的治疗仍然无效,且患者一般情况不断恶化,也佐证了HPD的疗效评估是恰当的。
近年来,许多研究揭示了与HPD可能相关的一些机制或危险因素。大量基础研究发现抗PD-1/PD-L1单抗耐药及发生HPD的机制可能包括:1)阻断PD-1/PD-L1在功能上激发调节性T细胞,进而产生免疫抑制性肿瘤微环境;2)阻断PD-1/PD-L1代偿性上调其余免疫检查点信号,从而导致T细胞耗竭增加;3)阻断PD-1/PD-L1影响免疫抑制细胞亚群富集,比如影响到M2巨噬细胞、树突状细胞和骨髓源性抑制细胞亚群的比例;4)阻断PD-1/PD-L1触发失控性炎症反应,导致肿瘤细胞免疫逃逸和肿瘤加速生长;5)阻断PD-1/PD-L1后激活某些信号通路,促进肿瘤细胞存活和增殖[25-31]。在临床研究方面,Champiat等[18]的研究认为年龄>65岁与发生HPD存在较强的相关性,但是Kato等[19]的研究则没有观察到这一现象。Ferrara等[32]的研究报道了HPD发生率为13.8%,且多因素分析显示>2个部位转移的患者HPD发生率更高(62.5%vs42.6%,P=0.006)。本研究中,两例患者均有多个部位转移,但Champiat等人的研究却未得出同样结论。Okan Cakir等[33]的研究发现MDM2/4和EGFR基因突变与HPD的发生存在明显的相关性,而本研究中的两例患者,均未证实存在MDM2/4和EGFR基因突变。Adderley等[34]总结了TP53基因和KRAS基因的突变状态,发现TP53和KRAS这两个基因对PD-L1的表达、免疫系统T细胞的浸润、肿瘤免疫原性的增强具有显著影响,预示着PD-1/ PD-L1抗体可能具有较好的疗效。以KEYNOTE189为代表的多项研究均提示PD-L1表达水平大于50%,可能意味着免疫治疗疗效更好[35]。然而,本研究中第一例患者是年仅50岁的中年男性,PD-L1阳性率高达90%,同时具有KRAS基因突变,仍然在免疫治疗后出现HPD。由于目前报导的HPD的患者总量仍然较少,虽然观察到HPD患者的总生存有缩短的趋势,但结果并不完全一致。在前述Champiat等人的研究中,与未发生HPD的患者相比,HPD患者的中位总生存明显缩短(分别为4.6个月和7.6个月,P<0.05)。在Saada-Bouzid等[20]的研究中, HPD患者的中位总生存比未发生HPD的患者更短(分别为6.1个月和8.1个月),但数据差异无统计学意义。因此,考虑到既往关于HPD的回顾性研究的样本量都比较小,这类患者的临床病理特征、发生机制及相关的分子标记物都还需要进一步研究来证实[36]。
在临床实践中,患者可能会接受到抗PD-1/PD-L1抗体单药治疗或者抗PD-1/PD-L1抗体联合不同方案的化疗药物、抗血管生成药物等。由于人体免疫系统是一个非常复杂且精细化的系统,化疗在诱导免疫原性细胞死亡、释放免疫刺激因子、启动抗原递呈和激活免疫应答的同时,也可能导致免疫系统损伤。因此,在接受免疫检测点抑制剂治疗的患者中,合并用药对患者的肿瘤缓解或进展(包括HPD的发生)究竟有着怎样的影响,其机制也需要进一步研究[37]。
3 结 论
综上所述,HPD是近年来在肿瘤治疗中提出的一个新的概念,在大量接受抗PD-1/PD-L1抗体的患者中被广泛报导。由于人体免疫系统是一个非常复杂且精细化的系统,而肿瘤患者间存在个体差异并且治疗中合并用药也可能存在差异,因此研究HPD的危险因素和发生机制非常困难。另外,关于药物与药物之间或者药物与机体之间的相互作用机制,以及如何个体化选择有效率高的联合治疗方案来提高抗肿瘤免疫治疗的疗效并减少HPD的发生率,都需要进一步探索。除此之外,肿瘤医生还需要更多大样本的临床研究来增强对于HPD现象的认识。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
