以KRAS为靶标的抗结肠癌药物筛选系统的构建及应用
2020-06-19何刘军谢永丽岑山周金明
何刘军,谢永丽,岑山,周金明
·论著·
以KRAS为靶标的抗结肠癌药物筛选系统的构建及应用
何刘军,谢永丽,岑山,周金明
100050 北京,中国医学科学院北京协和医学院医药生物技术研究所免疫生物学室(何刘军、谢永丽、岑山、周金明);321004 金华,浙江师范大学生化学院现代制药创新研究中心(谢永丽、周金明)
构建以 KRAS 为靶标的抗结肠癌药物筛选系统,为抗结肠癌药物筛选提供新的技术手段。
首先选取细胞系并确定系统的技术参数,构建以 KRAS 为靶标的抗结肠癌药物筛选系统,设计实验验证筛选系统的有效性;而后将构建的筛选系统初步应用,筛选化合物库 Z183593-L1200,并对筛选结果进行验证,验证筛选系统的可行性。
完成筛选系统构建后,通过筛选系统(in-cell Western blot)测得的 Hce8693 和 T47D 细胞的 KRAS 表达差异与普通 Western blot 一致,筛选系统测定的 siRNA 系统的敲低效率与普通 Western blot 亦一致,筛选系统的有效性得到初步验证。筛选激酶抑制剂化合物库 Z183593-L1200 后,选取活性最好的化合物 PF-04691502 进行验证;浓度梯度实验显示,随着 PF-04691502 浓度升高则 KRAS 胞内含量降低,KRAS 胞内含量对 PF-04691502 浓度呈梯度依赖性;细胞增殖实验结果显示 PF-04691502 对 Hce8693 细胞的半数有效浓度(IC50)为 3.546 μmol/L,进一步验证了系统的可行性。
所构建的以 KRAS 为靶标的抗结肠癌药物筛选系统具有一定有效性和可行性,能够用于以 KRAS 蛋白为药物靶点的药物高通量筛选,为抗结肠癌的药物研发提供了新的筛选方法。
高通量模型; 结肠癌; KRAS; 近红外双色激光成像系统
是一种原癌基因,长约 35 kb,位于12 号染色体,是基因(及)家族成员之一[1]。活化的表皮生长因子受体(EGFR)蛋白通过募集生长因子受体结合蛋白 2(GRB2)结合鸟嘌呤核苷酸交换因子(GEF)促进 KRAS 蛋白的核苷酸交换,使其转化为活性 GTP 结合态。活化的 KRAS 会激活一系列的下游通路,尤其是 RAF/MEK/ERK 和 PI3K/AKT 通路,从而促进细胞分裂增殖和抑制细胞凋亡[2-3]。基因的激活突变可抑制 KRAS 蛋白的 GTPase 酶活性,和野生型 KRAS 蛋白相比降低 GTP 水解活性 3 ~ 9 倍[4],促使 KRAS 蛋白处于 GTP 结合活性构象,导致 KRAS 信号处于持续激活状态,进而引起细胞增殖失控,导致癌变发生[5-6],基因突变在肿瘤中广泛存在,在胰腺导管腺癌、结直肠腺癌、肺腺癌等肿瘤中呈现高表达[7],是重要的癌症驱动基因[8-9];在 30% ~ 40%结直肠癌中发现具有激活基因突变。使用等位基因敲除和敲入野生型或激活突变的结直肠癌细胞系研究表明,这些突变在肿瘤细胞生存和肿瘤进展中发挥重要的作用。突变可增强细胞增殖,抑制细胞凋亡,改变细胞代谢和肿瘤微环境[1, 6]。上述研究表明,降低 KRAS 的胞内含量能达到抑制结肠癌细胞生长和增殖的目的,将降低 KRAS 蛋白的胞内含量作为抗结肠癌药物的研发策略具有可行性。
近红外双色激光成像系统(in-cell Western blot)在细胞内即可完成胞内蛋白含量测定,操作简便,定量线性范围广,且适用于高通量筛选,相较于传统的 Western blot 实验具有突出的优势;本研究旨在以 KRAS 蛋白的胞内含量作为筛选指标,以近红外双色激光成像系统为技术手段建立一个以 KRAS 为靶标的抗结肠癌药物筛选系统,以便能够从数量巨大的化合物实体库中精准高效地获得抗结肠癌的活性化合物。
1 材料与方法
1.1 材料
1.1.1 实验材料 Costar 低荧光 96 孔细胞培养板为美国 Corning 公司产品;鼠源抗 KRAS 抗体为中国台湾Abnova 公司产品;兔源抗 β-Actin 抗体为武汉爱博泰克生物科技有限公司产品;IRDye800 cw 抗鼠荧光二抗和 IRDye800 cw 抗兔荧光二抗为美国LI-COR 公司产品;RPM1640 培养基、0.25% 胰蛋白酶、25 ml 细胞培养瓶、6 孔及 96 孔细胞培养板、Lipofectamine RNAiMAX Reagent 和 1 × PBS 缓冲液均为美国Thermo Fisher Scientific 公司产品;Hce8693 人盲肠腺癌细胞为广州华拓生物科技有限公司产品;T47D 人乳腺导管癌细胞为美国ATCC 产品;RIPA 裂解液(强)和Cell counting kit8(CCK8)为上海碧云天生物技术有限公司产品;si-h-KRAS siRNA 敲低系统为广州博锐生物科技有限公司产品;化合物库 Z183593-L1200 为美国 Selleck Chemicals 公司产品;其他无机试剂均为国产分析纯。
1.1.2 实验仪器 Odyssay 近红外双色激光成像系统为美国 LI-COR 公司产品;平卧式摇床为海门其林贝尔仪器制造有限公司产品;电泳转膜仪为美国Bio-Rad 公司产品;生物洁净工作台为北京泰奇净设备有限公司产品;细胞培养箱为美国Thermo Fisher Scientific 公司产品;干式恒温器为杭州奥盛仪器有限公司产品;EnSpire 2300 多功能酶标仪为美国PerkinElmer 公司产品;自动细胞计数仪为美国Countstar BioTech 公司产品。
1.2 方法
1.2.1 细胞传代培养 将细胞用 1 ml 0.25% 胰蛋白酶消化 2 min,用 4 ml RPM1640 终止消化,首先按 1:5 传至新的 25 ml 培养瓶;而后使用自动细胞计数仪测定细胞浓度,将细胞悬液稀释成2 × 105/ml,混匀后,将细胞悬液加入96 孔板中,200 μl/孔(每孔细胞数 4 × 104个),勿剧烈晃动,与 25 ml 培养瓶一同放置于细胞培养箱中培养,培养条件 37 ℃、5% CO2。
1.2.2 细胞转染 按每孔 100 μl 吸取无血清的 RPM1640 培养基至 1.5 ml 离心管 A,加入RNAiMAX Reagent 5 μl/孔,另取与转染孔数量相等的 1.5 ml 离心管,每孔加入 100 μl 无血清的 RPM1640 培养基,以及 5 μl 的 siRNA,静置5 min,然后将离心管中的混合液按 105 μl/管加入到已加入 siRNA 的离心管中,静置 15 min,然后全部加入至 6 孔板中。
1.2.3 蛋白提取 将培养基吸出,用 1 × PBS 洗一遍,加入 RIPA 裂解液,冰上放置 20 min,加入5 × protein loading buffer,然后干式恒温器,100 ℃加热30 min,然后将样品置于–20 ℃贮存。
1.2.4 Western blot 将样品取出,组装电泳装置,加入蛋白样品,10 μl/孔,进行电泳操作(S1:75 V,45 min;S2:110 V,45 min),电泳完成后进行转膜(75 V,75 min),再用 5% 脱脂牛奶封闭1 h,1 × PBST 洗两次,而后进行一抗孵育(鼠源抗 KRAS 抗体 1:2000 稀释;兔源抗 β-Actin 抗体 1:2000 稀释),4 ℃过夜孵育;1 × PBST 洗4 次,5 min/次;孵育二抗(IRDye800 cw 抗鼠荧光二抗 1:500 稀释;IRDye800 cw 抗兔荧光二抗 1:500 稀释),室温孵育 1 h;1 × PBST 洗 4 次,5 min/次;利用 Odyssay 近红外双色激光成像系统扫描。
1.2.5 In-cell Western blot 将已长满细胞的 Costar 低荧光 96 孔细胞培养板从培养箱中取出,加入 3.7% 的甲醛溶液,100 μl/孔,固定 25 min;而后加入 0.1% 的 Triton-X100 溶液,100 μl/孔,打孔 20 min;加入 0.1% FBS,100 μl/孔,封闭 1 h;用 1 × PBS 洗涤 2 次,5 min/次;孵育一抗(鼠源抗 KRAS 抗体 1:400 稀释;兔源抗 β-Actin 抗体 1:1000 稀释),4 ℃过夜孵育;1 × PBS 洗 4 次,5 min/次;孵育二抗(IRDye800 cw 抗鼠荧光二抗 1:500 稀释;IRDye680 cw 抗兔荧光二抗 1:500 稀释),室温孵育 1 h;1 × PBS 洗 4 次,5 min/次;利用 Odyssay 近红外双色激光成像系统扫描。
1.2.6 IC50的测定及计算 将细胞传代至 96 孔细胞培养板中,4 × 104/孔,24 h 后加入梯度稀释的待测化合物在细胞培养箱中培养 24 h 后,加入 CCK8,10 μl/孔,然后细胞培养箱中放置 2 h,使用 EnSpire 2300 多功能酶标仪在波长 450 nm 处测量吸光度(450),而后将数据导出,进行初步处理。将浓度按照从小到大顺序排列,实验组吸光度除以对照组并换算成百分比;而后在 Graphpad prism 5.0 上作散点图,横轴为化合物浓度,纵轴为实验组450数值与 DMSO 组比值的百分数,而后计算 IC50。
2 结果
2.1 构建以 KRAS 为靶标的抗结肠癌药物筛选系统
2.1.1 确定药物筛选系统的细胞系 基于实验室现有的近红外双色激光成像系统,选取人结肠癌的一个细胞系Hce8693,其基因发生突变,同时在胞内呈高表达,且抑制 Hce8693 细胞胞内的 KRAS 含量能够抑制细胞增殖[10],细胞大小适中,贴壁生长,适用于近红外双色激光成像系统。
2.1.2 制定药物筛选系统的大体流程 将 Hce8693 细胞传代至 Costar 低荧光 96 孔细胞培养板中,培养24 h,然后每孔加入待筛选化合物(1 μmol/L),设置 1 个复孔,培养 24 h;经前处理后,通过近红外双色荧光报告系统检测细胞胞内的KRAS 蛋白含量,而后对实验结果进行验证。
2.2 验证以 KRAS 为靶标的抗结肠癌药物筛选系统的有效性
2.2.1 利用不同细胞系间 KRAS 蛋白表达差异验证筛选系统的有效性 由于目前没有以降低 KRAS 蛋白胞内含量为研发策略的阳性药,为了验证筛选系统的可靠性,我们选取了人乳腺导管癌细胞 T47D 作为对照细胞,其相对低表达 KRAS[7]。首先,普通 Western blot实验(图 1A)及半定量分析(图 1B)证明了 T47D 细胞相较于 Hce8693 细胞显著低表达 KRAS,KRAS 蛋白胞内含量仅为 Hce8693 的 26%;筛选系统(in-cell Western blot)半定量分析结果(图 1C、1D)表明,T47D 胞内的 KRAS 蛋白水平显著低于 Hce8693 细胞,相当于 Hce8693 胞内的 23%。综上所述,筛选系统的结果与普通 Western blot 实验结果基本一致,表明筛选系统能够较为准确地检测 KRAS 在胞内含量的差异,鉴于传统 Western blot 实验的可信度,能够初步验证筛选系统的有效性。
2.2.2 siRNA 敲低系统验证系统有效性 为了验证筛选系统的有效性,我们构建了 KRAS 的 siRNA 系统(si-h-KRAS-1/2/3),首先借助于普通 Western blot 验证 3 种 siRNA 的敲低效率(图 2A),分析结果表明,si-h-KRAS-1 和 si-h-KRAS-3 的敲低效率较高,敲低效率分别为 65% 和 63%(图 2B);而后使用筛选系统检测 si-h-KRAS-1 和 si-h-KRAS-3 的敲低效率(图 2C),定量后的结果显示,si-h-KRAS-1 和 si-h-KRAS-3 的敲低效率分别为 71% 和 58%(图 2D)。综上结果,普通Western blot 结果与筛选系统的验证结果基本一致,筛选系统的有效性得到了进一步验证。
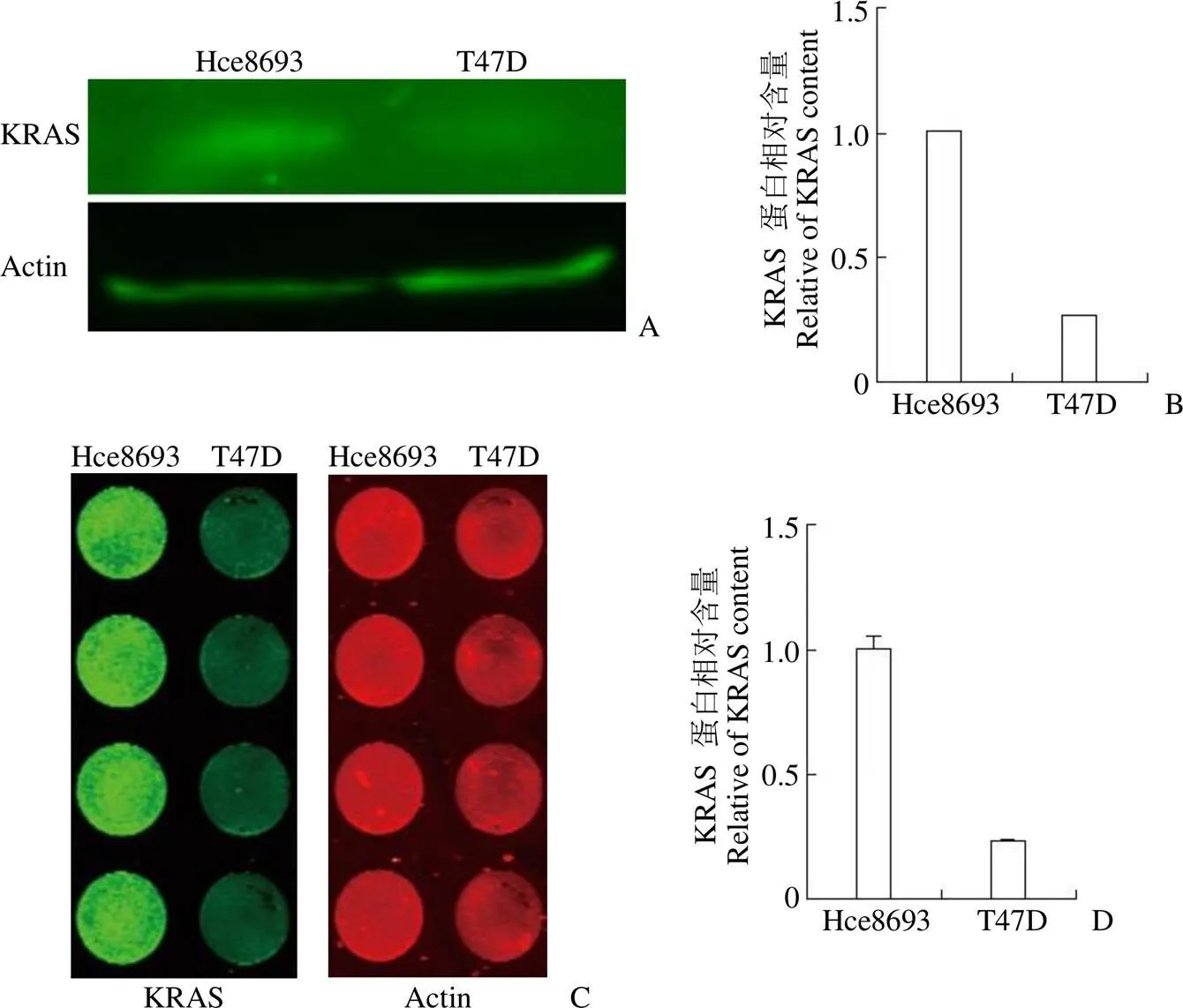
图 1 两株 KRAS 差异表达的细胞验证筛选系统有效性(A:普通 Western blot实验结果;B:普通 Western blot 实验蛋白定量;C:筛选系统实验结果;D:筛选系统蛋白定量)
Figure 1 Verifying the availability of the screening system by two strains of KRAS differentially expressed cells (A: Results of general Western blot experiment; B: Protein quantification of general Western blot experiment; C: Experimental results of screening system; D: Protein quantitative map of screening system)
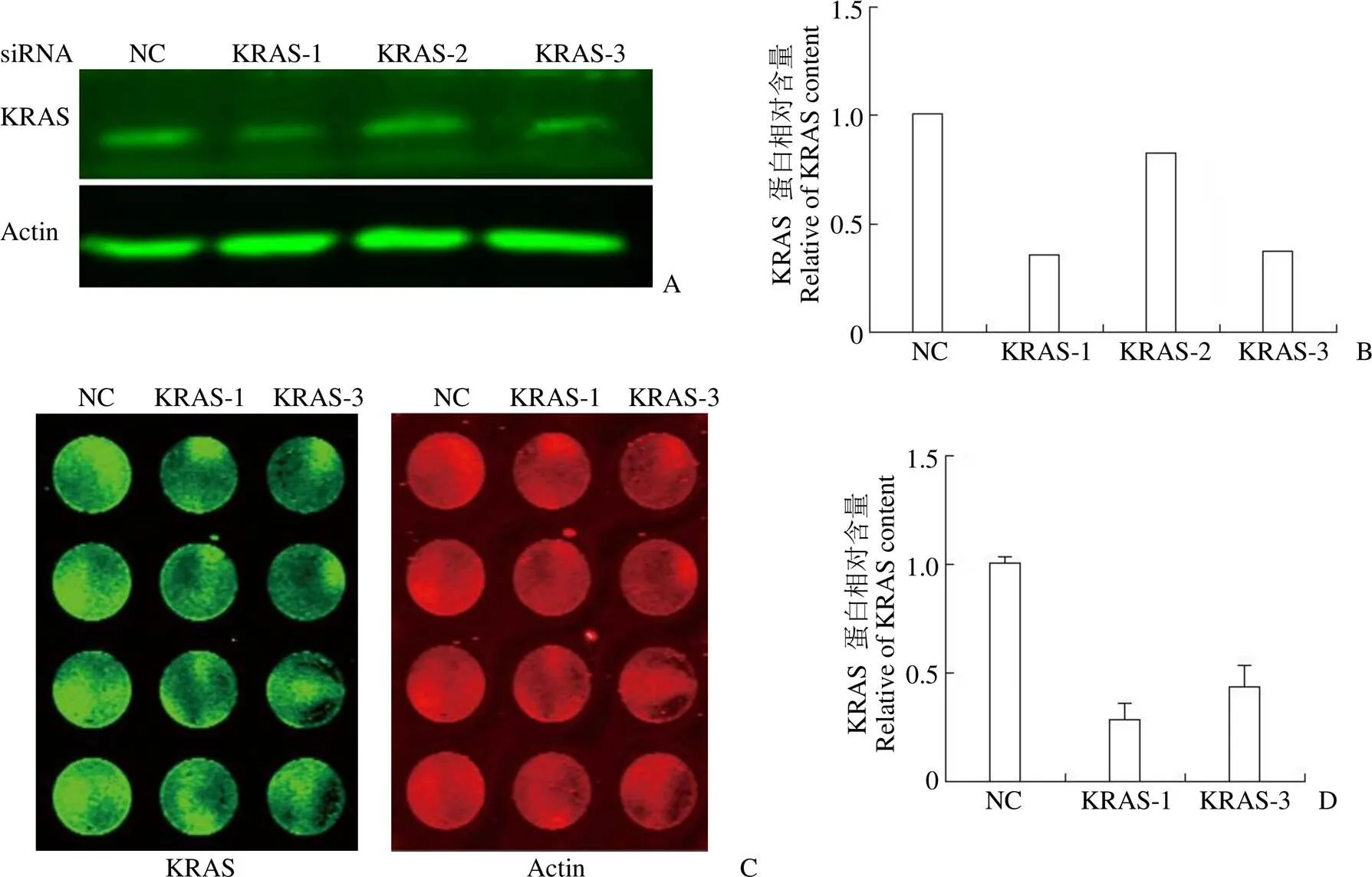
图 2 构建siRNA 敲低系统验证筛选系统的有效性(A:普通Western blot 实验结果;B:普通Western blot 实验蛋白定量;C:筛选系统实验结果;D:筛选系统蛋白定量)
Figure 2 Establishing siRNA system to verify the availability of the screening system (A: General Western blot experimental results chart; B: Ordinary Western blot experimental protein quantification chart; C: Screening system experimental results graph; D: Screening system protein quantification graph)
2.3 筛选化合物库验证以 KRAS 为靶标的抗结肠癌药物筛选系统的可行性
为进一步验证以 KRAS 为靶标的抗结肠癌药物筛选系统的可行性,利用筛选系统对激酶抑制剂化合物库Z183593-L1200 中的 425 个化合物进行高通量筛选(图 3),并选取降低 Hce8693 细胞胞内 KRAS 蛋白含量最为明显的化合物 PF-04691502(KRAS 蛋白胞内含量抑制率 64%)(图 4A)进行活性验证并测定其 IC50。浓度梯度实验结果显示,随着化合物 PF-04691502 浓度的提高,KRAS 的胞内含量不断降低,与 PF-04691502呈浓度依赖关系(图 4B、4C)。虽然在 PF-04691502 浓度为 1 μmol/L 时,对 KRAS 蛋白胞内含量抑制率仅为 43%,和初筛数据不相符,但仍表明PF-04691502 的筛选结果可信度较高;细胞增殖实验结果经 Graphpad prism 5.0 作图并计算而知,化合物 PF-04691502 对细胞 Hce8693 的 IC50为 3.546 μmol/L(图4D)。以上实验结果反映出化合物 PF-04691502 能有效降低 Hce8693 胞内KRAS蛋白含量,并能够抑制细胞的生长和增殖;表明筛选系统可从化合物库中筛选出降低结肠癌细胞内 KRAS 蛋白含量的活性化合物,筛选系统的可行性得到验证。
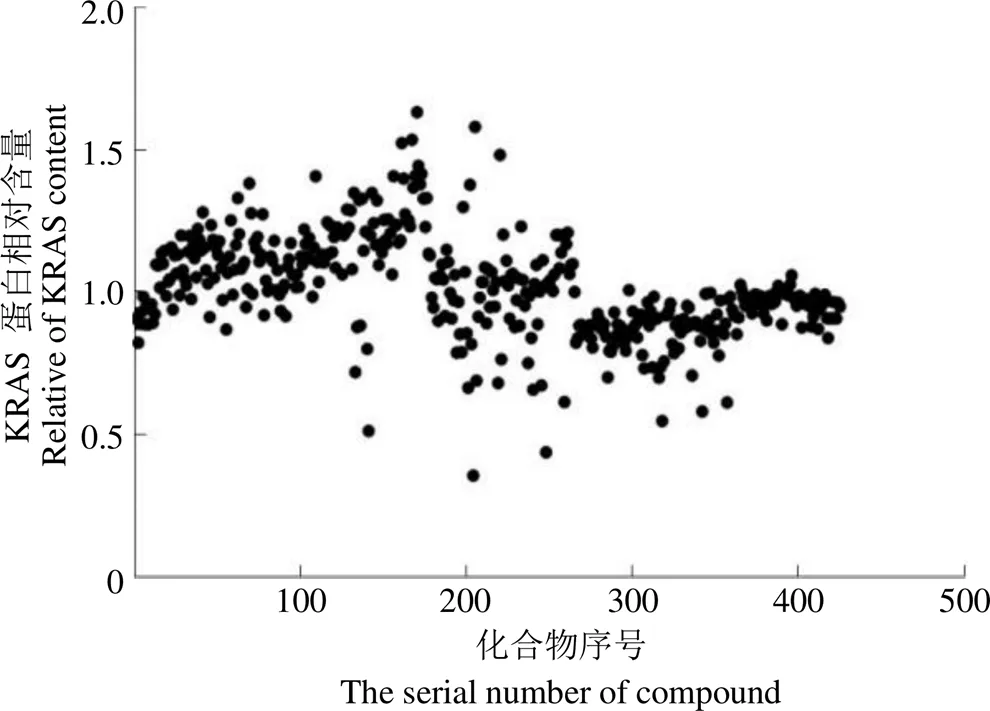
图 3 激酶抑制剂库 LP1200 的筛选结果
Figure 3 Screening results of the kinase inhibitor library LP1200
3 讨论
KRAS 在结肠癌等癌症发生发展过程中是重要的驱动基因,目前以 KRAS 作为药物靶标的研发策略主要包括:①减少 KRAS-GTP 的含量;②阻碍 KRAS-GTP 与下游效应因子的结合;③减少 KRAS-GTP 的膜锚定;④减少 KRAS-GTP 的二聚化和多聚化[11]。相比于上述四种研发策略,降低 KRAS 蛋白胞内含量这种研发策略成本最低,且研究人员进行了多次原理性验证。Singh 等[12]采用shRNA 敲除研究表达 KRAS 蛋白的细胞系,发现这些细胞系分为两类,KRAS 依赖组和 KRAS 非依赖组。KRAS 依赖组细胞系表达 E-cadherin 因子,对敲低 KRAS 蛋白的 shRNA 敏感。同时,多西环素诱导 KRAS 蛋白表达在小鼠实验表明,诱导表达 KRAS 蛋白可以形成肿瘤,而停止诱导表达 KRAS 蛋白会使肿瘤变小并消失[13]。以降低 KRAS 蛋白胞内含量作为研究策略,阿斯利康开发了反义核苷酸 AZD4785。AZD4785 可有效抑制细胞中的 mRNA 和蛋白的表达,可选择性抑制突变介导的下游因子通路以及突变细胞的增殖。小鼠体内实验也证实 AZD4785 可以抑制 KRAS 突变细胞移植肿瘤以及患者来源移植肿瘤中的 KRAS 表达,抑制其肿瘤的生长。同时以小鼠和猴子为评价模型表明 AZD4785 可在一系列的组织中稳定下调目标蛋白 KRAS 的水平,并未表现任何副作用[14]。这些研究结果充分表明降低 KRAS 胞内含量在体内外均具较好的抑癌效果及安全性,更进一步佐证了以降低KRAS 的胞内含量为研发策略的可行性。
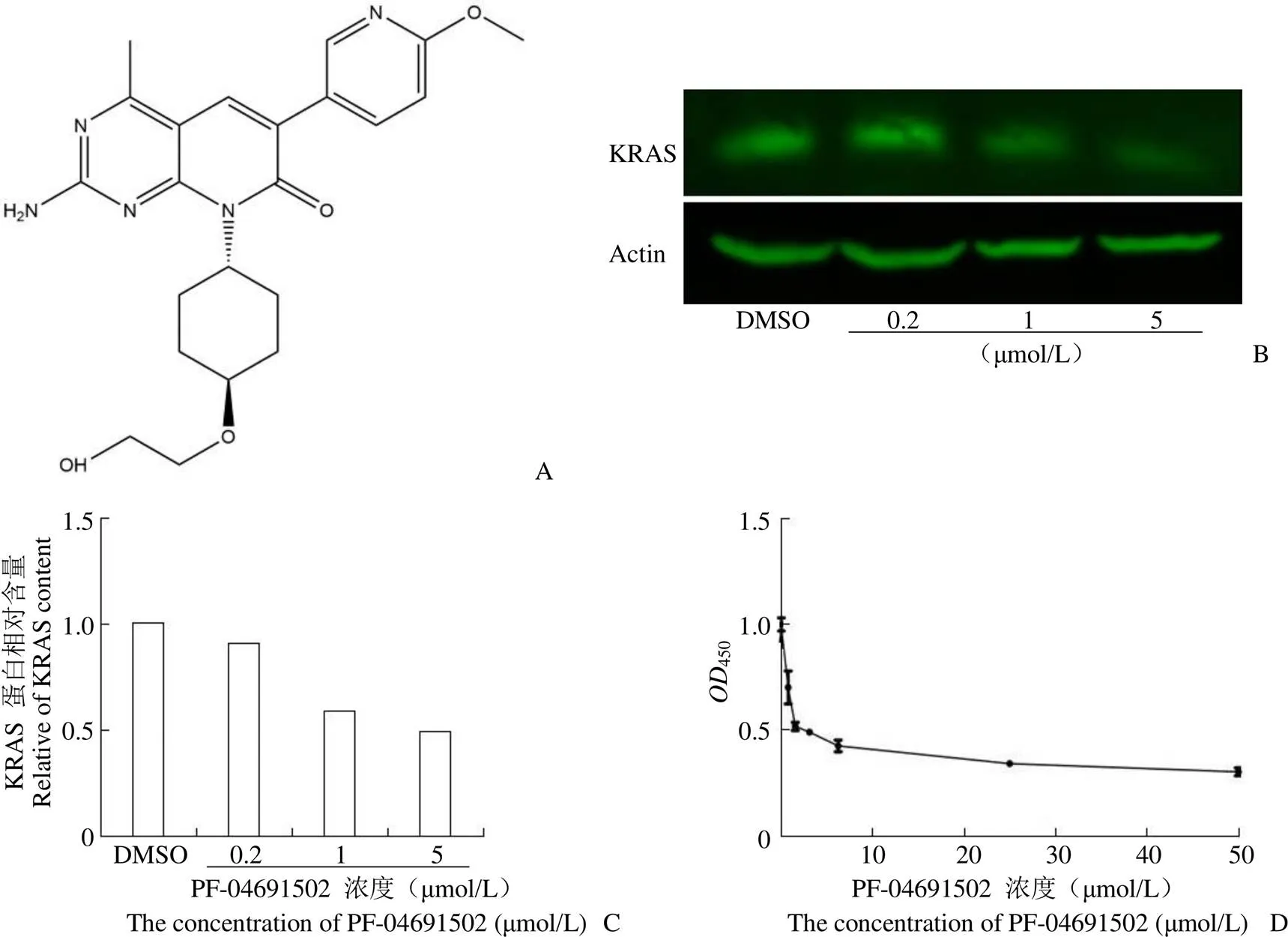
图 4 验证化合物 PF-04691502 对 Hce8693 的抑制活性(A:化合物 PF-04691502 的化学结构;B:普通 Western blot 实验结果;C:普通 Western blot 实验蛋白定量;D:细胞增殖实验结果)
Figure 4 Verifying the inhibitory activity of compound PF-04691502 on Hce8693 (A: Chemical structure of compound PF-04691502; B: Normal Western blot results; C: Normal Western blot experimental protein quantitative map; D: Results ofcell proliferation test)
本研究初步建立以 KRAS 为靶标的抗结肠癌药物筛选系统,通过设置阴性对照细胞和敲低胞内 KRAS 的方法验证系统的有效性;后又筛选了化合物库,并对筛选结果进行了初步验证,结果表明该筛选系统具有一定可行性。综上所述,该系统具有可行、有效、高通量的特征,为结肠癌的药物研究提供了一种新的筛选方法,加快抗结肠癌药物的研发。
[1] Pylayeva-Gupta Y, Grabocka E, Bar-Sagi D, et al. RAS oncogenes: weaving a tumorigenic web. Nat Rev Cancer, 2011, 11(11):761-774.
[2] Downward J. Targeting RAS signalling pathways in cancer therapy. Nat Rev Cancer, 2003, 3(1):11-22.
[3] Buday L, Downward J. Epidermal growth factor regulates p21ras through the formation of a complex of receptor, Grb2 adapter protein, and Sos nucleotide exchange factor. Cell, 1993, 73(3):611-620.
[4] Lowy DR, Willumsen BM. Function and regulation of ras. Annu Rev Biochem, 1993, 62(1):851-891.
[5] Yun J, Rago C, Cheong I, et al. Glucose deprivation contributes to the development of KRAS pathway mutations in tumor cells. Science, 2009, 325(5947):1555-1559.
[6] Arena S, Isella C, Martini M, et al. Knock-in of oncogenic Kras does not transform mouse somatic cells but triggers a transcriptional response that classifies human cancers. Cancer Res, 2007, 67(18):8468-8476.
[7] Cox AD, Fesik SW, Kimmelman AC, et al. Drugging the undruggable RAS: Mission possible? Nat Rev Drug Discov, 2014, 13(11):828-851.
[8] Matallanas D, Romano D, Al-Mulla F, et al. Mutant K-Ras activation of the proapoptotic MST2 pathway is antagonized by wild-type K-Ras. Mol Cell, 2011, 44(6):893-906.
[9] Downward J. Ras signalling and apoptosis. Curr Opin Genet Dev, 1998, 8(1):49-54.
[10] Qian Y, Yu YN, Dong HT, et al. Sequence-specificity of inhibition of HCe8693 cell growth and p21ras expression by c-k-ras antisense oligonucleotides. Chin J Pharmacol Toxicol, 1996, 10(1):45-48. (in Chinese)
钱瑛, 余应年, 董海涛, 等. c-k-ras反义寡核苷酸抑制HCe8693细胞生长及p21ras表达的序列特异性. 中国药理学与毒理学杂志, 1996, 10(1):45-48.
[11] Ostrem JM, Shokat KM. Direct small-molecule inhibitors of KRAS: from structural insights to mechanism-based design. Nat Rev Drug Discov, 2016, 15(15):771-785.
[12] Singh A, Greninger P, Rhodes D, et al. A gene expression signature associated with "K-Ras addiction" reveals regulators of EMT and tumor cell survival. Cancer Cell, 2009, 15(6):489-500.
[13] Fisher GH, Wellen SL, Klimstra D, et al. Induction and apoptotic regression of lung adenocarcinomas by regulation of a K-Ras transgene in the presence and absence of tumor suppressor genes. Genes Dev, 2001, 15(24):3249-3262.
[14] Ross SJ, Revenko AS, Hanson LL, et al. Targeting KRAS-dependent tumors with AZD4785, a high-affinity therapeutic antisense oligonucleotide inhibitor of KRAS. Sci Transl Med, 2017, 9(394): eaal5253.
Construction and application of KRAS-targeted drug screening system against colon cancer
HE Liu-jun, XIE Yong-li, CEN Shan, ZHOU Jin-ming
Department of Immunobiology, Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100050, China (HE Liu-jun, XIE Yong-li, CEN Shan, ZHOU Jin-ming); Modern Pharmaceutical Innovation Research Center, School of Biochemistry, Zhejiang Normal University, Jinhua 321004, China (XIE Yong-li, ZHOU Jin-ming)
To construct a KRAS-targeted drug screening system, providing a new technical means for screening anti-colon cancer drugs.
Firstly, the cell line was selected and the technical conditions of the system were determined. The screening system targeting KRAS was constructed, and the effectiveness of the screening system was evaluated. The screening system was then applied to screen the kinase inhibitor library Z183593-L1200. The screening results are verified to verify the feasibility of the screening system.
After the completion of the screening system, the difference in KRAS expression between Hce8693 and T47D cells measured by the screening system (in-cell Western blot) was consistent with that of the common Western blot. The knockdown efficiency of the siRNA system determined by the screening system was also consistent with that of the common Western blot. The effectiveness of the screening system was initially verified. After screening the compound library Z183593-L1200, the best activity compound PF-04691502 was selected for verification. The concentration gradient experiment showed that the intracellular content of KRAS decreased with the increase of PF-04691502 concentration, and the intracellular content of KRAS showed the concentration of PF-04691502. Gradient-dependent; cell proliferation assay showed that the half effective concentration (IC50) of PF-04691502 on Hce8593 cells was 3.546 μmol/L, further verifying the feasibility of the system.
The KRAS-targeted anti-colon cancer drug screening system has certain validity and feasibility. It can be used for high-throughput screening of drugs with KRAS protein as a drug target, and provides a new drug development for a screening method.
High-throughput model; Colon cancer; KRAS; In-cell Western blot
ZHOU Jin-ming, Email: zhou_jim@hotmail.com; CEN Shan, Email: Shancen@hotmail.com
国家自然科学基金(81672559)
周金明,Email:zhou_jim@hotmail.com;岑山,Email:shancen@hotmail.com
10.3969/j.issn.1673-713X.2020.03.005
2019-10-08
