腺苷酸基琥珀酸活化AMPK抑制肝细胞内脂质蓄积的作用机制
2020-06-19王洋姜允嘉成钟赵晓宏郭鹏蔡大勇谢勇
王洋,姜允嘉,成钟,赵晓宏,郭鹏,蔡大勇,谢勇
·论著·
腺苷酸基琥珀酸活化AMPK抑制肝细胞内脂质蓄积的作用机制
王洋,姜允嘉,成钟,赵晓宏,郭鹏,蔡大勇,谢勇
100193 北京,中国医学科学院北京协和医学院药用植物研究所中草药物质基础与资源利用教育部重点实验室
揭示腺苷酸基琥珀酸(盐)(S-AMP)的生物学新功能。
以 AMP 活化蛋白激酶(AMPK)的天然底物 AMP 为参照,应用表面等离子共振研究 S-AMP 和 AMPK 的相互作用特征。分别构建脂质蓄积和糖蓄积的 HepG2 细胞模型,通过特定浓度的 S-AMP 和对照药物作用后测定 HepG2 细胞内甘油三酯浓度和葡萄糖浓度,研究 S-AMP 和 AMP 降脂和降糖的作用规律。用 Western blot 研究 S-AMP 作用 HepG2 细胞后提高 AMPK 磷酸化水平及其下游糖、脂质代谢通路中关键蛋白质的表达量变化规律,提出 S-AMP 的作用机制。最后利用饮食诱导的糖尿病和高血脂症金黄地鼠模型研究 S-AMP 促进糖脂代谢的药效。
S-AMP 和 AMPK γ 亚基形成复合体后提高 AMPK 磷酸化水平,提高 AMPK 下游的甘油三酯脂肪酶和乙酰辅酶 A 羧化酶的表达量和磷酸化。促进葡萄糖分解的 PFKFB3(6-phosphofructo-2-kinase/fructose-2,6-biphosphatase 3 enzyme)蛋白和转化为糖原的蛋白质糖原合成酶的表达量没有明显变化,S-AMP 显示出的降脂活性高于同等浓度的洛伐他汀。
发现了 S-AMP 降低脂质蓄积的作用机制。
腺苷酸基琥珀酸(盐); AMPK; 脂质蓄积; 作用机制
腺苷酸基琥珀酸(盐)[adenylosuccinic acid (adenylosuccinate),S-AMP]是嘌呤从头合成()通路中合成 AMP 的前体化合物[1]。S-AMP 具有促进胰岛素分泌,使2 型糖尿病患者胰岛 β 细胞恢复正常的功能[2],可能具有治疗糖尿病、高血脂症等代谢综合征的应用前景。迄今为止对 S-AMP 的作用靶标和机制缺乏全面的了解。从分子结构来看,S-AMP 是 AMP 的结构类似物,可能具有活化 AMP 活化蛋白激酶(AMPK)实现提高糖代谢、脂代谢等功能[3]。前期研究中我们利用酶促动力学方法实现了 S-AMP 的小试合成[4],保证了开展 S-AMP 作用机制研究的原料需求。此论文报道 S-AMP 靶向 AMPK 结合改善糖脂代谢的活性和作用机制研究结果,为开展 S-AMP 的成药性研究提供参考。
1 材料与方法
1.1 材料
1.1.1 细胞来源与实验动物 HepG2 细胞来自国家实验细胞资源共享服务平台(中国医学科学院基础医学研究所内),表达人源 AMPK γ1 亚基(NCBI Reference Sequence: NP_002724.1)的质粒 pET-21a-AMPK γ1 亚基[5]由本实验室保存,大肠杆菌表达感受态细胞购自全式金生物技术公司。实验动物金黄地鼠,6 周龄,雌性,空白组、模型组和给药组各 6 只,来自北京维通利华实验动物技术有限公司(合格证号:SCXK Jing 2012-0001),在中国医学科学院药用植物研究所 SPR 动物房内按照实验动物饲养规程饲养和进行药物灌胃。
1.1.2 主要试剂 DMEM 细胞培养基购自美国HyClone 公司;FBS 购自美国 Gibco Life Technologies 公司;用于 Western blot 分析蛋白质表达量的抗原:ATGL、AMPK 亚基、Thr172 磷酸化的AMPK 亚基、ACC(1,2)、Ser221 磷酸化的 ACC1、Ser79 磷酸化的 ACC2、GS、PFKFB3、β-actin 的 I 抗均购自美国 Cell-Signal Technology 公司;山羊 II 抗(抗鼠和抗兔)购自英国 Abcam公司上海分部;油酸、罗格列酮、洛伐他汀等试剂购自德国 Sigma-Aldrich 公司上海分部;S-AMP 按照本课题组已报道方法[3]制备,油红 O 染色试剂盒和葡萄糖浓度测定试剂盒购自上海BioSino 生物技术科学有限公司。
1.1.3 主要仪器 Pioneer 型表面等离子共振仪为美国FortéBio 公司产品;Tecan M1000 多功能连续波长分光光度计为瑞士 Tecan 公司产品;Leica DM4000B 荧光显微镜为德国Leica 公司产品;AU480 型全自动生化仪为美国 Beckman Coulter 公司产品。
1.2 方法
1.2.1 表面等离子共振实验 人源 AMPK γ1 亚基按照已经报道的蛋白质表达和纯化方法制备[5]。室温下利用表面等离子共振(SPR)仪实施 S-AMP 和 AMPK γ1 亚基相互作用分析。挂载蛋白质的 COOH5 芯片安装在指定位置后泵入 NHS/EDC [N-hydroxysuccinimide/1-ethyl-3-(3-dimethylperpyl)-carboiimide]溶液以活化芯片,用 1 mol/L 的乙醇胺封闭芯片后再用 10 mmol/L 醋酸钠缓冲溶液(pH 4.5)稀释 AMPK γ1 亚基至50 μg/ml,溶液用进样装置输送到芯片上,仪器显示 Response Units(RU)数值大于 2000 表明芯片表面成功挂载蛋白质,可以用于分子相互作用分析。用 PBS-T 溶液(pH 7.4,含 10 mmol/L Na2HPO4,1.8 mmol/L KH2PO4,2.7 mmol/L KCl,140 mmol/L NaCl,0.05% Tween 20)平衡化芯片。配制含有 S-AMP 浓度分别为 2.5、5、10、20 μmol/L 的 PBS-T 溶液,每种溶液分别用加样装置输送至芯片表面测定 RU 信号的经时变化量。S-AMP 和 AMPK γ1 亚基相互作用形成复合体的动力学常数a、d和D用表面等离子共振仪器自带程序进行计算。AMP 是 AMPK 的天然底物,为了比较 S-AMP-AMPK γ1 亚基复合体和 AMP-AMPK γ1 亚基复合体的稳定性,AMP 和 AMPK 的相互作用也用同样的方法进行分析。
1.2.2 S-AMP 降低脂质蓄积的体外实验 HepG2 细胞用含有 1% 青霉素-链霉素和 10% FBS 的 DMEM 培养基培养。将细胞置于含有 5% CO2的 37 ℃细胞培养基中,当细胞融合度至约 80% 时,用 0.25% 的胰蛋白酶消化并传代培养。取对数生长期内的健康细胞接种于 96 孔细胞培养皿中,密度约为 1 × 104个/孔,设定 DMEM 培养基培养的 HepG2 细胞作为对照组,含有 100 μmol/L 油酸的 DMEM 培养基培养的 HepG2 作为模型组,含有10 μmol/L 洛伐他汀和 100 μmol/L 油酸的 DMEM培养基培养的 HepG2 为阳性对照,含有 100 μmol/L油酸和 5、10、20 和 40 μmol/L 的 AMP 或 S-AMP 的 DMEM 培养基培养的细胞为给药组,在相同的环境中培养各组细胞 24 h 后去除培养液,用 37 ℃预热过的 PBS 清洗细胞后去除 PBS 溶液,每孔加入 100 μl 的 4% 的多聚甲醛,于 4 ℃固定细胞 30 min 后去除多聚甲醛,PBS 洗涤 3 次后,每孔加入 20 μl 油红 O 溶液,室温下细胞染色15 min 后去除油红 O 溶液,用 PBS 洗涤染色的细胞 3 次;每孔加入 100 μl 的 DMSO,摇动 10 min,用多功能连续波长分光光度计测定358。每种培养条件都开展 3 组平行实验。
为进一步观察 S-AMP 等抑制 HepG2 细胞内脂质蓄积的活性,对10 μmol/L 洛伐他汀、S-AMP、AMP 处理 24 h 的 HepG2 细胞用多聚甲醛固定后,每组细胞添加 100 μl 的 Bodipy 493/50(2 μmol/L)溶液,在 37 ℃避光环境中恒温 15 min 后去除溶液,用 PBS 冲洗每个孔 3 次,用倒置荧光显微镜观察细胞并拍照。
1.2.3 S-AMP 降糖的体外实验 HepG2 细胞按照密度约为1 × 104个/孔接种于 96 孔细胞培养皿中。设定无酚红低糖 DMEM 培养基培养细胞为空白组,含有 5 mmol/L 葡萄糖无酚红低糖 DMEM 培养基培养细胞为模型组,含有 10 μmol/L 罗格列酮和 5 mmol/L 葡萄糖的无酚红低糖 DMEM 培养基培养的细胞作为阳性对照,分别含有 5 mmol/L 葡萄糖和 20、40、50 和 60 μmol/L 的 AMP 或 S-AMP 的无酚红低糖 DMEM 培养基培养细胞为给药组,同样的条件下培养 24 h,将 96 孔板中的培养基移入 0.75 ml EP 管中。使用全自动生化仪,利用葡萄糖氧化酶法,测定其中的葡萄糖含量。每种培养条件都开展 3 组平行实验。
1.2.4 Western blot 分析 根据测定 S-AMP 和 AMP 的药效,用 6 孔培养皿培养 HepG2细胞,对照组、模型组和阳性对照组按照上述条件设定,降脂功能研究给药组 S-AMP 和AMP 的浓度均为 10 μmol/L。降糖功能研究给药组 S-AMP 和 AMP 的浓度均为 20 μmol/L。培养 24 h 后,去除培养基,加入 RIPA 细胞裂解液,冰上提取总蛋白。用 BCA 蛋白质浓度定量试剂盒测定蛋白质浓度后,用 SDS-PAGE 上样缓冲液和各蛋白质样品按比例混合后,于 100 ℃恒温 10 min 让蛋白质变性。Western blot 分析特定蛋白的表达量按照文献[5]所述方法实施,各种抗体的稀释比都为 1:1000。
1.2.5 S-AMP 降脂和降糖活性的体内实验 金黄地鼠饲养按照文献[5]所述流程开展,对高营养饮食诱导的高血糖和高血脂症地鼠按 300 mg/kg 的剂量灌胃给药,以 200 mg/kg 二甲双胍为阳性对照。间隔 24 h 给药 1 次,以正常饲养地鼠为对照组,高脂饲料喂养地鼠为模型组,灌胃给药 18 d 后取地鼠血液用全自动生化仪测定血糖、总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白(HDL-C)以及低密度脂蛋白(LDL-C)的含量。各组地鼠的肝组织用 4% 甲醛固定后,包埋到石蜡中,用组织切片机制成肝组织切片。各个组织切片用油红 O 染色后再用苏木素-伊红复染,在显微镜下观察并拍照。
1.3 统计学处理
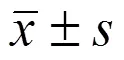
2 结果
2.1 SPR 分析结果
SPR 通过实时定量分析分子间相互作用以确定二者是否形成复合物。挂载于 COOH5 传感器芯片上的蛋白质和其他分子形成复合体,测定复合体形成和解离过程中产生相应的 RU 变化,计算出分子间相互作用的动力学常数,RU 的变化量受溶液中小分子化合物浓度和结合强度影响[6]。S-AMP 和 AMP 的分子结构如图 1A 所示,S-AMP 相当于 AMP 的次黄嘌呤环上的氨基上结合了一个丁二酸基团的衍生物。嘌呤从头合成通路中 S-AMP 被腺苷酸基琥珀酸裂解酶分解成延胡索酸和 AMP[1]。用 SPR 法测定的 AMPK γ1 亚基分别与S-AMP 和 AMP 相互作用的 RU 实时变化如图 1B 所示,由此计算的分子间相互作用的动力学常数如表 1 所示。这些结果证实 S-AMP 可以和AMPK γ1亚基相互作用形成复合体,这个复合体的稳定性低于 AMP-AMPK γ1 复合体。AMPK 分子是由被称为 α、β 和 γ 亚基的 3 条肽链形成的复合体,人源 AMPK 的 γ 亚基存在 γ1、γ2 和 γ3 三种异构体,三种异构体和 AMP 结合部位的结构相同[7],因此 S-AMP 都可能和 AMPK 的 γ 亚基形成复合体。
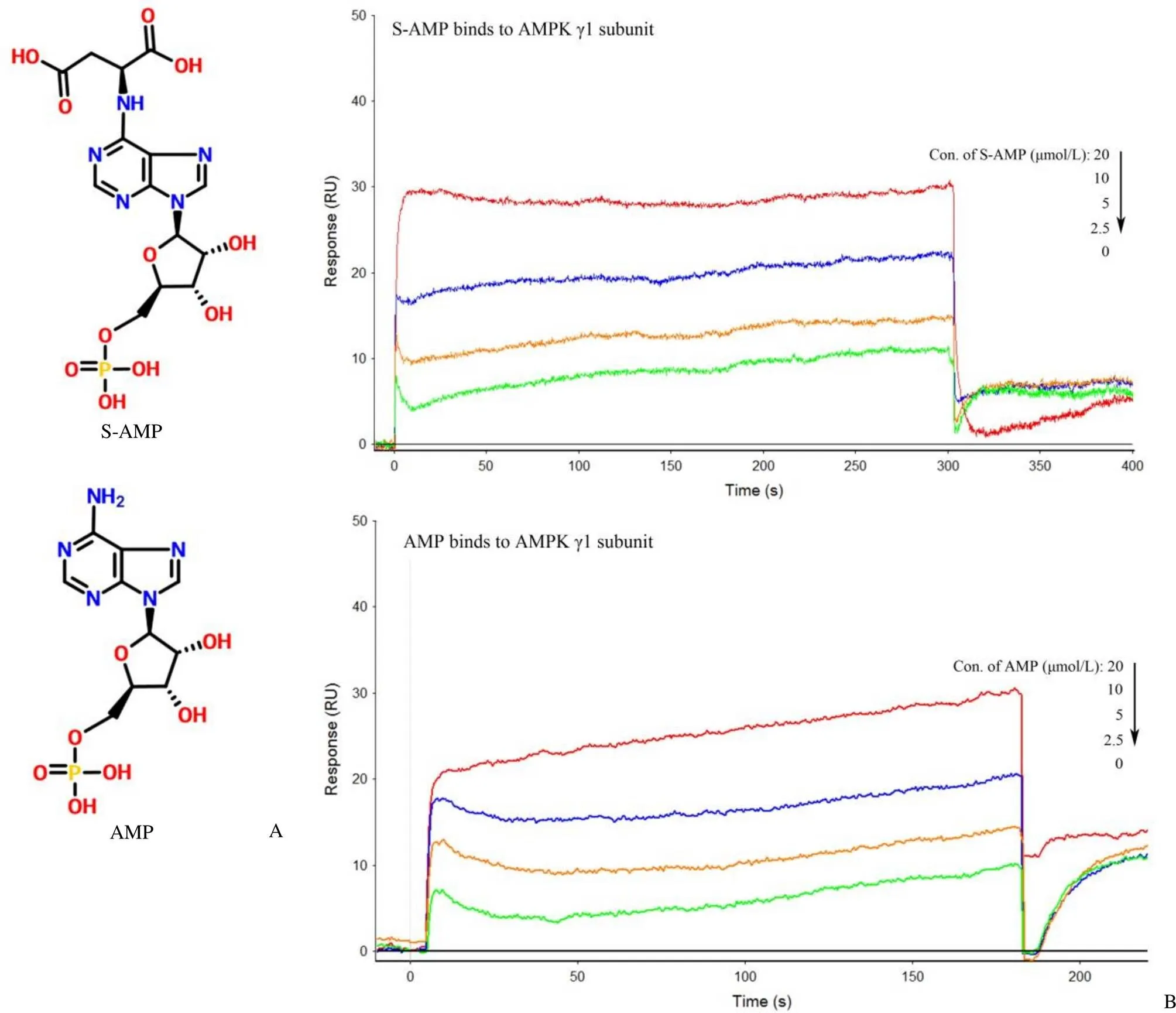
图 1 S-AMP 和 AMP 分别和 AMPK γ1 亚基相互作用结果(A:S-AMP 和 AMP 的分子结构;B:S-AMP 和 AMP 分别和 AMPK γ1 亚基相互作用的表面等离子共振信号图)
Figure 1 Results of S-AMP and AMP interact with AMPK γ1 subunit respectively (A: Structures of S-AMP and AMP; B: SPR signal of S-AMP and AMP interact with AMPK γ1 subunit respectively)
2.2 S-AMP 对油酸处理的 HepG2 细胞的降脂作用
油红O 染色后的 HepG2 细胞用特定体积的 DMSO 萃取,得到的 DMSO 溶液的358大小和细胞内脂质浓度呈正比关系,可以表示细胞内脂质浓度的大小。从测定的结果来看,含有 100 μmol/L油酸的细胞培养基培养 24 h 后 HepG2 细胞存在脂质蓄积,10 μmol/L 的 S-AMP 和 AMP 都显示出比同等浓度的洛伐他汀更强的降脂活性,AMP 的降脂活性在 20 μmol/L 达到最大,而 S-AMP 则显示出较为缓慢的量效关系(图 2A)。
为了探讨 S-AMP 降脂作用的机制,我们用 Western blot 法分析了各个培养环境中HepG2 细胞内 AMPK 磷酸化和下游脂代谢信号通路中蛋白的磷酸化及表达量变化。人体AMPK 的 γ 亚基结合 AMP 或 AMP 的结构类似物后 α 亚基上 Thr172 被磷酸化,Thr172 的磷酸化水平可表征 AMPK 的活性[3, 5]。SPR 分析证明 S-AMP 可以通过靶向结合AMPK 实现活化 AMPK 下游的代谢通路。如图 2B 所示,和模型组比较,洛伐他汀、S-AMP和 AMP 处理的细胞内 AMPKα 亚基上 Thr172 的磷酸化水平显著增加,上调下游脂代谢通路中 ATGL 和 ACC 的表达量。ACC 包含 ACC1 和 ACC2 两个亚型[8],它们的磷酸化水平,尤其是 ACC2 的磷酸化水平显著提高。ACC1 定位于胞质中,催化长链脂肪酸的合成,ACC2 定位于线粒体膜上,催化脂肪酸的氧化。我们观察到的 ACC 磷酸化主要是 ACC2 的磷酸化。ACC 的活性受磷酸化调控,当 ACC2 磷酸化后促进脂肪酸氧化[9-10],这个是促进细胞内脂质代谢的原因之一。此外,ATGL 的表达量显著加速脂肪分解[11],也是促进细胞内脂质代谢的原因。
上述 S-AMP 降脂活性和 Western blot 研究结果以及 SPR 分析的结果显示细胞内 S-AMP 可以直接和 AMPK 形成复合体后导致 α 亚基上 Thr172 磷酸化水平升高,通过上调 ATGL 的表达量促进细胞内的脂肪分解,上调 ACC2 表达和提高其磷酸化水平以促进脂肪酸氧化。细胞内的一部分AMP 是S-AMP 被 ADSL 分解的产物[1],AMP 是 AMPK的天然激动剂,两者形成复合体后也能以 S-AMP相同的作用机制促进脂质代谢。荧光显微镜观察结果显示同样浓度(10 μmol/L)的洛伐他汀、AMP 和 S-AMP 都明显抑制 HepG2 细胞内脂质蓄积,三者之中,S-AMP 抑制 HepG2 细胞内脂质蓄积的活性最高,S-AMP 和 AMP 的活性明显高于洛伐他汀(图 2C)。

表 1 表面等离子共振分析测定的AMPK γ1 亚基和小分子化合物相互作用的动力学常数
2.3 S-AMP 的降糖活性及其作用机制
AMP 和 S-AMP 促进糖代谢的结果如图 3A 所示,相对于阳性对照药罗格列酮,AMP 和 S-AMP 的降糖活性显著低下。培养基中 AMP 的浓度从 20、40、50、60 μmol/L 依次增加时没有观察到药物量效关系,即使培养基中 AMP 的浓度为 60 μmol/L 都不能观察到显著的降糖效果,而 S-AMP 的浓度分别为 20、40、50、60 μmol/L 时,能够观察到药物量效关系,S-AMP 浓度为60 μmol/L 时的降糖效果和 10 μmol/L 罗格列酮的降糖效果相当。
培养基内分别添加 10 μmol/L 罗格列酮、20 μmol/L 的 AMP 和 S-AMP 对 AMPK 磷酸化和 GS、PFKFB3 的表达量的 Western blot 分析结果如图 3B 所示,相对于模型组,对照药罗格列酮能显著提高 AMPK 的磷酸化和 GS 的表达量,但是 PFKFB3 的表达量没有显著提高,因此罗格列酮主要通过促进细胞内糖元合成来降低葡萄糖的含量。在这种培养条件下 AMP 和 S-AMP 都不能提高 AMPKα 亚基上 Thr172 的磷酸化水平,因而下游的 PFKFB3 和 GS 的表达量无明显的上调,证明 AMP 和 S-AMP 都不能通过诱导 GS 的表达量上调促进糖元合成促进葡萄糖代谢。这些结果表明 S-AMP 和 AMP 在现有的细胞培养体系中,不能活化 AMPK-PFKFB3 通路及其 AMPK-GS 通路。高浓度的 S-AMP 显示出比同等浓度 AMP稍高的降糖活性的原因是它能促进胰岛素分泌[2],AMP 没有显示出降糖活性的量效关系,因此可以认为 AMP 没有促进胰岛素分泌的功能。
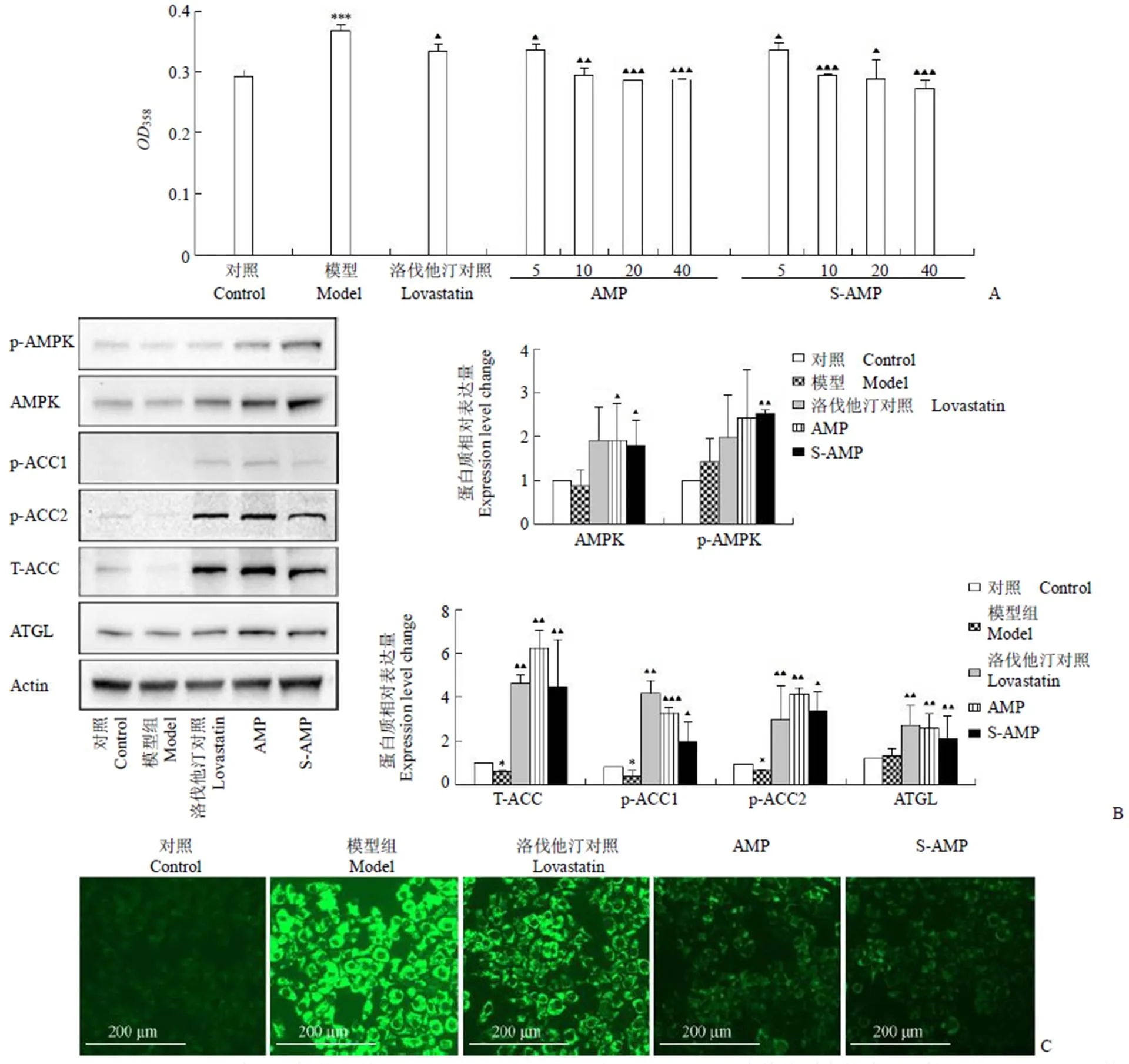
图 2 S-AMP 和 AMP 降脂活性的比较(A:S-AMP 和 AMP 在 HepG2 细胞培养体系中的降脂活性统计,以OD358的数值大小表征脂质浓度;B:Western blot 检测脂代谢途径中部分蛋白的表达。条形图描述了至少三组平行试验数据的平均值;C:荧光显微镜显示的分别用 10 μmol/L 洛伐他汀、S-AMP、AMP 处理 24 h 后细胞内脂质蓄积的结果;与正常组比较*P < 0.05,***P < 0.001;与模型组比较P < 0.05,P < 0.01,P < 0.001)

2.4 S-AMP 改善高营养诱导金黄地鼠的脂质代谢活性
在整个饲养期间,正常饲养的金黄地鼠(对照组)血糖浓度约为 4.8 mmol/L,高营养饲粮饲养的金黄地鼠(模型)血糖浓度为 16 ~ 18 mmol/L。这些结果表明,过量的营养摄入可以诱发金黄地鼠的2 型糖尿病。在使用二甲双胍和 S-AMP 治疗 18 d 后,金黄地鼠的血糖浓度分别变为 5 mmol/L 和11 mmol/L 左右。Tukey's 试验或 Newman-Kueuls 试验结果证明,S-AMP 对血糖无明显降低作用。但二甲双胍可使金黄地鼠血糖恢复到正常水平,说明本研究建立的动物疗效评价模型是成功的(图 4A)。模型组大鼠在高营养饮食 30 d 后血清 TG、TC 明显升高,HDL-C 的浓度无明显变化。300 mg/kg 剂量的 S-AMP 处理 18 d 后,金黄地鼠血液中 TG 浓度明显降低脂质含量,TC、HDL-C 和 LDL-C 的浓度无明显变化(图 4B),肝组织中 S-AMP 能明显减少脂质蓄积(图 4C),这些结果证明 S-AMP 靶向 AMPK 产生可高效促进脂质分解。体内和体外实验显示 S-AMP 的降脂活性明显高于降糖活性。
图 3 S-AMP 和 AMP 降糖活性的比较(A:AMP 或 S-AMP 在 HepG2 细胞培养体系中的降糖活性统计;B:Western blot 检测糖代谢途径中部分蛋白的表达。条形图描述了至少 3 组平行试验数据的平均值。与正常组比较*P < 0.05,**P < 0.01,***P < 0.001;与模型组比较P < 0.05,P < 0.01,P < 0.001)

2.5 S-AMP 促进脂质代谢的作用机制
从观测到 S-AMP 具有促进脂质代谢的量效关系以及 AMP 作为天然 AMPK 激动剂也具有同样作用通路来看,它们都是 S-AMP 促进脂质分解信号通路的组成部分。因为 S-AMP 和 AMP 都是细胞内独立存在的化合物[1-2],腺苷酸基琥珀酸裂解酶(ADSL)将 S-AMP 分解为 AMP 和延胡素酸是通路的一个反应,也是嘌呤代谢通路不可缺少的环节。酶促动力学研究显示人体内 ADSL 的max为(11.9 ± 0.1)μmol/(L·min·mg)(25 ℃)[12],外源 S-AMP 进入到细胞内,ADSL 将 S-AMP 分解为 AMP 不可避免,此部分 AMP 发挥降脂功能。此外,1 mg 总蛋白的细胞提取液中,未用葡萄糖处理的肾脏细胞内 S-AMP 和 AMP 的含量分别为 0.17 和20 nmol/L,葡萄糖处理 2 h 后肾脏细胞内 S-AMP 和 AMP 的含量分别为 0.56 和18 nmol/L[2],细胞内 S-AMP 和 AMP 的浓度变化不仅和外源性补充有关,还受细胞代谢水平控制,目前还没有合适的实验方法能精准测定细胞内外源性 S-AMP 的浓度和被 ADSL 转化为AMP 的比例。综上所述,S-AMP 促进脂质分解的作用机制通路如图 5 所示,外源性 S-AMP 一部分被代谢成 AMP,一部分依然为 S-AMP,两者分别和 AMPK 的 γ 亚基形成复合体提高 α 亚基上 Thr172 磷酸化水平,导致 AMPK 下游的脂肪酸氧化和脂肪分解通路被活化,可以认为 SPR 观测到的 S-AMP 靶向结合 AMPK 是细胞内脂质代谢通路中存在的客观事实。
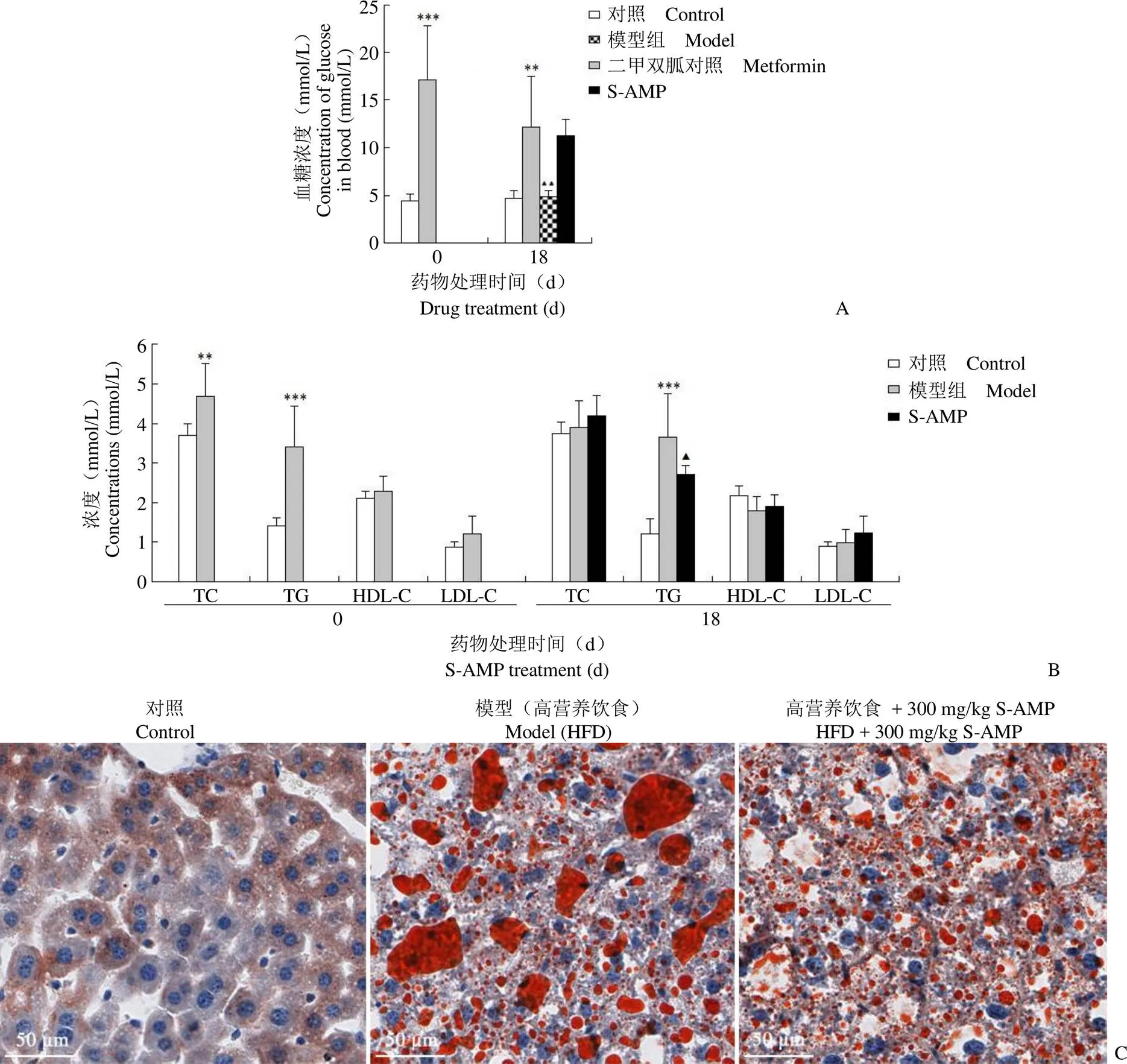
图 4 S-AMP 改善降糖和降脂代谢活性的体内实验结果[A:测定的各组金黄地鼠血糖浓度的统计结果(,mmol/L)。给药前与对照组比较,模型组的空腹血糖明显升高,差异有显著性意义。分组给药 18 d 后,200 mg/kg 的二甲双胍能明显降低地鼠血糖含量,而 300 mg/kg 的 S-AMP 对地鼠血糖无明显作用(与对照组比较,**P < 0.05,***P < 0.001;与模型组比较,P < 0.01);B:给药前和给药 18 d 后各组金黄地鼠血液内 TC、TG、HDL-C 和 LDL-C 浓度的统计结果(,mmol/L),高营养饮食能显著提升小鼠血清内 TC 和 TG 含量;300 mg/kg 剂量给药 18 d 后,S-AMP 能明显降低血清中 TG 含量(与对照组比较,**P < 0.05,***P < 0.001;与模型组比较, P < 0.05);C:各组金黄地鼠肝组织切片用油红 O 染色,苏木素-伊红复染后具有代表性的组织显微镜图像]
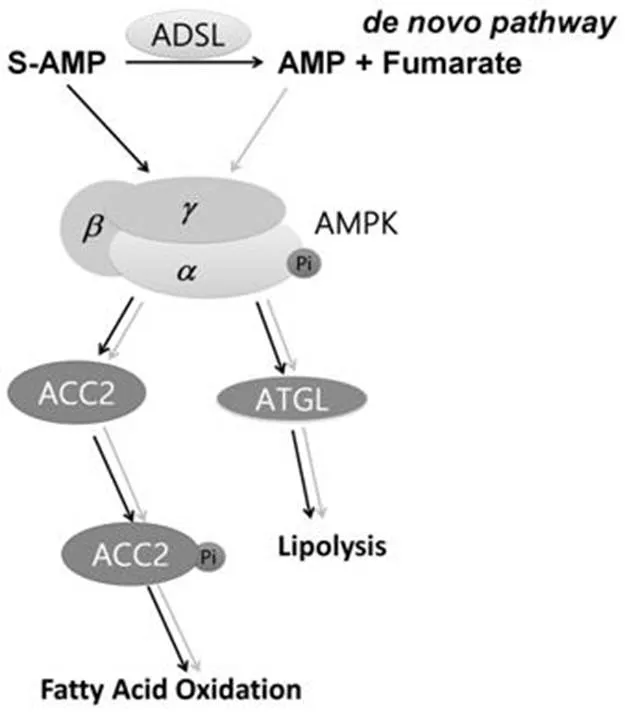
图 5 S-AMP 促进脂质代谢的作用机制(黑色和灰色箭头分别表示 S-AMP 和 AMP 的信号通路)
Figure 5 Lipid metabolism signal pathways induced by S-AMP and AMP are shown using the black and gray arrows respectively
3 讨论
AMP 等嘌呤核苷酸是重要的细胞成分,调节细胞的重要功能,包括细胞代谢、细胞增殖和细胞死亡,以及 DNA 和 RNA 的合成[13]。人体内嘌呤合成的主要场所是肝脏,嘌呤的生物合成主要涉及两个分离的途径,即从头合成途径和回收途径,通过嘌呤核苷酸的合成和降解来维持各个组分的平衡。嘌呤代谢功能障碍在免疫学、血液学和神经肌肉疾病方面与多种疾病相关[14-16],这些疾病与细胞中嘌呤核苷酸和体液中碱基的异常水平有关。嘌呤和嘧啶代谢的先天缺陷在十多种不同的疾病中都有表现。我们发现,补充 S-AMP 和 AMP 能降低高血脂症金黄地鼠的血脂和抑制肝脏内脂肪蓄积,意味着肝细胞内 S-AMP 和 AMP 低下可能是导致脂肪代谢紊乱的原因,S-AMP 和 AMP 有望作为治疗高血脂症、非酒精性脂肪肝等脂质代谢紊乱疾病的药物开展研究。
此外,尽管 S-AMP 对高糖培养基培养的 HepG2 细胞,不能活化 AMPK 以促进糖分解或糖原合成,依然有降糖活性,其原因应该是 S-AMP 提高了胰岛素分泌[2]。体内实验观察到 S-AMP 无明显的降糖活性,原因可能是 S-AMP 的剂量不足以使金黄地鼠的胰岛素分泌量达到促进糖代谢的要求,也可能是高饮食诱导金黄地鼠产生的胰岛素抵抗导致的,需要开展进一步研究才能阐明其科学本质。
[1] Bubić A, Mrnjavac N, Stuparević I, et al. In the quest for new targets for pathogen eradication: the adenylosuccinate synthetase from the bacterium Helicobacter pylori. J Enzyme Inhib Med Chem, 2018, 33(1):1405-1414.
[2] Gooding JR, Jensen MV, Dai X, et al. Adenylosuccinate is an insulin secretagogue derived from glucose-induced purine metabolism. Cell Rep, 2015, 13(1):157-167.
[3] Garcia D, Shaw RJ. AMPK: mechanisms of cellular energy sensing and restoration of metabolic balance. Mol Cell, 2017, 66(6):789-800.
[4] Wang N, Jiang YJ, Wang Y, et al. Large-scale synthesis of adenylosuccinate using a high thermal stability adenylosuccinate synthetase as a bio-catalys. Chin Med Biotechnol, 2019, 14(2):108- 114. (in Chinese)
王楠, 姜允嘉, 王洋, 等. 以高热稳定性的腺苷酸基琥珀酸合成酶为催化剂大量合成腺苷酸基琥珀酸(盐). 中国医药生物技术, 2019, 14(2):108-114.
[5] Wu C, Guo Y, Su Y, et al. Cordycepin activates AMP-activated protein kinase (AMPK) via interaction with the γ1 subunit. J Cell Mol Med, 2014, 18(2):293-304.
[6] Löfås S. Biacore systems: leading the revolution in label-free interaction analysis. Biointerphases, 2008, 3(3):FD2-FD3.
[7] Corton JM, Gillespie JG, Hawley SA, et al. 5-aminoimidazole-4- carboxamide ribonucleoside. A specific method for activating AMP-activated protein kinase in intact cells? Eur J Biochem, 1995, 229(2):558-565.
[8] Brownsey RW, Boone AN, Elliott JE, et al. Regulation of acetyl-CoA carboxylase. Biochem Soc Trans, 2006, 34(Pt 2):223-227.
[9] Karami KJ, Coppola J, Krishnamurthy K, et al. Effect of food deprivation and hormones of glucose homeostasis on the acetyl CoA carboxylase activity in mouse brain: a potential role of acc in the regulation of energy balance. Nutr Metab (Lond), 2006, 3:15.
[10] Bianco AC, Maia AL, da Silva WS, et al. Adaptive activation of thyroid hormone and energy expenditure. Biosci Rep, 2005, 25(3-4): 191-208.
[11] Cerk IK, Wechselberger L, Oberer M. Adipose triglyceride lipase regulation: an overview. Curr Protein Pept Sci, 2018, 19(2):221-233.
[12] Ariyananda Lde Z, Lee P, Antonopoulos C, et al. Biochemical and biophysical analysis of five disease-associated human adenylosuccinate lyase mutants. Biochemistry, 2009, 48(23):5291-5302.
[13] Pedley AM, Benkovic SJ. A new view into the regulation of purine metabolism: the purinosome. Trends Biochem Sci, 2017, 42(2):141-154.
[14] Yin J, Ren W, Huang X, et al. Potential mechanisms connecting purine metabolism and cancer therapy. Front Immunol, 2018, 9:1697.
[15] Nyhan WL. Disorders of purine and pyrimidine metabolism. Mol Genet Metab, 2005, 86(1-2):25-33.
[16] Edwards NL, Fox IH. Disorders associated with purine and pyrimidine metabolism. Spec Top Endocrinol Metab, 1984, 6:95-140.
Adenylosuccinate, a metabolite in purine salvage pathway, binds to AMP-activated protein kinase (AMPK) γ subunit and enhances the metabolic efficiency of lipid
WANG Yang, JIANG Yun-jia, CHENG Zhong, ZHAO Xiao-hong, GUO Peng, CAI Da-yong, XIE Yong
Department of Medicinal Plant Development, Chinese Academy of Medical Sciences & Peking Union Medical College, Key Laboratory of Bioactive Substances and Resources Utilization of Chinese Herbal Medicine, Ministry of Education, Beijing 100193, China
To discovery of novel biological functions of adenosylsuccinate (adenosylsuccinatic acid; referred to as S-AMP).
Surface plasmonic resonance (SPR) was used to explore the direct interaction between S-AMP and AMP activated protein kinase (AMPK) by using the natural substrate AMP of AMP-activated protein kinase (AMPK) as the reference. HepG2 cell models of lipid and glucose accumulation were constructed respectively to evaluate the concentration of triglyceride and glucose in HepG2 cells after the addition of S-AMP at different concentrations, the lipid-lowering and glucose-lowering effects of S-AMP were studied. Western blot was used to study the phosphorylation of AMPK and the expression of downstream signaling pathways of glucose and lipid metabolism by the addition of S-AMP to HepG2 cells, and the mechanism of S-AMP on the attenuation of lipid metabolism was proposed. Finally, the effect of S-AMP was verified in mice with diet-induced diabetes and hyperlipidemia.
It was confirmed for the first time that the formation of complex of S-AMP and AMPK increased the phosphorylation level of AMPK, enhanced the expression of ATGL and ACC2 in the fatty acid synthesis downstream of AMPK pathway, and simultaneously increased the phosphorylation of ACC2. It also increased the intracellular decomposition of triglyceride to generate fatty acids and decreased the lipid accumulation in cells. In addition, theandexperiments showed that S-AMP had no significant hypoglycemic activity.
The mechanism of S-AMP reducing lipid accumulation was confirmed.
Adenylosuccinic acid (Adenylosuccinate); AMPK; Lipid accumulation; Mechanism
XIE Yong, Email: yxie@implad.ac.cn
国家自然科学基金(81473114)
谢勇,Email:yxie@implad.ac.cn
10.3969/j.issn.1673-713X.2020.03.004
2020-04-03
