建立共载米铂与核酸miR-34a阳离子脂质体中miR-34a的含量测定方法
2020-06-19孟月王丹王雪蕾郭晓茹夏桂民
孟月,王丹,王雪蕾,郭晓茹,夏桂民
·论著·
建立共载米铂与核酸miR-34a阳离子脂质体中miR-34a的含量测定方法
孟月,王丹,王雪蕾,郭晓茹,夏桂民
100050 北京,中国医学科学院北京协和医学院医药生物技术研究所制剂室
建立共载米铂与核酸 miR-34a 阳离子脂质体中 miR-34a 的含量测定方法,分析检测 miR-34a 的包封率。
选用 RiboGreen-荧光分光光度法分析测定共载脂质体中 miR-34a 的含量,并对建立的方法进行方法学研究与验证。
建立的 RiboGreen-荧光分光光度法,最佳激发和发射波长分别为 485 和 535 nm;miR-34a 在 0.5 ~ 100.0 nmol/L范围内线性关系良好(= 6538+ 687.1,= 0.9998);低、中、高 3 种浓度的平均回收率分别为98.23%(RSD = 1.88%,n = 3)、99.40%(RSD = 1.51%,n = 3)和99.03%(RSD = 1.28%,n = 3);日内精密度 RSD = 1.80%(n = 6),日间精密度 RSD = 0.99%(n = 6)。制备的连续 3 批共载脂质体中 miR-34a 的浓度分别为 4.99、5.01 和 4.92 μmol/L,包封率分别为 99.0%、99.1% 和 99.1%。
本文建立的方法简便易行、重复性好、准确度高,可用于共载脂质体中 miR-34a 的含量和包封率分析测定。
RiboGreen-荧光分光光度法; 含量测定; miR-34a; 阳离子脂质体
肿瘤的发生、发展和复发与基因密切相关,抗肿瘤核酸药物可通过调节相关基因的表达实现抗肿瘤效果。核酸药物因易被核酸酶降解而不稳定,将其制备成阳离子纳米脂质体是解决此类问题的有效途径之一。铂类药物具有广谱抗肿瘤作用,miR-34a 也具有广泛的抗肿瘤活性,两者的作用靶点不同,联合给药可以多靶点抑制肿瘤细胞的生长,利于控制或消除肿瘤的发展和(或)复发等。本课题组构建了共载米铂与核酸 miR-34a 的阳离子脂质体,以期实现较好的抗肿瘤效果。
目前,核酸药物的定量检测方法主要有紫外分光光度法、凝胶电泳法和荧光分光光度法。利用核酸分子在 260 nm 处具有最大吸收峰,可采用紫外分光光度法进行定量分析[1],该法操作简便,是实验室常用的核酸定量方法。但该法灵敏度低,且易受到被检样品中其他杂质的干扰,准确度低,常常不适用于纳米制剂中核酸药物的定量检测[2]。利用核酸分子与荧光染料结合后能够产生较强荧光信号的特性,可以采用凝胶电泳法和荧光分光光度法进行含量测定。荧光染料的选择是这两种方法的关键。常见的核酸染料有 EB、GelRed、SYBRGreen I 和RiboGreen 等[3-8]。
本研究尝试建立 RiboGreen-荧光分光光度法和琼脂糖凝胶电泳法检测共载米铂和miR-34a 的阳离子脂质体(MCL/miR-34a)中miR-34a 的含量,进而分析检测 miR-34a 的包封率。经过方法学研究与验证,认为RiboGreen-荧光分光光度法更适合 MCL/miR-34a 中miR-34a 的分析检测。
1 材料与方法
1.1 材料
RF-6000 荧光分光光度计购自日本岛津公司;Victor X5 多功能酶标仪购自美国PerkinElmer 公司;OSB-2100 旋转蒸发仪购自日本 Eyela 东京理化器械株式会社;KQ-250DB 数控超声波清洗器购自昆山市超声仪器有限公司;共载米铂和 miR-34a 阳离子脂质体自制,批号 20191101、20191102、20191103;miR-34a购自苏州吉玛基因股份有限公司,批号 380008;米铂原料药(纯度99.6%)购自昆明贵研药业有限公司,批号 M20171214;1,2-二油酰氧基丙基-N,N,N-三甲基溴化铵(DOTAP)、二油酰磷脂酰乙醇胺(DOPE)和胆固醇(Chol)购自上海艾韦特医药科技有限公司;Triton X-100购自索莱宝生物科技有限公司;十二烷基硫酸钠(SDS)购自国药集团化学试剂有限公司;Quant-iTTMRiboGreen®RNA Assay Kit 购自美国 Thermo Fisher 公司;其他试剂均为分析纯。
1.2 方法
1.2.1 miR-34a 标准溶液制备 精密量取 1 ml 焦碳酸二乙酯(DEPC)水,置于含20 nmol miR-34a 的EP 管中,充分混匀,即得 20 μmol/L miR-34a 标准溶液。
1.2.2 共载米铂和 miR-34a 阳离子脂质体制备 采用薄膜分散法制备米铂阳离子脂质体(miriplatin cationic liposomes,MCL):精密称取处方量的米铂及磷脂,溶于氯仿,再将其减压旋蒸得均匀薄膜后,加入 5% 葡萄糖溶液(经 DEPC 除酶处理:加 1‰的DEPC,37 ℃振摇过夜,高压蒸汽灭菌)水化、超声,得MCL;采用共孵育法制备共载米铂和 miR-34a 阳离子脂质体:将处方量的miR-34a 与 MCL 等体积混合,室温孵育 20 min,即得 MCL/miR-34a。
1.2.3 供试品溶液及空白对照溶液制备 吸取 40 μl MCL/miR-34a,置于 2 ml 量瓶中,向其中加入 8.0 μl 10% Triton X-100(v/v),超声 5 min,用 1 × TE 缓冲液(10 mmol/L Tris-HCl 和 1 mmol/L EDTA)定容至刻度,充分振荡、摇匀,即得供试品溶液。另吸取 20 μl MCL,加 20 μl 经 DEPC 除酶处理的 5% 葡萄糖溶液,同法操作,得空白对照溶液。
1.2.4 RiboGreen 荧光染料配制 将 Quant-iTTMRiboGreen®RNA Reagent 用 1 × TE 稀释200 倍,即得。
1.2.5 最佳激发波长和发射波长的确定 吸取 20 μmol/L miR-34a 标准溶液 10 μl,用 1 × TE稀释 200 倍,然后将其与 RiboGreen 荧光染料等体积混合并摇匀,得具有荧光活性的 RiboGreen-miR-34a 复合物溶液。固定发射波长,通过改变激发波长,得到激发波长(λex)和荧光强度()的关系曲线,即激发光谱;固定激发波长,通过改变发射波长,得到发射波长(λem)和荧光强度()的关系曲线,即发射光谱,最终确定最佳激发波长和发射波长。
1.2.6 破乳剂的选择 为准确测定制剂中 miR-34a的浓度,需向制剂中加入适宜的破乳剂,以确保 miR-34a 从制剂中完全释放的同时,不干扰 miR-34a 的含量测定。为此,本研究对破乳剂的类型及浓度进行筛选:选用两种表面活性剂 Triton X-100(非离子型)和 SDS(阴离子型),按制剂/表面活性剂的体积比为 5:1,分别向制剂中加入不同浓度的 Triton X-100 和 SDS,照“1.2.3”项下方法处理样品,得样品溶液,将其与 RiboGreen 荧光染料等体积混合,进行荧光强度测定,测定结果与 miR-34a标准溶液荧光强度对比,同时考察 miR-34a 的释放。
1.2.7 线性与范围 吸取适量 20 μmol/L miR-34a标准溶液,用 1 × TE 稀释制备成 200 nmol/L miR-34a 标准溶液,再将其按梯度稀释成 100、50、20、10、5、1 nmol/L 的一系列 miR-34a 标准溶液。测定时,将系列浓度的 miR-34a 标准溶液与 RiboGreen 荧光染料等体积混合(得浓度分别为 100.0、50.0、25.0、10.0、5.0、2.5、0.5 nmol/L 的一系列溶液),在特定的激发和发射波长下分别测其荧光强度,并测定空白溶液的荧光强度,前者减去后者即为 RiboGreen-miR-34a复合物的荧光强度,以 miR-34a 浓度()为横坐标,荧光强度()为纵坐标,进行线性回归。
1.2.8 精密度实验 取同一 MCL/miR-34a,照“1.2.3”项下方法操作,得供试品溶液,将其与 RiboGreen 荧光染料等体积混合,分别于日内及日间(6 日)测定 MCL/miR-34a 中 miR-34a 的含量,并计算精密度。
1.2.9 回收率实验 取 MCL 20 μl,分别加入低、中、高 3 个浓度的 miR-34a 标准溶液20 μl,得低、中、高 3 个浓度的 MCL/miR-34a,照“1.2.3”项下方法操作,得供试品溶液,将其与 RiboGreen 荧光染料等体积混合,进行荧光强度测定,计算 miR-34a 浓度,将 miR-34a 浓度的实测值与理论值相比,即得回收率,每个浓度平行测 3 次。
1.2.10 含量及包封率测定 取 MCL/miR-34a,照“1.2.3”项下方法操作,得供试品溶液,将其与 RiboGreen 荧光染料等体积混合,进行荧光强度测定,采用外标一点法,计算 miR-34a 的浓度,即为 MCL/miR-34a 中 miR-34a 的总浓度(total);当 RiboGreen 荧光染料加入溶液中后,游离的 miR-34a 会与其结合,形成具有荧光活性的复合物 RiboGreen-miR-34a。而 MCL 固缩包载的 miR-34a不会与 RiboGreen 荧光染料结合,不产生荧光活性。吸取 40 μl MCL/miR-34a,用 1 × TE 稀释50 倍,将其与 RiboGreen 荧光染料等体积混合,进行荧光强度测定,采用外标一点法,计算游离 miR-34a浓度(free)。
按以下公式计算包封率:
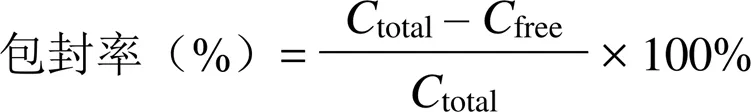
2 结果
2.1 最佳激发波长和发射波长的确定
RiboGreen-miR-34a复合物的激发光谱和发射光谱如图 1 所示,最佳激发波长和发射波长分别为 485 nm 和 535 nm。
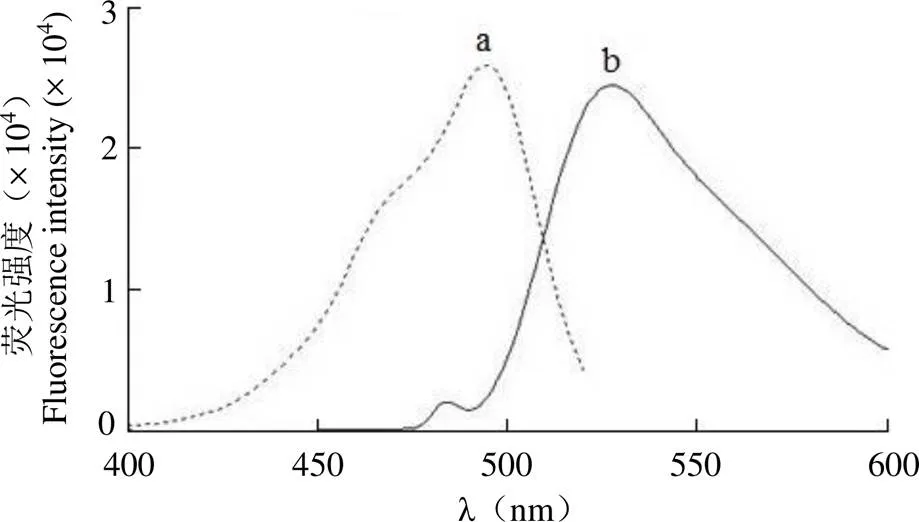
图 1 RiboGreen-miR-34a 的激发光谱(a)和发射光谱(b)
Figure 1 Excitation (a) and emission (b) spectra of RiboGreen-miR-34a
2.2 破乳剂的选择
破乳剂及其浓度的改变对荧光强度和 miR-34a释放的影响如图 2 所示。随着 Triton X-100浓度的增加,荧光强度逐渐增加,miR-34a 释放量逐渐增加,当 Triton X-100浓度为10%(v/v)时,miR-34a 可从制剂中完全释放(图 2A);随着 SDS 浓度的增加,荧光强度先增加后减小,当 SDS 浓度为 5%(m/v)时,miR-34a 释放量达最大,仅为 70%,miR-34a释放不完全(图 2B)。因此,在该法中选用 10% Triton X-100 作为破乳剂。
2.3 线性与范围
分别测定 100.0、50.0、25.0、10.0、5.0、2.5、0.5 nmol/L RiboGreen-miR-34a 复合物溶液的荧光强度(表 1),以 miR-34a 浓度()为横坐标,荧光强度()为纵坐标,进行线性回归,得回归方程:= 6538+ 687.1(= 0.9998)。结果表明,在 0.5 ~ 100.0 nmol/L范围内 miR-34a 浓度与荧光强度呈良好的线性关系。
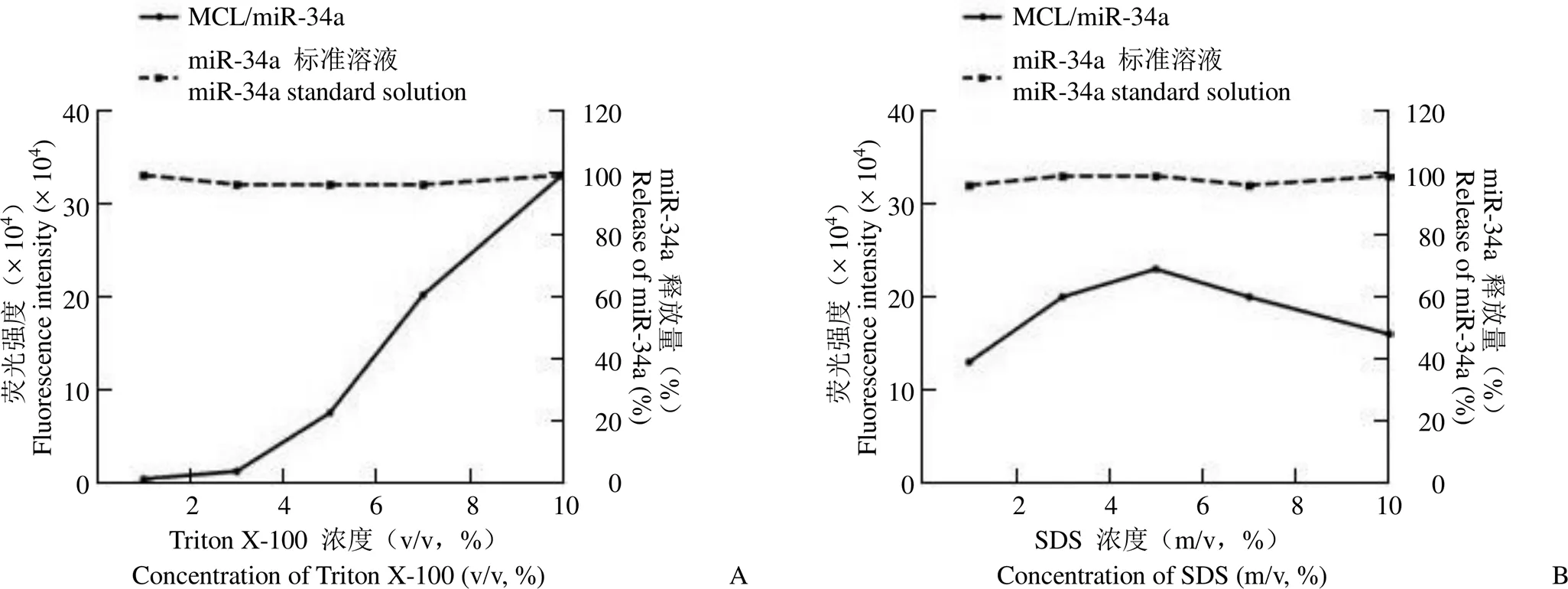
图 2 miR-34a 释放实验(A:Triton X-100 浓度与 miR-34a荧光强度及释放量曲线;B:SDS 浓度与 miR-34a 荧光强度及释放量曲线)
Figure 2 The release test of miR-34a in MCL/miR-34a (A: Curve of concentration of Triton X-100 and fluorescence intensity/release of miR-34a; B: Curve of concentration of SDS and fluorescence intensity/release of miR-34a)

表 1 miR-34a 浓度与荧光强度(n = 3)
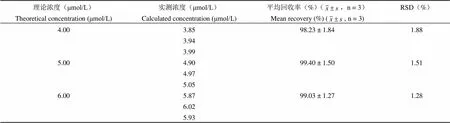
表 2 回收率结果
2.4 精密度实验
照“1.2.8”项下操作,同一天内连续 6 次测定 RiboGreen-miR-34a 复合物溶液的荧光强度,计算得 miR-34a 平均浓度为 4.96 μmol/L,日内精密度 RSD 为 1.80%(n = 6);连续 6 d,每天同法处理并平行测定 6 次,计算得 miR-34a 平均浓度为 4.94 μmol/L,日间精密度 RSD 为 0.99%(n = 6)。
2.5 回收率实验
低、中、高 3 种浓度的平均回收率分别为98.23%(RSD = 1.88%,n = 3)、99.40%(RSD = 1.51%,n = 3)、99.03%(RSD = 1.28 %,n = 3)(表 2)。
2.6 miR-34a 的含量及包封率测定
采用 RiboGreen-荧光分光光度法测定3 个批次共载脂质体 MCL/miR-34a 中 miR-34a的含量及包封率。分别测定 MCL/miR-34a 中 miR-34a 的总浓度(total)和游离 miR-34a 浓度(free),计算包封率,统计结果如表 3 所示。
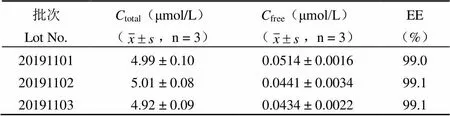
表 3 共载脂质体 MCL/miR-34a 中 miR-34a 的含量和包封率
3 讨论
琼脂糖凝胶电泳法也是核酸药物含量测定的常用方法,操作简便,但检测灵敏度受荧光染料影响较大,且灵敏度较低。在开展RiboGreen-荧光分光光度法研究的同时也考察了琼脂糖凝胶电泳法分析检测共载脂质体中 miR-34a 的含量。
在琼脂糖凝胶电泳法分析检测 miR-34a 的研究中,选择了常用的 GelRed 染料,检测不同浓度 miR-34a 标准溶液的凝胶成像,结果显示,该法的最低检测限为 100nmol/L,灵敏度显著低于 RiboGreen-荧光分光光度法(最低检测限为0.5 nmol/L)。应用此法检测MCL/miR-34a 中 miR-34a 的包封率时,MCL/miR-34a 组未见游离 miR-34a 条带,原因可能有两种:①游离 miR-34a 浓度低于检测限;②miR-34a 全部被 MCL 固缩包载,无游离 miR-34a,前者可能性更大。所以认为:琼脂糖凝胶电泳法无法灵敏地测定微量的游离核酸,不能满足 MCL/miR-34a 中 miR-34a 的包封率测定。
本文建立的 RiboGreen-荧光分光光度法操作简便、专属性强、准确度高及重复性好。通过方法学研究与验证,认为本法适合共载脂质体MCL/miR-34a 中 miR-34a 的含量及包封率的测定。
[1] Yao DB, Chi DF, Yu J, et al. An improved method for extraction of nucleic acid from coleopteran insects. J Northeast Forestry Univ, 2009, 37(01):86-88. (in Chinese)
姚大彬, 迟德富, 宇佳, 等. 一种改良的鞘翅目昆虫核酸的提取方法. 东北林业大学学报, 2009, 37(01):86-88.
[2] Tsanev R. Fractionation of RNA in agar-gel electrophoresis studied by direct ultraviolet spectrophotometry. Biokhimiia, 1965, 30(1):124- 127.
[3] Sharma S, Mazumdar S, Italiya KS, et al. Cholesterol and morpholine grafted cationic amphiphilic copolymers for miRNA-34a delivery. Mol Pharm, 2018, 15(6):2391-2402.
[4] Lou J, Diao BW, Li W, et al. Comparative analysis of three types of nucleic acid staining for PFGE. Dis Surveill, 2011, 26(5):388-391. (in Chinese)
娄静, 刁保卫, 李伟, 等. 三种核酸染料应用于细菌脉冲场凝胶电泳染色的比较研究. 疾病监测, 2011, 26(5):388-391.
[5] Ye JS, Zhang N, Ma CH, et al. SYBR Green I-fluorometry determination of content and entrapment efficiency of protamine- pDNA complex loaded solid lipid nanoparticles. Chin J Pharm Anal, 2007, 27(11):1769-1772. (in Chinese)
叶杰胜, 张娜, 马春红, 等. SYBR Green I-荧光法测定载鱼精蛋白缩合基因纳米粒中pDNA的含量和包封率. 药物分析杂志, 2007, 27(11):1769-1772.
[6] Jones LJ, Yue ST, Cheung CY, et al. RNA quantitation by fluorescence-based solution assay: ribogreen reagent characterization.Anal Biochem, 1998, 265(2):368-374.
[7] Zang X, Ding H, Zhao X, et al. Anti-EphA10 antibody-conjugated pH-sensitive liposomes for specific intracellular delivery of siRNA. Int J Nanomedicine, 2016, 11:3951-3967.
[8] Shen Y, Tu JS, Pang H, et al. Electrophoresis and fluorospectrophotometry methods to determine the content and entrapment efficiency of siRNA in cationic liposomes. Acta Pharm Sinica, 2009, 44(4):430-435. (in Chinese)
沈雁, 涂家生, 庞卉, 等. 凝胶电泳法及荧光光度法测定siRNA阳离子脂质体的含量和包封率. 药学学报, 2009, 44(4):430-435.
Establishment of a method for determination of miR-34a in codelivery miriplatin and miR-34a cationic liposomes
MENG Yue, WANG Dan, WANG Xue-lei, GUO Xiao-ru, XIA Gui-min
Pharmaceutics Department, Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100050, China
To establish a method for determining miR-34a content of codelivery miriplatin and miR-34a cationic liposomes (MCL/miR-34a).
RiboGreen-fluorescence spectrophotometry was used for content determination as RiboGreen can combine with miR-34a to form a complex with strong fluorescent activity.
The optimal excitation and emission wavelengths of RiboGreen-miR-34a were 485 and 535 nm, respectively. RiboGreen-fluorescence spectrophotometry had a good linear correlation in a range at 0.5 - 100.0 nmol/Land the regression equation was= 6538+ 687.1,= 0.9998; the recovery at the low, middle and high concentrations were 98.23% (RSD = 1.88%, n = 3), 99.40% (RSD = 1.51%, n = 3) and 99.03% (RSD = 1.28%, n = 3), respectively. The inter-day and intra-day precision was reflected by RSD values of 1.80% (n = 6) and RSD = 0.99% (n = 6), respectively. The concentration of miR-34a in 3 batches of MCL/miR-34a measured by this method were 4.99, 5.01 and 4.92 μmol/L, and the encapsulation rate were 99.0%, 99.1% and 99.1%, respectively.
A convenient, sensitive and accurate method has been established for determination of the miR-34a content and the entrapment efficiency of MCL/miR-34a.
RiboGreen-fluorescence spectrophotometry; Determination; miR-34a; Cationic liposomes
XIA Gui-min, Email: xiaguimin@126.com
国家重点研发计划(2016YFA0201504);国家自然科学基金(81673383、81603063、81803479)
夏桂民,Email:xiaguimin@126.com
10.3969/j.issn.1673-713X.2020.03.003
2019-12-21
