等离子体活性水对生鲜黄鱼杀菌效果及品质的影响
2020-06-19仲安琪王露丹赵穗润严文静章建浩
钱 婧,仲安琪,王露丹,赵穗润,严文静,章建浩
(南京农业大学食品科技学院,江苏南京 210095)
黄鱼由于蛋白质含量高、肉质鲜嫩以及营养价值高等特点,其需求量日益增加,现已成为我国主要的海水养殖鱼类[1]。但由于黄鱼的肌肉组织疏松且蛋白含量高,易受到致腐致病微生物的污染而发生腐败变质[2-3]。目前,冻藏保鲜技术是防止鱼肉腐败变质常用的方法[4-5],然而该技术只能抑制微生物的生长,一旦鱼体在室温下解冻后,鱼体本身的微生物将继续繁殖生长,破坏鱼肉品质。因此,在鱼体冻藏保鲜前进行简单高效的初步杀菌显得尤为重要,可降低后续的冷藏条件,减弱冻藏对鱼肉品质的影响。

本研究利用等离子体射流发生装置制备等离子体活性水,将鱼肉中常见的肠道病原微生物肠炎沙门氏菌作为菌体模型[14],评估等离子体活性水的抗菌活性及抗菌时效,同时测定活性水中长效杀菌物质的含量。将制得的等离子体活性水用于生鲜黄鱼的初步杀菌,以生鲜黄鱼片(2.5 cm×5 cm,10 g)为研究对象。通过浸泡接种法(肠炎沙门氏菌),确保鱼体表面初始微生物数量的一致性,进而探讨等离子体活性水对生鲜黄鱼片的杀菌效果,从色泽、pH、脂质氧化、亚硝酸盐残留、肌肉持水力及气味多方面地揭示等离子体活性水对鱼肉品质的影响,为等离子体活性水对黄鱼初步杀菌的应用提供理论基础。
1 材料与方法
1.1 材料与仪器
生鲜大黄鱼 南京苏果超市;肠炎沙门氏菌(SalmonellaenteritidisCICC24119) 中国工业微生物菌种保藏管理中心;LB肉汤、SS琼脂(SalmonellaShigellaagar) 青岛海博生物技术有限公司;Amplex® UltraRed试剂盒 赛默飞世尔科技公司;其他试剂均为国产分析纯 南京寿德生物科技有限公司。
PG-1000ZD低温等离子体喷枪 南京苏曼等离子科技有限公司;Allegra-64R台式冷冻离心机 美国贝克曼公司;SJ-CJ-1D超净工作台 苏州净化设备有限公司;SMIC型电热灭菌锅 上海医用仪器厂;恒温培养摇床 上海一恒科学仪器有限公司;UV-2006 UV-Vis分光光度计 日本岛津公司;数显式pH测试仪 梅特勒-托利多仪器有限公司;IKA T25组织分散机 德国艾卡仪器设备有限公司;SpectraMax M2e多功能酶标仪 美国分子仪器公司。
1.2 实验方法
1.2.1 等离子体活性水的制备及性能测定
1.2.1.1 等离子体活性水的制备 图1为制备等离子体活性水所用的等离子体射流发生装置示意图。该装置以空气为工作气体,流速为22.5 L/min,工作电流为0.024 mA,电压为19 kV,频率为20 kHz。本实验将等离子体射流装置的喷枪口位置固定于液面下方15 mm,待处理去离子水体积为1000 mL,处理一定时间(1、2、3 min)后,立即置于密闭容器中,在室温(25 ℃)条件下储藏,每隔4 h测定其理化性质(亚硝酸根、硝酸根、过氧化氢、pH)的变化情况。不同等离子体处理时间制得的等离子体活性水分别记为:PAW-1、PAW-2和PAW-3。

图1 等离子体射流发生装置示意图Fig.1 Schematic diagram of plasma jet generator set-up
1.2.1.2 菌体悬浊液的制备 将肠炎沙门氏菌置于100 mL的LB肉汤中,37 ℃、180 r/min条件下培养15 h。取对数期的菌液离心(10000×g,6 min),去上清,用无菌生理盐水清洗菌斑3次,再重悬于生理盐水中。利用分光光度计测量600 nm波长下菌体悬浮液的吸光度值(OD),调整菌体悬浊液的浓度至108CFU/mL(相应的OD值为0.2)。
1.2.1.3 等离子体活性水抗菌时效的测定 将制备好的等离子体活性水(PAW-1,PAW-2,PAW-3)室温下储藏24 h,每隔4 h测定其对肠炎沙门氏菌的抗菌效果。等离子体活性水与菌体悬浊液(108CFU/mL)按1∶1体积比进行混合,反应15 min后立即进行菌落数的测定,将去离子水处理作为对照组。对混合液进行10倍梯度稀释,选择3个适宜的稀释度,分别吸取100 μL稀释液于SS琼脂平板上(每组3个),涂布均匀,置于37 ℃培养箱中培养24 h,以lg CFU/mL进行平板计数。
1.2.1.4 等离子体活性水中长效杀菌物质的测定 亚硝酸根及硝酸根含量按照国标 GB 5009.33-2016《食品安全国家标准 食品中亚硝酸盐与硝酸盐的测定》进行测定。根据Amplex® UltraRed试剂盒的说明书测定等离子体活性水(PAW-1,PAW-2,PAW-3)中过氧化氢的含量。在每100 μL的PAW中加入100 μL 10 mmol/L的试剂盒储备液(含有辣根过氧化物酶),在37 ℃条件下反应15 min,利用酶标仪检测其荧光强度(激发波长为540 nm,发射波长为590 nm)。
1.2.1.5 等离子体活性水pH的测定 pH计校正后,将电极分别浸没在PAW-1,PAW-2及PAW-3溶液中,待读数稳定后记录数据。
1.2.2 等离子体活性水对生鲜黄鱼品质的影响
1.2.2.1 样品的制备及接种处理 采用无菌剪刀及手术刀在超净台内制备黄鱼生鱼片(2.5 cm×5 cm,10 g),将生鱼片放在紫外灯下照射以除去鱼原本的菌体(鱼片每面用紫外灯照射各40 min)。紫外灭菌后将生鱼片浸没于肠炎沙门氏菌溶液(106CFU/mL)中30 s,取出,在超净台中室温静置4 h,使菌体附着于鱼肉。
1.2.2.2 等离子体活性水处理 随机抽取染菌生鱼片(每组3片,每片10 g),浸没于不同的等离子体活性水(PAW-1,PAW-2,PAW-3)中30 s,取出,放置于无菌密封袋中后立即测定生鲜黄鱼片上肠炎沙门氏菌的数量。随机抽取未染菌生鱼片(每组3片,每片10 g),浸没于不同的等离子体活性水(PAW-1,PAW-2,PAW-3)中30 s,取出,测定鱼片在色泽、pH、TBARS、亚硝酸盐、持水力、气味以及味感上的变化情况。以去离子水浸泡处理为对照组,每个处理组重复3次。
1.2.2.3 肠炎沙门氏菌的测定 向装有待测样品的无菌袋中加入110 mL无菌生理盐水,均质器以6次/s拍打2 min,10倍梯度稀释,选择3个适宜的稀释度,分别吸取100 μL稀释液于SS琼脂平板上(每组3个),涂布均匀,置于37 ℃培养箱中培养24 h,以log CFU/g进行平板计数。
1.2.2.4 色泽的测定 利用以标准白板(L*=95.35,a*=0.01,b*=2.30)校正的色差仪对样品的颜色特征进行评价。将色差仪垂直于样品表面进行测量,每个样品测量5个点,取其平均值。颜色值表示为L*(+亮度,-黑暗)、a*(+红色,-绿色)和b*(+黄色,-蓝色)[15]。
1.2.2.5 pH的测定 按照国标GB 5009.237-2016《食品安全国家标准 食品pH的测定》进行测定。
1.2.2.6 TBARS的测定 按照国标GB 5009.181-2016《食品安全国家标准食品中丙二醛的测定》进行测定。
1.2.2.7 亚硝酸盐含量的测定 按照国标 GB 5009.33-2016《食品安全国家标准 食品中亚硝酸盐与硝酸盐的测定》进行测定。
1.2.2.8 肌肉持水力的测定 将处理后的生鲜黄鱼片剪碎(15±1 g,质量记为m1/g),分别置于50 mL离心管中,在20000 r/min、4 ℃条件下离心15 min后,记录鱼肉质量(m2/g)[16]。持水力计算公式如下:
式中:WHC表示鱼体肌肉的持水力,%;m1表示离心前黄鱼的总质量,g;m2表示离心后黄鱼的总质量,g。
1.2.2.9 电子鼻的测定 将处理后的生鲜黄鱼片剪碎(10±1) g,分别放入20 mL顶空瓶中。顶空瓶在37 ℃下水浴30 min,以达到稳定的顶空成分。在每次测量之前,传感器室都要用空气进行净化,以便重新建立仪器的基线。顶空气体以400 mL/min的速度泵入腔内。传感器的采集时间为120 s,可以使传感器响应信号达到稳定值。应用主成分分析法(PCA)对数据库进行分析,以区分不同的处理方法[17]。
1.2.2.10 电子舌的测定 将处理后的生鲜黄鱼片剪碎,每小块约(5±1) g,分别放入100 mL离心管中,加入50 mL去离子水,高速匀浆30 s。制得的匀浆液在10000 r/min、4 ℃条件下离心15 min后,取上清,定容至100 mL,取80 mL用于电子舌分析。样品测量的循环次数为4次,取后3次数据用于主成分分析(PCA)[18]。
1.3 数据处理
所有实验均独立重复三次,数据表示为平均值±标准差。采用SAS 8.0软件进行单因素方差分析(ANOVA),差异显著性选择邓肯多重比较检验,P<0.05为差异显著。采用Origin 8.0进行绘图。
2 结果与分析
2.1 PAW性质的测定
2.1.1 PAW抗菌活性及抗菌时效的测定 如图2所示,在恒定的处理电压及频率条件下,随着等离子体射流装置处理时间的增加(储藏时间为0 h),PAW的抗菌活性显著增强(P<0.05)。经等离子体射流装置处理1、2和3 min后,得到的PAW能使肠炎沙门氏菌的菌落数从原始的7.76lg CFU/mL(去离子水处理)分别降至7.21lg、5.81lg和4.72lg CFU/mL,分别降低了0.55lg、1.95lg和3.04lg CFU/mL(杀菌率分别为71.82%、98.88%和99.91%)。由此可见,PAW对食源性致病菌具有较好的抗菌作用,能够显著(P<0.05)降低菌落数,适合用于生鲜肉的清洗。等离子体活性水作为一种新型的抗菌液,具备抗菌效果的同时也应有一定的稳定性。从图2中可知,PAW-1储藏至4 h时,其抗菌性能与去离子水处理相比无显著性差异,相比之下,PAW-3仍保持较好的抗菌性能,表明等离子体射流处理的时间越长,PAW的抗菌时效越长,且PAW的抗菌性能最高能够保持8 h。

图2 等离子体活性水对菌落数的影响Fig.2 Effects of plasma-activated wateron the number of live bacterium
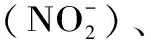

图3 等离子体活性水中长效物质的测定 Fig.3 Detection of long-lived species in plasma-activated water 注:小写字母表示差异显著(P<0.05),图5~图8同。

综上可知,随着等离子体处理时间的延长,PAW中的抗菌活性物质含量能够增加;PAW中的过氧化氢与亚硝酸根反应形成的ONOOH虽具有较强的抗菌性能,但由于其化学性质的不稳定,抗菌时效很短;PAW储藏过程中的抗菌性能主要归因于亚硝酸根在酸性条件下分解形成的具有较强杀菌活性的NO·和NO2·。因此,PAW的抗菌性能相对稳定,并非是瞬时性的,对于产业应用具有一定的可行性。
2.2 PAW处理对生鲜黄鱼品质的影响
2.2.1 PAW对生鲜黄鱼的抗菌效果 如图4所示,经PAW处理后,黄鱼表面肠炎沙门氏菌的活菌数量显著降低(P<0.05),且随着等离子体射流处理水时间的增加,其抗菌效果显著(P<0.05)增加。经PAW-1、PAW-2和PAW-3浸泡后,黄鱼表面的沙门氏菌数从5.26lg CFU/g(去离子水处理)分别降低至5.15lg、4.98lg和4.14lg CFU/g,其中PAW-3抗菌效果最显著(P<0.05),可使黄鱼表面沙门氏菌细菌数降低1.12lg CFU/g,杀菌率达92.41%,因鱼肉组织结构的影响,杀菌率略低于纯菌液的杀菌效果。经去离子水、PAW-1、PAW-2和PAW-3处理后的鱼片在4 ℃条件下储藏24 h后,黄鱼表面的沙门氏菌菌落数分别为6.21lg、6.07lg、5.78lg和5.49lg CFU/g,表明等离子体活性水中的抗菌物质(酸性亚硝酸盐:NO·、NO2·)能够有效地抑制鱼肉储藏过程中微生物的生长。综上可知,鱼肉经过PAW简单的浸泡便可实现快速高效的杀菌效果,更利于鱼肉的储藏。

图4 不同等离子体活性水对菌落数的影响 Fig.4 Effects of various types of PAWon the number of live bacterium
2.2.2 PAW对生鲜黄鱼色泽的影响 肉的颜色是消费者用来评判肉质量及新鲜度的重要指标[30],本文利用色差仪测定经PAW浸泡后生鲜黄鱼片的表面色泽。表1表明,经PAW浸泡后,鱼肉的L*和a*值降低,b*值增加,但与对照组相比并无显著性差异(P>0.05)。由此表明,PAW不会引起鱼肉的肉色发生显著变化。

表1 不同等离子体活性水处理对黄鱼表面色泽的影响Table 1 Effects of various types of PAWon the surface color of yellow croaker
2.2.3 PAW对生鲜黄鱼pH的影响 图5为不同PAW处理对黄鱼pH的影响,从图5中可以看出,PAW处理对鱼肉pH的影响较小。PAW-3 浸泡后的鱼肉,其pH从6.54降低至6.45,表明鱼片经PAW浸泡处理后,PAW本身的低pH特性并不会影响鱼肉的pH。同时由于鱼肉本身呈酸性[31],pH6.45并不会显著影响肉的品质,同时低pH的环境能抑制微生物的生长。

图5 不同等离子体活性水对黄鱼pH的影响Fig.5 Effect of various types of PAWon the pH of yellow croaker
2.2.4 PAW对生鲜黄鱼TBARS值的影响 等离子体中的长效物质或者自由基可通过从脂质分子中提取氢离子开启脂质氧化过程[32],Kim和孟婧怡等也指出猪肉经等离子体处理后其脂质氧化情况显著增强[33-34]。本实验利用TBARS值评估不同种等离子体活性水(PAW-1,PAW-2,PAW-3)对鱼肉脂质氧化的影响。如图6所示,随着等离子体处理水时间的延长,鱼肉中TBARS含量增加。当等离子体射流处理水的时间增至3 min时,鱼肉的丙二醛含量从0.30增至0.34 mg/kg,表明此时等离子体活性水中的活性物质或通过后续反应形成的自由基,可能会破坏脂肪酸的功能,引起脂质氧化[35]。Greene等指出当鲜肉中的丙二醛含量在0.6 mg/kg以上时会对肉的感官品质及风味造成影响[36]。本实验中PAW处理后鱼肉的丙二醛含量远远低于该值,表明PAW浸泡不会对生鲜黄鱼片的脂肪氧化产生影响。

图6 不同等离子体活性水对黄鱼TBARS值的影响Fig.6 Effect of various types of PAWon the TBARS values of yellow croaker
2.2.5 PAW对生鲜黄鱼亚硝酸盐含量的影响 本文通过检测黄鱼中亚硝酸盐的含量来判断PAW处理是否会造成过量的亚硝酸盐残留。如图7所示,鱼肉经水及PAW-1、PAW-2和PAW-3处理后,鱼肉的亚硝酸盐含量分别为0.23、0.35、0.43和0.49 mg/kg,虽然PAW浸泡后黄鱼中亚硝酸盐的含量有所增加,但均远远低于限量值(30 mg/kg)[37],表明鱼片经PAW浸泡处理后,PAW中的部分亚硝酸根虽会吸附在鱼片表面却不会造成严重残留,因此不会对人体健康造成危害。另外,在储藏过程中,硝化还原菌的作用远弱于细菌亚硝酸盐还原酶,亚硝酸盐被还原为一氧化氮,导致亚硝酸盐的减少的同时也能够起到抗菌作用[38]。

图7 不同等离子体活性水对黄鱼亚硝酸盐含量的影响Fig.7 Effect of various types of PAWon the nitrite content of yellow croaker
2.2.6 PAW对生鲜黄鱼肌肉持水力的影响 鱼体肌肉的持水力与其嫩度及质构等品质密切相关[39],如图8所示,经去离子水及三种等离子体活性水处理后,鱼肉的持水力分别为76.0%、75.1%、73.4%及72.9%。与去离子水处理组相比,等离子体活性水处理降低了鱼肉的持水力,但并未产生显著性差异,表明等离子体活性水中的氮氧自由基(NO·、NO2·)并不会对肌肉蛋白的空间结构造成严重破坏,导致肌原纤维间隙中的水分的过量流失[40]。

图8 不同等离子体活性水对黄鱼肌肉持水力的影响Fig.8 Effect of various types of PAWon the water holding capacity of yellow croaker
2.2.7 PAW对生鲜黄鱼气味及味感的影响 如图9A所示,两个主成分PC1和PC2代表了电子鼻数据库中89.5%的信息,且二维主成分分析(PCA)图能较好地区分不同处理后鱼肉的气味。PC1解释了传感器响应的主要差异,水、PAW-1、PAW-2和PAW-3处理组的样品沿PC1轴依次排列,但并未过度分散,表明随着等离子体处理时间的增加,等离子体活性水中的活性物质会对鱼肉的气味造成影响,当等离子体处理时间在3 min以内时对鱼肉气味的影响并不显著。
如图9B所示,两个主成分PC1和PC2代表了电子舌数据库中75.8%的信息,因此可反映样品的绝大部分信息。水、PAW-1、PAW-2和PAW-3处理组的数据点大部分出现重叠,并不能明显地区分开,可见处理组之间的味感信息具有很大的相似性,表明鱼片经等离子体活性水浸泡后并不会对其味感产生显著的影响。

图9 不同等离子体活性水对黄鱼(A)气味及(B)味感的影响Fig.9 Effects of various types of PAWon the(A)odor and(B)taste of yellow croaker
3 结论

