高产酸菌株的筛选、鉴定及其混菌发酵对菜籽粕营养价值的影响
2020-06-19肖宇婷王景峰王国强赵琦锴
帖 余,肖宇婷,刘 军,李 丽,*,王景峰,王国强,赵琦锴
(1.四川轻化工大学生物工程学院,四川自贡 643000; 2.乐山恒峰华邦生物科技有限公司,四川乐山 614000)
菜籽粕是菜籽经榨油后的副产物,其粗蛋白含量为35%~42%,碳水化合物含量为20%~25%,粗纤维含量为12%~13%,且氨基酸组成平衡,是一种优质的植物蛋白资源[1],近年来常被作于制备多肽及作为动物日粮[2-3]。由于其中含有硫苷、植酸等抗营养因子,限制了其在食品、动物日粮中的应用价值[4-5]。为提高菜籽粕应用价值,国内外学者已对其抗营养因子的降解进行了大量研究,如物理法、化学法、酶法、微生物发酵法等[6-7]。因微生物发酵法相比于物理、化学、酶法具有成本低、营养物质损失少、发酵降解抗营养因子的同时能提高蛋白营养价值等优点而受到广泛关注。近年来,大量研究中常用到乳酸菌、曲霉、枯草芽孢杆菌等进行固态发酵降解菜籽粕抗营养提高小肽含量[8-9]。吴正可等[10]通过嗜酸乳杆菌发酵菜籽粕后,将总酸从1.01%提高至3.10%,硫苷从37.48 μmol/g降至28.60 μmol/g,有效改善了其营养价值。Shi等[11]研究结果表明通过黑曲霉发酵菜籽粕72 h后,将菜籽粕中硫苷从41.91 μmol/g降低至23.86 μmol/g,小肽含量从2.57%提高至8.39%,但并不能提高酸度改善风味。
虽然将乳酸菌应用于菜籽粕发酵能提高菜籽粕总酸含量和改善其风味,但对于降解硫苷、大分子蛋白的能力有限。鉴于黑曲霉在发酵的过程中能产生多种酶系,对降解抗营养因子及分解大分子蛋白效果显著。因此,在本研究中,将乳酸菌和黑曲霉混菌发酵同时结合两步法进一步降解菜籽粕中的抗营养因子和分解大分子蛋白[12],以达到改善菜籽粕营养价值的目的,扩大菜籽粕的应用范围。
1 材料与方法
1.1 材料与仪器
黑曲霉 中国工业菌种保藏中心(CICC);乳杆菌 泡菜水中分离;泡菜水 三种市售泡菜水;菜籽粕、麸皮 乐山恒峰华邦科技有限公司;LBS培养基 北京奥博星生物技术有限责任公司;过氧化氢酶试剂盒 上海源叶生物科技有限公司;细菌DNA提取试剂盒 杭州新景生物试剂开发有限公司;其他试剂均为国产分析纯 成都市科隆化学品有限公司。
SW-CJ-2D双人单面净化工作台 苏州净化设备有限公司;K9840自动凯氏定氮仪 山东海能科学仪器有限公司;AT-710电位自动滴定计 Kyoto Electronics MFG公司;BCD-571WDPF冰箱 海尔集团电器产业有限公司;T-114型分析天平 北京赛多利斯仪器系统有限公司;T6紫外-可见分光光度计 北京普析通用仪器有限公司;QYC-2102C型恒温培养摇床 上海福马实验设备有限公司;MF80BSH-2型霉菌培养箱 上海新苗医疗器械制造有限公司;LS-75HD立式高压蒸汽灭菌器 江阴滨江医疗设备有限公司。
1.2 实验方法
1.2.1 培养基的配置 MRS液体培养基:蛋白胨10 g,牛肉膏10 g,酵母粉5 g,葡萄糖5 g,乙酸钠5 g,柠檬酸二铵2 g,Tween-80 1 g,K2HPO42 g,MgSO4·7H2O 0.2 g,MnSO4·H2O 0.05 g,去离子水1.0 L,pH6.8,121 ℃灭菌15 min。
MRS琼脂培养基:同MRS液体培养基,向其中添加20 g琼脂,121 ℃灭菌15 min。
黑曲霉菌麸皮种子培养基:麸皮∶水=2∶1 (W/V),混匀后取30 g装入500 mL 三角瓶,121 ℃灭菌15 min。
菜籽粕发酵培养基:菜籽粕∶麸皮=72∶28 (W/W),添加含0.12%吐温溶液,使其水分含量为58%(W/W),混匀后取 60 g 装入500 mL三角瓶,121 ℃灭菌15 min。
1.2.2 高产酸乳杆菌分离筛选 初筛:将泡菜水中分离得到的76株乳杆菌分别于LBS培养基划线,并于37 ℃培养3 d,挑取生长快,单菌落为灰白色,直径在0.5~0.25 mm的菌株进行过氧化氢酶接触试验,对酶接触试验呈阴性的菌株进行复筛。
复筛:将初筛获得的菌株接种于MRS培养基中,37 ℃培养18 h。培养后,按1%接种量接种于菜籽粕发酵培养基,混匀,装入自封袋并排出空气,37 ℃厌氧发酵24 h,发酵结束后测定总酸,选择发酵菜籽粕产酸优势乳杆菌,以接种无菌MRS培养基替代乳杆菌种子液做空白对照。
1.2.3 菌株鉴定 通过细菌DNA提取试剂盒法提取优势菌株基因组后,用细菌16S rDNA通用引物27f(5′-AGAGTTTGATCMTGGCTCAG-3′)和1492r(5′-TACGGYTACCTTGTTACGACTT-3′)进行PCR扩增。PCR反应条件为:预变性:98 ℃,5 min;变性:98 ℃,10 s;退火:55 ℃,15 s,延伸:72 ℃,20 s;循环数:35;终延伸:72 ℃,5 min。将PCR扩展产物送至成都擎科梓熙生物技术有限公司进行测序。将测序序列与GenBank核酸序列数据库进行BLAST同源性对比分析,运用Mega 7.0构建系统发育树,确定所选菌株种属。
1.2.4 菌株生长曲线 将保藏于斜面的乳杆菌接种于MRS液体培养基中并于37 ℃培养12 h后,按1%接种量(V/V)接种于250 mL MRS培养基中,37 ℃静置培养36 h,每隔3 h取样1次,于600 nm 处测定OD值,确定菌体浓度。
1.2.5 乳杆菌发酵温度对产酸的影响 将筛选得到的乳杆菌按1.2.2中复筛的方法接种发酵菜籽粕,探讨不同发酵温度(35、36、37、38、39、40、41、42和43 ℃)对乳杆菌发酵菜籽粕产酸的影响。
1.2.6 混菌发酵结合两步法对发酵菜籽粕产酸的影响 黑曲霉麸曲种子:将斜面保藏的黑曲霉用接种环勾取3环接种于种子培养基中,30 ℃恒温培养72 h;乳杆菌发酵种子液:将复筛的乳杆菌按1%接种量(V/V)接种于MRS液体培养基中,于37 ℃下,按1.2.4中确定的最佳培养时间培养。
两步法—发酵:将黑曲霉麸曲种子按3%(W/W)接种量接种于菜籽粕发酵培养基中,混匀,28 ℃发酵48 h;发酵结束后,将发酵后的菜籽粕装入自封袋中,按1%接种量(V/W)接种乳杆菌种子液,混匀并排出自封袋空气后于1.2.5中确定的最佳温度下发酵,于不同发酵时间下测得总酸和还原糖含量。
两步法—酶解:操作与两步法步骤相同,仅用接种无菌水替换接种乳杆菌,于1.2.5中确定的最佳温度下对发酵菜籽粕进行酶解处理,于不同酶解时间下测定总酸和还原糖含量。
乳杆菌发酵:于菜籽粕发酵培养基中接种1%接种乳杆菌种子液(V/W)并于1.2.5中确定的最佳温度下进行发酵,于不同发酵时间下测定总酸含量。
空白对照:以未接种黑曲霉和乳杆菌进行两步法处理或未接种乳杆菌、黑曲霉进行单菌发酵的菜籽粕为空白对照。
1.2.7 混菌发酵结合两步法对发酵菜籽粕过程中硫苷、酸溶蛋白、氨基酸态氮含量变化 按1.2.6中两步发酵方式对菜籽粕进行发酵,测定发酵过程中硫苷、酸溶蛋白、氨基酸态氮含量变化,同时对酶解过程中硫苷含量进行测定,确定两步发酵对硫苷降解的影响。
1.2.8 指标的测定 总酸:根据GB/T 12456-2008[13]测定,结果以乳酸计。还原糖:参考文献[14]采用DNS法测定。酸溶蛋白:参考GB/T 22492-2008[15]测定。氨基酸态氮:根据GB 5009.235-2016[16]测定。硫苷:根据文献[17]方法测定。
1.3 数据处理
每次试验设置三个平行,试验结果采用平均值±标准误差表示,使用SPSS 22.0进行单因素方差分析,并采用Duncan检验法进行多重比较,以P<0.05作为差异性显著判断标准。
2 结果与分析
2.1 高产酸的乳杆菌初筛与复筛
通过LBS乳杆菌选择培养基筛选出了34株长势良好且过氧化氢酶接触试验呈阴性的菌株。通过固态发酵菜籽粕试验对34株菌进行复筛,结果如图1所示。

图1 发酵菜籽粕高产有机酸菌株筛选Fig.1 Screening of strains producing high organicacid during fermentation of rapeseed meal注:*表明实验组与空白组具有显著差异(P<0.05);菌株编号以a,b,c开头表明筛选自三种不同类型的泡菜水。
结果表明,相比于未添加乳杆菌发酵的空白对照,除a1和a3外,其他32株乳杆菌产酸能力都较好,总酸含量显著提高(P<0.05)。分别经a2,a11,c5,c10,c11,c13发酵菜籽粕后,总酸含量均从0.31%提高至1%以上,尤其经c10发酵后,总酸含量最高,达到1.24%,与空白相比提高了300%。说明乳杆菌c10在菜籽粕中生长良好,且能利用菜籽粕中多种糖类发酵并产生大量酸性物质,使得总酸含量大幅提高,因此选择c10用于后续研究。
2.2 乳杆菌菌株鉴定
通过PCR对c10基因组中16S rDNA 扩增后送至擎科生物有限公司测序,将测序所得序列与NCBI数据库中已收录DNA序列进行BLAST对比,并构建系统发育树(图2)。结果表明,c10为乳杆菌属(Lactobacillus),与类食品乳杆菌(LactobacillusparalimentariusDSM 13238)的相似性达99.37%,因此确定c10为类食品乳杆菌。

图2 菌株c10系统发育树Fig.2 Phylogenetic tree of c10 strain
2.3 乳杆菌生长曲线
图3为类食品乳杆菌生长曲线。结果表明,0~3 h为生长延滞期,3 h后,进入对数生长期,菌体浓度迅速增加。到12 h后,可能进入对数末期,菌体浓度缓慢增加。为保证接种的乳杆菌处于对数生长期,在后续试验中,均选择培养12 h的处于对数生长期的菌种活化液作为发酵菜籽粕种子液。

图3 类食品乳杆菌生长曲线Fig.3 The growth curve of Lactobacillus paralimentarius
2.4 温度对类食品乳杆菌发酵菜籽粕产酸的影响
图4为类食品乳杆菌于不同温度下发酵24 h后菜籽粕中总酸含量变化情况。结果表明,37~40 ℃为发酵菜籽粕产酸的最佳温度,当发酵温度低于37 ℃或高于40 ℃时,总酸含量显著降低(P<0.05)。可能由于温度过低或过高,乳杆菌生长代谢、胞内外酶活性受到抑制,从而影响产酸的相关代谢途径,导致发酵后菜籽粕中总酸含量较低[18]。

图4 温度对类食品乳杆菌发酵菜籽粕产酸的影响Fig.4 Effect of temperature on acid production duringfermentation of rapeseed meal by Lactobacillus paralimentarius注:不同小写字母表示差异显著(P<0.05),图5同。
由于黑曲霉在发酵菜籽粕过程中能产生蛋白酶、纤维素酶等,发酵结束后进一步提高温度进行酶解,可将菜籽粕中大分子营养物降解为小分子营养物。因此在第二步厌氧发酵(乳杆菌发酵)过程中,适当提高环境温度将有利于提高蛋白酶、纤维素酶活性,为乳杆菌提供大量可发酵碳氮源,促进乳杆菌发酵菜籽粕产酸,同时利于蛋白酶将菜籽粕中大分子蛋白分解为小肽。由于39 ℃利于乳杆菌发酵产酸,且与蛋白酶作用温度接近,因此将39 ℃作为第二步乳杆菌发酵温度。
2.5 混菌发酵结合两步法对发酵菜籽粕总酸含量的影响
如图5A所示,经黑曲霉发酵后,总酸含量从0.37%提高至1.05%。由于黑曲霉可利用多种碳源发酵产生柠檬酸等有机酸[19-20],因此,在第一步黑曲霉有氧发酵中,菜籽粕中部分糖类被黑曲霉转化为有机酸,使得发酵后菜籽粕总酸含量提高。将黑曲霉发酵后的菜籽粕接种类食品乳杆菌进行厌氧发酵后,总酸含量进一步提高。厌氧发酵至3 h时,总酸含量变化较小,发酵3 h后,总酸含量被显著提高,当发酵至12 h后,总酸含量无显著变化(P<0.05)。当两步法发酵至12 h时,总酸含量达到2.74%,与黑曲霉单菌发酵和空白对照比较可知,其总酸含量分别提高160.95%和640.54%。将黑曲霉发酵后的菜籽粕进行酶解后,总酸含量无显著性差异(P>0.05),表明在酶解过程中,黑曲霉发酵产生的酶不影响总酸含量,且在第二步乳杆菌厌氧发酵过程中,总酸含量的变化主要由乳杆菌发酵糖类产生有机酸引起。
图5B为两步法过程中的还原糖含量的变化情况。结果表明,发酵菜籽粕于39 ℃下进行酶解后,还原糖含量明显增加。当酶解至12 h时,菜籽粕中还原糖含量达到30.09 mg/g,相比于黑曲霉有氧发酵结束后,还原糖含量提高了272.86%,延长酶解时间,还原糖含量无显著差异(P>0.05)。当菜籽粕经黑曲霉发酵后,仍有大量多糖未被降解,这些物质在酶解阶段能被黑曲霉发酵产生的多糖水解酶水解,因此使得菜籽粕中还原糖含量明显增加。当接种类食品乳杆菌进行厌氧发酵至12 h后,还原糖含量为17.94 mg/g,相比39 ℃酶解12 h,还原糖含量下降了40.38%。在添加乳杆菌进行厌氧发酵过程中,酶将多糖分解为还原糖的同时,乳杆菌利用这些还原糖发酵产生有机酸,因此相比酶解菜籽粕中,还原糖含量大幅下降,并且总酸含量明显提高。
如图5C所示,经类食品乳杆菌单独发酵菜籽粕24 h,总酸含量提高至1.29%,延长发酵时间,总酸含量无显著差异(P>0.05)。两步法缩短了乳杆菌发酵菜籽粕达到最大产酸量的时间,且相比类食品乳杆菌单独发酵菜籽粕总酸含量提高了112.40%。可能的原因是,在两步发酵过程中,多种酶将菜籽粕中多种大分子物质分解为小分子物质,乳杆菌可利用的小分子营养物质不断增多,加快了其生长代谢速率,因此缩短了产酸时间,同时在此过程中还原糖含量不断增加,经乳杆菌发酵后,总酸含量进一步提高。
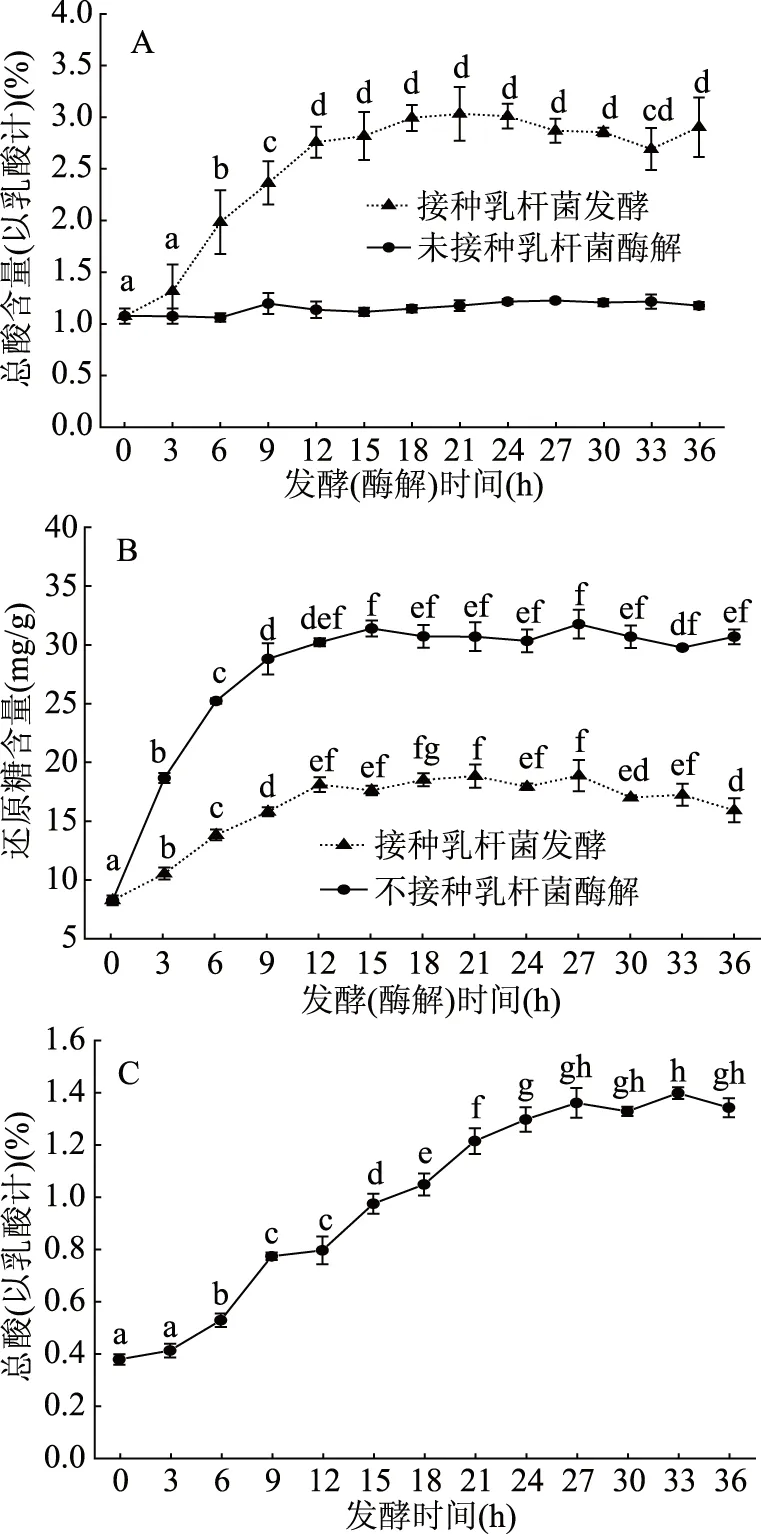
图5 发酵方式对菜籽粕总酸及还原糖含量的影响Fig.5 Effect of fermentation mode on total acidand reducing sugar content of rapeseed meal
2.6 混菌发酵结合两步法对硫苷含量的影响
黑曲霉在发酵48 h后进入酶解阶段,结果如表1所示,将黑曲霉发酵后的菜籽粕于39 ℃酶解后,硫苷含量明显降低,经酶解12 h后,硫苷含量降低为13.29 μmol/g,随着酶解时间的延长,其含量无显著变化(P>0.05)。此结果与黑曲霉一步发酵后接种乳杆菌于39 ℃发酵12 h后的硫苷含量无显著差异(P>0.05),表明类食品乳杆菌在第二步厌氧发酵产酸过程中的相关代谢活动不会对黑曲霉分泌的相关酶系分解硫苷产生影响。当两步发酵菜籽粕至12 h后,硫苷、总酸含量均无显著变化(P>0.05),因此在后续试验中仅关注两步发酵12 h后菜籽粕中酸溶蛋白及氨基酸态氮含量变化,确定两步发酵的最佳发酵时间。

表1 混菌发酵结合两步法对硫苷含量的影响Table 1 Effect of mixed fermentation with two-step method on glucosinolates content
2.7 混菌发酵结合两步法对酸溶蛋白和氨基酸态氮含量的影响
表2为混菌发酵结合两步法对酸溶蛋白和氨基酸态氮含量的影响。结果2.5表明,经两步发酵12 h后,总酸含量不再随发酵时间延长而变化,但酸溶蛋白、氨基酸态氮含量均随发酵时间延长而增加。当发酵至18 h后,酸溶蛋白及氨基酸态氮含量分别提高至19.08%和1.23%,且不随发酵时间延长而改变(P>0.05),相比黑曲霉单步发酵后分别提高78.48%和68.27%。因此确定两步发酵的最佳发酵时间为18 h。之前的研究表明[21],将黑曲霉发酵后的菜籽粕进一步酶解后,由于菜籽粕中大分子蛋白被黑曲霉发酵产生的相关蛋白酶分解,将大幅度提高菜籽粕中小分子蛋白含量。因此,在本研究中,将发酵的菜籽粕接种乳杆菌进行两步发酵后,总酸含量被提高的同时酸溶蛋白及氨基酸态氮含量也被大幅提高。

表2 混菌发酵结合两步法对酸溶蛋白及氨基酸态氮含量的影响Table 2 Effect of mixed fermentation with two-step method acid-soluble protein,amino acid nitrogen and total acids content
3 结论
本实验从泡菜水中筛选出一株高产有机酸的乳杆菌,经16S rDNA测序鉴定为类食品乳杆菌(Lactobacillusparalimentarius),并确定其发酵菜籽粕产酸的最佳条件。将乳酸菌与黑曲霉混合发酵同时结合两步法作用于菜籽粕后,与空白对照和单菌发酵相比,其总酸含量分别提高了640.54%、160.95%和112.40%;酸溶蛋白和氨基酸态氮含量分别从2.87%和0.12%提高到19.08%和1.23%,其提高率达到了564.81%和925%;硫苷含量从23.09 μmol/g下降到12.65 μmol/g,其降解率为45.21%。以上结果表明,菜籽粕先经黑曲霉发酵产酶再接种乳杆菌两步法处理后,硫苷含量显著下降,菜籽粕的营养价值显著提高,其品质得到了很大的改善,对扩大菜籽粕在食品和饲料中的开发与利用具有实际意义。
