葛根护肝片组方配伍及其辅助护肝功能研究
2020-06-19史保银刘新宇史顶聪秦海龙赵宏宇张凤清
史保银,刘新宇,邸 琳,史顶聪,秦海龙,赵宏宇,*,张凤清,*
(1.长春工业大学化学与生命科学学院,吉林长春 130012; 2.吉林省中医药科学院,吉林长春 130012; 3.吉林省集安益盛药业股份有限公司,吉林通化 134200)
酒精性肝病(ALD)可以被广泛地描述为在慢性和过量的乙醇消耗后具有不同程度的肝功能损伤的病症,在西方国家酒精性肝病是最常见的肝病,在我国酒精性肝病的发病率也在日益增加[1-2]。因此,对酒精性肝损伤的预防及治疗变得尤为重要。葛根是我国传统的解酒中药,其主要成分为黄酮类化合物,含黄豆苷、黄豆苷原及葛根素等,具有保护肝细胞结构和功能完整性的作用,能有效调节 mTOR 信号通路的激活[3-4]。研究发现,在酒精性中毒患者治疗过程中加入中药葛根,可显著改善临床表现,而且具有良好的经济性及可操作性[5]。葛根和水飞蓟组合可改善酒精引起的肝脂肪变性,抑制肝炎[6]。甘草主要含有三萜类、黄酮类及甘草多糖类化合物,甘草甜素或其衍生物[7]归因于其抗炎活性和抗氧化防御能力[8],有助于减轻与酒精有关的负面变化[9]。甘草酸差向异构体不同配比均具有不同程度的调节酒精性肝损伤脂质代谢的作用[10]。目前白芍保肝作机制的研究主要集中在芍药苷对抑制炎性因子、调节免疫、抗细胞凋亡以及抗氧化应激[11]的调节作用方面,临床前药效学研究揭示了其对急性肝损伤、非酒精性脂肪肝等不同类型的肝损伤[12]均有保护作用,但对酒精性肝损伤的实验研究目前仍存在空缺[13]。
实验室拟研发一款对酒精性肝损伤有辅助保护功能的保健食品,命名为葛根护肝片,通过以往药理活性筛选,结合中药配伍理论,已确立了葛根、甘草和白芍的组方。本实验以葛根、甘草、白芍不同配伍对酒精致急性肝损伤小鼠的血清VLDL及肝脏中MDA、GSH含量的影响结果为指标,采用L9(34)正交试验筛选其最优配伍,用数学模型设计组方配伍能分析出组方中的哪一种药物对酒精性肝损伤辅助保护作用的影响更明显,以及每种药物最佳的生药量[14-15]。考虑到按正交表安排的每一组实验动物给药剂量都是在一定范围内变化的,所以进一步研究了最佳配伍各剂量对亚急性酒精性肝损伤小鼠的影响来验证最优配方的效果,以此优化并确立配方中三种药材的配伍,为葛根护肝片的研制提供科学依据。
1 材料与方法
1.1 材料与仪器
SPF级KM雄性小鼠(实验动物生产许可证号:SCXK-(辽)2015-0001,120只,体质量18~21 g,实验动物质量合格证号:211002300035188;70只,体质量18~21 g,实验动物质量合格证号:211002300040738) 辽宁长生生物技术股份有限公司(试验动物使用许可证号:SYXK(吉)2015-0009,由吉林省中医药科学院实验动物伦理委员会审核通过,符合实验动物伦理委员会规定);小鼠颗粒饲料 长春市亿斯实验动物技术有限责任公司(饲料生产许可证号:SCXK-(吉)2010-0001);葛根、甘草、白芍药材 河北百合中药饮片有限公司(经吉林省中医药科学院鉴定,葛根为豆科植物野葛Puerarialobata(Willd.)Ohwi的干燥根,甘草为豆科植物甘草GlycyrrhizauralensisFisch.的干燥根,白芍为毛莨科植物芍药PaeonialactifloraPall.的干燥根;玉米淀粉 石家庄华辰淀粉糖生产有限公司;无水乙醇,乙酸(分析纯) 北京化工厂;磷酸(色谱纯) 天津市光复精细化工研究所;甲醇、乙腈(色谱纯) 默克股份两合公司;MDA试剂盒、GSH试剂盒、TG试剂盒、TC试剂盒、TBIL试剂盒、GPT试剂盒、GOT试剂盒、LDL-c试剂盒 南京建成生物工程研究所;VLDL ELISA试剂盒 武汉华美生物工程有限公司;葛根素标准品(以95.4%计)、芍药苷标准品(以95.7%计)、甘草酸铵标准品(以97.7%计) 中国食品药品检定研究院。
DHG-9134BS-III电热恒温鼓风干燥箱 上海新苗医疗器械仪器设备有限公司;RE-52C系列旋转蒸发仪 上海亚荣生化仪器厂;SHB-ⅢA循环水式多用真空泵 上海豫康科教仪器设备有限公司;DNM-9602型酶标仪 北京普朗新技术有限公司;723可见分光光度计 上海菁华科技仪器有限公司;HC-3618R高速冷冻离心机 安徽中科中佳科学仪器有限公司;SSW-600-2S型电热恒温水槽 上海博讯实业有限公司医疗设备厂;JA2003B型千分之一电子天平 上海越平科学仪器有限公司;PerkinElmer液相色谱仪 美国珀金埃尔默股份有限公司;Ultimate XB-C18(250×4.6 mm) 月旭科技(上海)股份有限公司;KQ5200DE型数控超声波清洗器 昆山市超声仪器有限公司。
1.2 实验方法
1.2.1 葛根护肝片配伍正交设计 2015年版《中国药典》中葛根饮片用量10~15 g,白芍饮片用量6~15 g,甘草饮片用量2~10 g,以葛根、甘草、白芍三个原料作为因素,各自生药用量(每日推荐人体使用量)作为水平,结合预实验筛选结果,设计四因素三水平正交试验,进行配方优选,因素水平见表1。

表1 正交试验因素与水平设计Table 1 Factors and levels in orthogonal experiment design
1.2.2 不同配伍葛根护肝片的制备 根据表1进行配比,每组配方的生药总量为人一日用量(生药量),按生药总量的15倍放大提取。提取条件为:药材加入10倍量的70%乙醇溶液浸泡30 min,微沸状态回流提取3次,每次1.5 h,滤液合并,干燥粉碎,以玉米淀粉补足至63 g(拟定护肝片人每日推荐用量为4.2 g)。性状:黄色粉状,微溶于水(震荡可悬浮)。灌胃液体:受试样品均用 0.5%羧甲基纤维素钠(CMC-Na)水溶液配制。
1.2.3 葛根护肝片对急性酒精性肝损伤小鼠影响实验 实验动物购入后自由进食、饮水适应3 d后进行实验。120只小鼠随机分为10组,分别为对照组和实验组,每组12只。对照组每日上午灌胃0.5% CMC-Na水溶液。实验组小鼠每日灌胃正交样品1~9号,葛根保肝片推荐人每日食用量为4.2 g,小鼠灌胃剂量按人体同体重推荐量的20倍(人体重以60 kg计),既灌胃剂量为4.2/60×20=1.4 g/kg·BW,连续灌胃四周,每周称重2次,灌胃体积随体重调整(10 mL/kg·BW)。
给予小鼠受试样品27 d,第28 d禁食不禁水6 h后,所有小鼠灌胃50%乙醇,灌胃体积为12 mL/kg·BW。在给予酒精15 h后给予受试物,再1 h后摘除眼球取血,离心取血清,保存备用。颈椎脱椎处死,摘取肝脏,截取合适大小肝块称重,以肝叶重量10 倍体积的生理盐水研磨肝叶,研磨液4 ℃放置过夜,离心,取上清液备用。
对急性酒精性肝损伤小鼠血清中VLDL及肝脏中MDA、GSH含量进行测定,并进行酒精性肝损伤保护作用综合评分,评分标准如下:以每组小鼠指标的均值作为统计值,评分时,每项指标以对照组均值作为0分,以实验组中最优组的均值作为100分;MDA、GSH、VLDL含量评分各占综合评分的1/3。以保肝综合评分为指标进行正交实验的方差分析及极差分析,考察最优配伍组合。为验证最优配伍对酒精性肝损伤的作用,同时进一步研究该配伍对乙醇所致小鼠亚急性酒精肝损伤的影响,进行了后续实验。
1.2.4 亚急性酒精性肝损伤小鼠实验 灌胃药品为正交试验最优葛根护肝片配伍。灌胃样品制备:以最优配伍组合生药总量的15倍放大提取(生药总量为人一日用量),配方工艺条件同1.2.2,以玉米淀粉补足至45 g(拟定护肝片人每日推荐用量为3.0 g)。
实验动物购入后自由进食、饮水适应3 d后进行实验。70只小鼠随机分为5组,分别为对照组、模型组、高剂量组、中剂量组、低剂量组,每组14只。对照组和模型组每日上午灌胃0.5% CMC-Na水溶液,高、中、低剂量组灌胃样品的剂量分别为人每公斤体重的20、10、5倍(人体重以60 kg计),即(3.0/60×20=1.00、3.0/60×10=0.50、3.0/60×5=0.25)1.00、0.50、0.25 g/kg·BW,所有小鼠灌胃体积均为10 mL/kg·BW。给予28 d,从第15 d开始,每日下午除对照组外,另4组灌胃给予30%乙醇10 mL/kg,末次给药后采血,分离血清,取肝脏称量重量,摘取最大叶分成2份,研磨肝脏,另取一叶4%甲醛固定,进行病理组织学检查,计算肝脏系数,测定血清中TG、TC、TBIL、VLDL、LDL-c含量、GOT、GPT活性,测定肝脏中GSH含量。
1.2.5 血清及肝脏中各指标含量及活性检测 血清中TG含量采用甘油磷酸氧化酶法(GPO-PVP)检测、TC含量采用葡萄糖氧化酶法(GOD-PAP)检测、TBIL含量采用钒酸氧化法检测、VLDL含量采用酶联免疫吸附测定法(ELISA)检测、LDL-c含量采用直接法检测、GOT及GPT活性采用赖氏法进行检测;肝脏中MDA含量采用硫代巴比妥酸比色(TRA)法检测、GSH-Px含量采用比色法进行测定。
1.2.6 葛根护肝片最优配伍提取物中葛根素、芍药苷、甘草酸含量测定 功效成分含量检测及方法学研究参考2015版《中国药典》、GB/T 22251-2008、《保健食品功效成分检测方法》(白鸿 主编)、《保健食品功效成分检测技术与方法》(马双成 等主编),并在此基础上进行了适应性改进。
1.2.6.1 葛根素测定 对照品溶液的配制:精密称取葛根素对照品适量,加甲醇制成每1 mL含葛根素0.08 mg的溶液。
供试品溶液的制备:取约0.9 g,精密称定,置于具塞锥形瓶中,精密加入30%甲醇25 mL,密塞,称定重量,超声处理(功率200 W,频率40 kHz)40 min,放冷,再称定重量,用甲醇补足减失的重量,摇匀,取10 mL稀释10倍,滤过,取续滤液。
测定条件:进样量:5 μL;流动相:甲醇-(36%乙酸∶水=3∶27,V/V)(78∶22,V/V);检测波长:247 nm;柱温:25 ℃;流速:0.8 mL/min。
1.2.6.2 芍药苷测定 对照品溶液的制备:精密称取芍药苷对照品适量,置于10 mL容量瓶中,用甲醇溶解并稀释至刻度,制成芍药苷质量浓度为0.32 mg/mL的对照品储备液,置于4 ℃的冰箱中备用。使用前取一定量的对照品储备液,以甲醇为稀释液稀释至芍药苷浓度为60 μg/mL标准溶液。
供试品溶液的制备:取约1.3 g,精密称定,置具塞锥形瓶中,精密加入50%乙醇25 mL,密塞,称定重量,超声处理(功率200 W,频率40 kHz)40 min,放冷,再称定重量,用乙醇补足减失的重量,摇匀,取10 mL稀释10倍,滤过,取续滤液,即得。
测定条件:进样量:5 μL;流动相:以0.1%磷酸水溶液为流动相A,以80%乙腈为流动相B,按下表进行梯度洗脱。检测波长:230 nm;柱温:25 ℃;流速:1.0 mL/min。

表2 流动相梯度Table 2 Gradient of mobile phase
1.2.6.3 甘草酸测定 对照品溶液的制备:精密称取甘草酸铵对照品适量,置于20 mL容量瓶中,用甲醇溶解并稀释至刻度,制成甘草酸铵质量浓度为 0.32 mg/mL的对照品储备液,置于4 ℃的冰箱中备用。使用前取一定量的对照品储备液,以甲醇为稀释液稀释至甘草酸铵浓度为80 μg/mL 标准溶液。
供试品溶液的制备:取约1.9 g,精密称定,置于具塞锥形瓶中,精密加入70%乙醇25 mL,密塞,称定重量,超声处理(功率200 W,频率40 kHz)30 min,放冷,再称定重量,用乙醇补足减失的重量,摇匀,取10 mL稀释10倍,滤过,取续滤液,即得。
测定条件:进样量:10 μL;流动相:以0.05%磷酸水溶液为流动相A,以80%乙腈为流动相B,按下表3进行梯度洗脱;检测波长:237 nm;柱温:25 ℃;流速:1.0 mL/min。

表3 流动相梯度Table 3 Gradient of mobile phase
1.3 数据处理

2 结果与分析
2.1 正交试验结果及最优配伍分析
急性酒精性肝损伤小鼠血清中VLDL及肝脏中MDA、GSH含量测定及评分结果见表4。

表4 各组小鼠血清中VLDL及肝脏中MDA、GSH的含量及各指标评分Table 4 Scores of serum VLDL and MDA,GSH in liver of mice in each group
以保肝综合评分为指标,考察最优配伍组合,正交试验和方差分析结果见表5、表6。由表 5 知,各因素水平 kA2>kA3>kA1,kC1>kC3>kC2,kD1>kD2>kD3,所以最优配伍组合为 A2C1D1,既葛根4 g,甘草 2 g,白芍2 g。表6可知,对考察指标影响的主要因素是配伍中葛根,其次是甘草,影响最小的是白芍。

表5 正交试验设计及极差分析Table 5 Orthogonal experimental design and range analysis

表6 方差分析Table 6 Analysis of variance
2.2 对小鼠亚急性酒精性肝损伤的影响
2.2.1 对小鼠血清中TC、TG、LDL-c和VLDL含量的影响 由表7可知,与对照组比较,模型组小鼠血清中TC、TG、LDL-c及VLDL含量均显著升高(P<0.05),结合表8模型组小鼠血清中TBIL含量显著升高(P<0.05)情况可判定亚急性酒精性肝损伤模型成立。
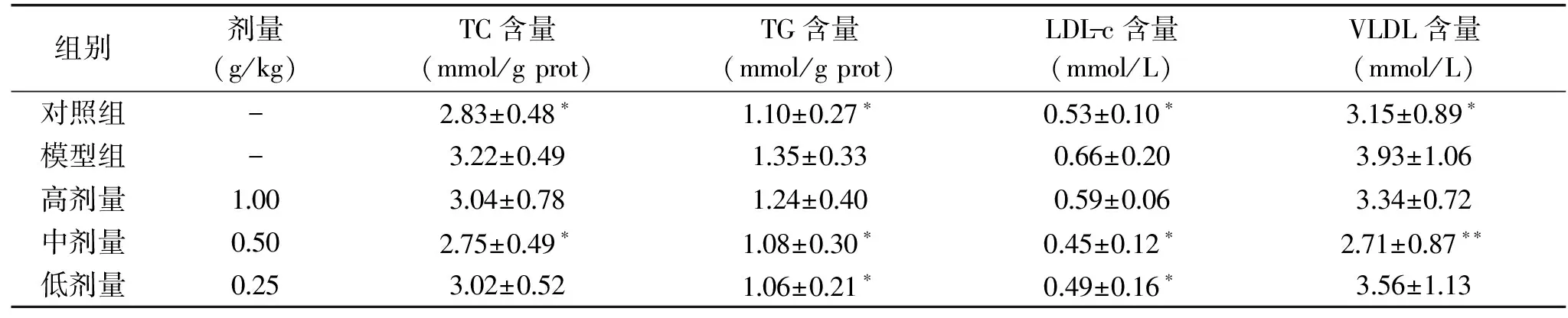
表7 各实验组小鼠血清中TC、TG、LDL-c和VLDL含量Table 7 Contents of TC,TG,LDL-c and VLDL in serum of mice in each experimental group

表8 各实验组小鼠血清中TBIL含量及GOT、GPT活性Table 8 Content of TBIL and activity of GOT,GPT in serum of mice in each experimental group
从表7的数据中可以看出,各剂量对小鼠亚急性酒精性肝损伤均有一定的改善作用。中剂量效果最佳,组内小鼠血液中各项指标含量均有降低(P<0.05)。其次为低剂量,可有效降低小鼠体内TG及LDL-c含量(P<0.05)。高剂量组各指标含量均有降低,但与模型组相比无显著差异。说明葛根、甘草、白芍最优配伍可改善乙醇诱导小鼠肝脏损伤造成的脂代谢异常。同时表明该配伍与其改善小鼠酒精性肝损伤作用的量效关系不成正比,预防及改善酒精性肝损伤不能简单的增加其剂量,需要进一步研究。
2.2.2 对小鼠血清中TBIL、GOT及GPT水平的影响 由表8可知,与对照组比较,模型组小鼠血清中TBIL含量显著升高(P<0.05),GPT和GOT活性无明显变化。肝细胞具有摄取、结合、运输TBIL的功能[16-17]。乙醇致小鼠肝细胞受损后,其摄取、结合、排泄TBIL的功能下降,使得血液中的TBIL积累,模型组小鼠血清中的TBIL含量显著升高(P<0.05),而最优配伍各剂量均能显著降低小鼠血清中TBIL的含量(P<0.05),证明肝细胞受损情况得以改善,功能趋于正常,其中中剂量效果最佳。GPT、GOT活性是评价肝细胞损害程度的指标[18]。GPT存在于胞浆中,GOT存在于线粒体中,肝细胞被破坏时,血清中GPT、GOT的浓度升高[19]。当肝细胞无明显坏死,而仅有肝细胞膜的通透性增加时,血中GOT的浓度亦可明显增高,是酒精性肝损伤的敏感指标之一。模型组小鼠血清中的GPT、GOT活性与对照组无明显差异,而各剂量组小鼠血清中GPT、GOT活性与模型组相比虽无显著差异,但确有所下降,表明长期给小鼠灌胃浓度为30%的乙醇,小鼠的肝脏会逐渐适应代偿,肝细胞膜或线粒体不会破裂[20],与赵敏等[21]的研究结果一致,而葛根护肝片能在改善脂代谢的同时保护小鼠肝细胞不受损。
2.2.3 对小鼠肝脏指数及GSH水平的影响 由表9可知,与对照组比较,模型组小鼠体肝脏指数明显增大,肝脏中GSH含量明显升高,差异均显著(P<0.05)。与模型组相比,各剂量组小鼠的肝脏指数与GSH含量无明显差异。

表9 各实验组小鼠的肝指数及肝组织中GSH的含量Table 9 Liver index and the content ofGSH in the liver of each experimental group
GSH作为抗氧化酶的辅助因子,在维持细胞氧化还原稳态中起关键作用[22]。在实验中后期给小鼠灌胃 30% 乙醇,主要目的是给予肝脏代谢压力[23-24]。由表9可知,模型组小鼠的肝脏有显著性的增重(P<0.05),并且小鼠肝脏中储藏的还原型物质 GSH 较高,结合肝脏指数及GSH含量两个指标来看,这可能是由于小鼠为适应乙醇的摄入,尝试增加肝脏中的功能组织细胞,提高了合成GSH的能力,机体的抗氧化能力也随之升高。与模型组相比,各剂量组小鼠的肝脏指数均略有上升,推测葛根护肝片最优配伍可能有辅助小鼠增加肝脏中功能组织细胞的作用,加快了GSH的合成,对抗自由基脂质过氧化反应,阻止肝细胞脂质过氧化,维持细胞质膜的正常结构,保护肝细胞免受损伤。虽然给小鼠灌胃的是葛根、甘草、白芍三种药材提取的混合物,存在除有效成分外的其他物质增加肝脏代偿负担的可能性,考虑到其筛选出的最优配伍中剂量能有效的降低小鼠血清中TC、TG、LDL-c及TBIL各指标的含量,该可能性不高。
2.2.4 对小鼠肝脏组织病理变化影响 如图1a所示,正常对照组小鼠的肝内可见多个肝小叶,肝索及肝窦排列整齐,汇管区三种管道结构清楚可见,无明显异常,呈正常肝组织结构。模型组小鼠的肝细胞以气球样变性为主,同时可见肝细胞胞浆疏松。比较正常对照组,模型组肝细胞损伤明显(图1b);证明肝损伤的模型复制是成功的。图1c中高剂量组小鼠的肝细胞变性程度明显减轻,未见肝细胞坏死,未见炎细胞浸润;比较模型组,高剂量组可以有效减轻肝损伤的程度。如图1d,中剂量组小鼠的肝细胞变性的程度得到有效减轻,肝细胞以疏松变性为主,未见肝细胞坏死,未见炎细胞浸润;比较模型组,中剂量组可以有效减轻肝损伤的程度。图1e中低剂量组小鼠的肝细胞气球样变的程度得到得到有效的减轻,可见肝细胞以疏松变性,未见肝细胞坏死,未见炎细胞浸润;比较模型组,低剂量组可以在一定程度上减轻肝损伤的程度。由此可知,葛根护肝片高剂量对小鼠酒精性肝损伤的辅助保护作用较好,中剂量组效果较好,低剂量可以在一定程度上减轻肝损伤。

图1 各实验组小鼠肝组织形态的比较(400×)Fig.1 Comparison of liver histology in mice from each experimental group(400×)
2.3 葛根护肝片最优配伍提取物中葛根素、芍药苷、甘草酸含量测定结果
葛根药材中葛根素含量为6.0%、白芍药材中芍药苷含量为2.3%、甘草药材中甘草酸含量为2.1%;经计算该样品(制备见1.2.4)中含有葛根素6.57%、芍药苷1.01%、甘草酸1.01%(甘草酸重量=甘草酸铵重量/1.0207)。
3 讨论与结论
中药配伍不同,其作用效果也有差异[25]。本研究以急性酒精性肝损伤小鼠其血清中VLDL及肝脏中MDA、GSH含量的综合评分为指标,采用L9(34)正交试验来分析葛根护肝片中三种药材的最优配伍,该配伍为葛根4 g、白芍2 g、甘草2 g,提取物中含有葛根素196.98 mg、芍药苷30.45 mg、甘草酸30.44 mg。在亚急性酒精性肝损伤小鼠模型成立的前提下,中剂量组小鼠血清TC、LDL-c和TBIL含量与模型对照组比较降低,差异有显著性(P<0.05),判定该指标结果阳性,即可判定该葛根护肝片最优配伍对亚急性酒精性肝损伤有辅助保护功能。综合二实验可判定该葛根护肝片配伍具有有助于降低酒精性肝损伤危害功能。
ALD的发病机制比较复杂,目前研究认为其发病机制主要为机体反复多次过量摄入酒精,乙醇可通过诱导CYP4502E1,引起氧化应激、脂质过氧化、代谢、营养紊乱等一系列复杂反应,导致肝细胞的功能损伤,进而引起肝组织中甘油三酯含量聚积,胆固醇合成加强,并引起相应载脂蛋白含量的改变。降低肝脏运出脂肪的功能后,乙醇还可增加脂肪组织的脂肪动员,引起早期酒精性脂肪肝和高脂血症。血脂代谢异常表现为血清中TC、TG[26]和载体蛋白(LDL-c、VLDL)含量升高等的变化[27-28]。
与亚急性酒精性肝损伤模型组比较,最优配伍的中剂量(0.50 g/kg·BW)可使小鼠血清中GPT和GOT的活性有所降低,对肝指数和GSH含量无明显影响,可使小鼠血清中TC、TG、LDL-c及TBIL含量显著降低(P<0.05),VLDL含量极显著降低(P<0.01),低剂量可使小鼠血清中TG、LDL-c及TBIL含量显著降低(P<0.05),高剂量可使小鼠血清中TBIL含量显著降低(P<0.05),即中剂量组显示出明显的护肝效果,且效果优于低、高剂量组,小鼠酒精性肝损伤情况有明显的改善,其作用机制可能与增加抗机体抗氧化能力及改善肝脏脂质代谢有关。本研究结果为葛根、甘草、白芍开发为对酒精性肝损伤有辅助保护功能的保健食品或药品提供了重要的实验依据,但本实验所用药材提取物为粗提物,其解酒护肝的有效成分和作用机制还需要更进一步的研究。
