红松松仁多糖对脂多糖诱导RAW264.7细胞炎症反应的抑制作用
2020-06-18伊娟娟王振宇
曲 航,高 鑫,伊娟娟,王振宇,*
(1.哈尔滨工业大学化工与化学学院,黑龙江哈尔滨 150001;2.郑州大学生命科学学院,河南郑州 450001)
巨噬细胞源自单核细胞,是一类重要的免疫细胞,具有多种生理功能。巨噬细胞依靠其特有的吞噬功能,在特异性免疫和非特异性免疫中均发挥着十分重要的作用。当病原微生物等外源物质进入人体,会迅速与相应的抗体形成抗原抗体复合物,而巨噬细胞可以准确识别并吞噬这类复合物,引起免疫应答反应[1]。脂多糖(lipopolysaccharide,LPS)作为革兰氏阴性菌细胞壁的主要组成,在细菌死亡或人为破坏菌的条件下才得以释放。LPS对宿主是有毒性的,其毒性作用主要源于类脂质A[2]。巨噬细胞在LPS的诱导下,不仅细胞增殖能力和吞噬能力明显增强,还会释放大量的细胞因子和炎症介质,如一氧化氮(nitric oxide,NO)、肿瘤坏死因子(tumor necrosis factor-α,TNF-α)、白介素-1β(interleukin-1β,IL-1β)、白介素-6(interleukin-6,IL-6)等。这些介质会对病原微生物的入侵产生抵御作用,过量分泌则会引发炎症反应[3-4]。炎症本身是机体对外源刺激的一种防御或免疫反应,但过度或持续性炎症会引发多种炎症相关性疾病[5]。
多糖是广泛存在于植物、动物和微生物中的一类碳水聚合物[6]。作为天然大分子物质,多糖具有来源广泛、低毒副作用、多靶点、高生物活性等优势,因而逐渐成为功能食品和医药领域的研究热点。近年来,国内外对多糖生理活性的大量报道证明多糖具有抗氧化作用[7]、免疫调节作用[8]、降脂[9]、降血糖作用[10]、保肝作用[11]、抗菌作用[12]和抗肿瘤[13]等诸多生理功能。红松(PinuskoraiensisSieb. et Zucc.)是我国东北地区特有的名贵木材,其种子红松松仁是药食同源类坚果。早在《本草纲目》中就有相关记载“松仁性温、味甘、无毒、主治关节风湿、头眩、润五脏、逐风痹寒气、补体虚、滋润皮肤、久服轻身不老”[14]。红松松仁中富含不饱和脂肪酸、氨基酸、多肽和多糖等生物活性分,在抗氧化、抗衰老、抗肿瘤和免疫调节等方面具有重要作用[15]。前期研究中,课题组从红松松仁提取出一种生物活性多糖PNP40c-1[11],本研究以小鼠单核巨噬细胞白血病细胞系(RAW264.7巨噬细胞系)为研究对象,采用LPS进行诱导,旨在研究PNP40c-1对LPS诱导RAW264.7细胞炎症反应的抑制作用,并探讨其可能的分子机制。
1 材料与方法
1.1 材料与仪器
红松松仁多糖PNP40c-1 实验室分离纯化制得;小鼠巨噬细胞株RAW264.7 黑龙江省肿瘤医院实验中心;RPMI 1640细胞培养基 美国Hyclone公司;新生胎牛血清FBS 美国Clark公司;胰蛋白酶(1∶250)、PBS粉末、双抗(1×105U/L青霉素和100 mg/L链霉素)、LPS、3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)、中性红活细胞染色液(0.33%) 北京索莱宝科技有限公司;NO检测试剂盒 上海碧云天生物技术有限公司;TNF-α、IL-1β、IL-6酶联免疫试剂盒 泉州科诺迪生物技术有限公司;BCA蛋白浓度测定试剂盒、内参(β-actin)抗体、核因子E2相关因子2(nuclear factor(erythroid-derived2)-like 2 protein,Nrf2)抗体、血红素氧化酶-1(heme oxygenase-1,HO-1)抗体 沈阳万类生物科技有限公司;RNA提取试剂盒(9767)、反转录试剂盒(RR047A) 日本TAKARA公司;定量试剂盒 美国Bio-Rad公司;其余试剂 均为市售分析纯。
Bio-Rad-500酶标仪、CFX96 荧光定量PCR仪 美国Bio-Rad公司;CO2细胞培养箱 美国Thermo公司;XDS-1B倒置显微镜 重庆重光实业有限公司;Vert.A1荧光显微镜 德国Axio公司;SW-CJ-1F单人双面超净工作台 香港蓝豹科技有限公司;TDZ4A-WS低速离心机 长沙湘麓离心机仪器有限公司;W205恒温水浴锅 上海申胜生物技术有限公司;DSX-280B高压灭菌锅 上海申安医疗器械厂;BSA224S分析天平 德国Satorius科学仪器有限公司;细胞培养瓶及细胞孔板 美国Corning公司。
1.2 实验方法
1.2.1 细胞培养 RAW264.7细胞用含10%胎牛血清FBS的RPMI 1640细胞培养基,在37 ℃,5% CO2培养箱中培养,每48 h更换一次培养液。采用胰蛋白酶法消化细胞,待细胞开始变圆时,终止消化,加入细胞培养液,轻轻吹打至细胞完全脱落,收集细胞悬液,1000 r/min离心5 min后弃上清。再次加入细胞培养液使细胞重新悬浮,按1∶3比例将细胞接种至培养皿中培养[16]。取对数生长期细胞用于实验研究。
1.2.2 细胞活力检测 取对数生长期RAW264.7细胞,以1×104个/孔接种到96孔板中,每孔100 μL。待细胞完全贴壁后,分别加入25、50、100、200和400 μg/mL的PNP40c-1溶液各5 μL,每组10个复孔;空白组加入同等体积的细胞培养液,孵育24 h后,加入10 μL MTT溶液(5 g/L),继续孵育4 h,然后弃上清,加入150 μL DMSO溶解紫色结晶,5 min后,用酶标仪检测各孔在490 nm波长下的OD值,进行数据分析。
1.2.3 吞噬能力的测定 取对数生长期RAW264.7细胞,以1×105个/孔接种到96孔板中,每孔100 μL。待细胞完全贴壁后,进行分组处理。空白组:不做任何处理;LPS对照组:加入10 μg/mL LPS溶液;多糖处理组:分别加入25、50、100和200 μg/mL PNP40c-1溶液;多糖+LPS处理组:分别加入25、50、100和200 μg/mL PNP40c-1和10 μg/mL LPS溶液,每组10个复孔。孵育24 h后,向每孔中加入预先稀释好的0.1%中性红染液,继续孵育30 min后,弃上清液。用0.01 mol/L PBS缓冲液(pH7.4)反复冲洗三次,然后向各孔中加入200 μL细胞裂解液,裂解30 min后弃裂解液,将96孔板在4 ℃下放置过夜[5]。各孔在540 nm波长下的OD值采用酶标仪进行测定;中性红吞噬率按式(1)计算。

式(1)
式中:A1表示空白组的OD值;A2表示处理组的OD值(包括LPS、多糖和多糖+LPS各处理组)。
1.2.4 NO和一氧化氮合酶的测定 取对数生长期RAW264.7细胞,以1×105个/孔接种到96孔板中,每孔100 μL。细胞的分组及处理方法同1.2.3。待细胞孵育24 h后,根据NO试剂盒的操作说明采用Griess法测定各孔培养液上清中NO的含量。
取对数生长期RAW264.7细胞,以1×106个/孔接种到24孔板中,每孔1 mL。细胞的分组及处理方法同1.2.3。待细胞孵育24 h后,收集上清液,按照一氧化氮合酶(nitric oxide synthase,NOS)试剂盒的说明测定各孔上清液的OD值,并计算iNOS酶活力。
1.2.5 酶联免疫法测定细胞因子含量 取对数生长期RAW264.7细胞,以1×106个/孔接种到24孔板中,每孔1 mL。细胞的分组及处理方法同1.2.3。待细胞孵育24 h后,收集上清液,分别按照TNF-α、IL-1β和IL-6酶联免疫试剂盒的操作说明,测定各OD值,并分别计算各组细胞中分泌细胞因子(TNF-α,IL-1β和IL-6)的含量。
1.2.6 RT-PCR法测定mRNA表达 取对数生长期RAW264.7细胞,以3×106个/孔接种到6孔板中,每孔2 mL。细胞的分组及处理方法同1.2.3。待细胞孵育24 h后,弃培养液,收集细胞,采用试剂盒提取细胞中RNA,然后依次按照试剂盒的操作步骤合成cDNA并进行PCR的扩增。引物由上海生工生物工程公司设计(见表1),深圳华大基因公司进行合成。每次扩增均以β-actin基因作为内参,对PCR产物进行分析和比较。

表1 引物序列Table 1 Sequences of primers used for RT-PCR
1.2.7 蛋白免疫印迹(Western Blot)测定蛋白表达 RAW264.7细胞中Nrf2和HO-1的蛋白表达情况采用Western Blot法进行测定。细胞的分组及处理方法同1.2.3,待培养结束后弃上清,用预冷PBS洗涤三次,使用含蛋白酶抑制剂的RIPA裂解液在冰上裂解蛋白。离心取上清,按照二奎琳甲酸(BCA)蛋白定量试剂盒的操作说明对所提取的蛋白进行定量。灭活后采用聚丙烯酰胺凝胶(SDS-PAGE)分离蛋白,湿转后将蛋白转至PVDF膜上,再采用5%脱脂牛奶进行封闭,2 h后加入一抗(Nrf2、HO-1和β-actin),于4 ℃下孵育过夜。缓冲液洗膜后,加二抗(IgG-HRP)共孵育1 h后进行ECL显影。以β-actin为内标,定量分析各组细胞中蛋白的表达情况。
1.3 数据处理
2 结果与分析
2.1 PNP40c-1对RAW264.7细胞活力的影响
利用MTT法测定不同浓度的PNP40c-1对RAW264.7细胞活力的影响,结果如图1所示。PNP40c-1作用浓度在25~200 μg/mL范围时,细胞活力有明显增加趋势,说明该多糖对巨噬细胞无毒性,且对其增殖活力无显著影响(P>0.05);但当浓度为400 μg/mL时,细胞活力与空白组相比有显著下降(P<0.05),说明过高剂量的PNP40c-1会抑制RAW264.7细胞的生长,存在细胞毒性。因此,选取PNP40c-1的浓度为25~200 μg/mL进行后续实验。

图1 不同浓度PNP40c-1对RAW264.7细胞活力的影响Fig.1 Effects of PNP40c-1 at differentconcentrations on RAW264.7 cell viability注:*:P<0.05,表示与空白组差异显著。
2.2 PNP40c-1对RAW264.7细胞吞噬能力的影响
吞噬作用是评价巨噬细胞活力的一个关键指标,也是巨噬细胞最基本的防卫机制之一,在非特异性免疫防护中具有重要作用[3]。如图2所示,在正常情况下,PNP40c-1在浓度25~200 μg/mL范围下,能够极显著提高巨噬细胞吞噬中性红的能力(P<0.01),且呈剂量依赖关系。LPS作为一种炎症刺激物,可极显著增强巨噬细胞的吞噬能力(P<0.01),其效果明显优于PNP40c-1;但从图2中可以发现,相比于LPS单独预处理的细胞,PNP40c-1+LPS预处理细胞的吞噬能力有极显著下降(P<0.01),但仍高于PNP40c-1单独预处理组和空白组。结果与Xiong 等[5]的报道相一致。因此可以说明,PNP40c-1能够刺激RAW264.7巨噬细胞,提高其吞噬能力,起到免疫调节作用。

图2 PNP40c-1和PNP40c-1+LPS对RAW264.7细胞吞噬能力的影响Fig.2 Effects of PNP40c-1 and PNP40c-1+LPSon phagocytosis of RAW264.7 cells注:*P<0.05表示与空白组差异显著;**P<0.01表示与空白组差异极显著;#P<0.05表示与LPS组差异极显著;##P<0.01表示与LPS组差异极显著;图3~图9同。
2.3 PNP40c-1对RAW264.7细胞NO及iNOS的影响
2.3.1 PNP40c-1对RAW264.7细胞释放NO的影响 NO作为一种重要的信号传导介质,参与多种生理活动和病理过程,其与免疫系统存在密切关系。NO在免疫调节方面具有双重作用,一方面NO是不可或缺的调节因子;另一方面,过量NO会诱导炎性因子的产生,引起炎症,导致组织损伤[17]。如图3所示,在正常情况下,100和200 μg/mL的PNP40c-1可以显著刺激巨噬细胞分泌NO(P<0.05);而当LPS诱导巨噬细胞过量分泌NO时,PNP40c-1又能够极显著抑制NO的产生(P<0.01),且在浓度范围25~200 μg/mL内该抑制作用呈剂量依赖性。PNP40c-1+LPS预处理组NO的分泌水平仍要明显高于PNP40c-1单独预处理组。结果表明,PNP40c-1在正常情况下可以刺激RAW264.7细胞少量分泌NO,起到防御和保护作用;而在LPS诱导炎症情况下,则能够抑制NO的过量产生,起到抗炎作用。

图3 PNP40c-1和PNP40c-1+LPS对RAW264.7细胞释放NO的影响Fig.3 Effects of PNP40c-1 and PNP40c-1+LPSon the secretion of NO in RAW264.7 cells
2.3.2 PNP40c-1对RAW264.7细胞iNOS的影响 在巨噬细胞中,NO的合成主要依赖于诱导型NOS,即iNOS;iNOS是在应激状态下催化生成NO的主要酶类,其在免疫应答中具有重要作用[18]。为了确定PNP40c-1抑制LPS诱导巨噬细胞中NO的过量分泌是否与iNOS有关,本实验对RAW264.7细胞中iNOS的酶活力及其mRNA的表达情况进行了研究。如图4所示,100和200 μg/mL PNP40c-1能够极显著提高RAW264.7细胞的iNOS酶活力(P<0.01),这与NO的结果一致;但从图5中可以发现,各剂量的PNP40c-1对巨噬细胞中iNOS的mRNA表达均无显著影响(P>0.05),虽然呈明显的上升趋势。这种mRNA水平与蛋白水平并不完全一致的现象可能是由基因在转录及转录后加工的过程中存在降解等现象,或是mRNA自身会受到miRNA等分子的调控等因素所造成[19]。在LPS诱导炎症的情况下,RAW264.7细胞的iNOS酶活力增加了3.67倍,mRNA的表达增加了9.50倍。PNP40c-1在25~200 μg/mL浓度范围内能够成剂量依赖性地有效抑制LPS所诱导的iNOS酶活力及其mRNA表达的骤增(P<0.01)。上述结果表明,PNP40c-1能够通过调节iNOS酶活力及其mRNA的表达而抑制LPS诱导下RAW264.7细胞中NO的过量分泌,从而起到缓解炎症反应的作用。
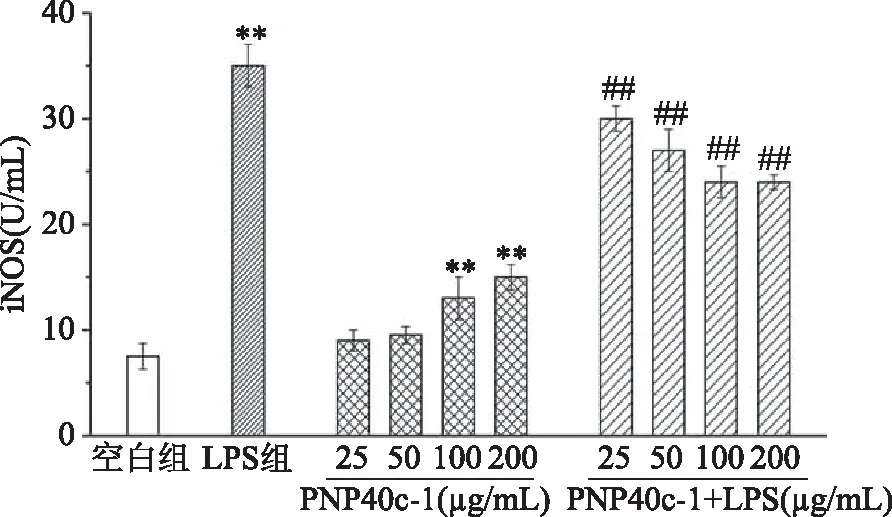
图4 PNP40c-1和PNP40c-1+LPS对RAW264.7细胞中iNOS酶活力的影响Fig.4 Effects of PNP40c-1 and PNP40c-1+LPSon the activities of iNOS in RAW264.7 cells
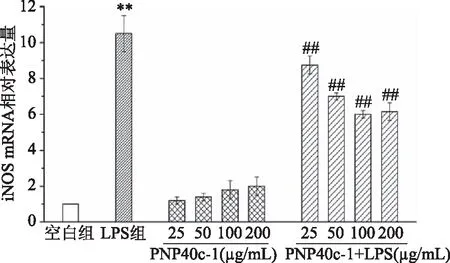
图5 PNP40c-1和PNP40c-1+LPS对RAW264.7细胞iNOS mRNA表达的影响Fig.5 Effects of PNP40c-1 and PNP40c-1+LPSon mRNA expression of iNOS in RAW264.7 cells
2.4 PNP40c-1对RAW264.7细胞分泌细胞因子的影响
2.4.1 PNP40c-1对细胞因子TNF-α、IL-1β和IL-6含量的影响 细胞因子是由免疫细胞(如巨噬细胞、T、B淋巴细胞等)或某些非免疫细胞(如表皮细胞等)在应激条件下合成分泌的一类小分子蛋白;其可以通过与受体结合调节细胞增殖、分化和效应而调控免疫应答。TNF-α、IL-1β和IL-6是介导炎症发生的主要因子,这些炎症因子不仅可以激活免疫细胞而起到免疫调节作用;也可以刺激其他炎症介质产生而引发炎症或加剧炎症[20]。
TNF-α参与免疫调节等多种生理和病理过程,其在诱导后会促进其它炎症介质如IL-1β和IL-6的分泌,加速炎症反应过程[16]。IL-1β则可以促进巨噬细胞的抗原呈递能力,吸引中性粒细胞而引发炎症,增强免疫细胞的杀伤能力等[21]。IL-6既是一种促炎因子,同时也是一种抗炎因子。当IL-6浓度相对较低时,可以增强免疫防御反应;当其浓度较高时,则会引发一系列慢性和急性炎症反应[22]。PNP40c-1及PNP40c-1+LPS对RAW264.7细胞分泌细胞因子的影响如表2所示。从表中数据可以发现,在细胞未受到外界刺激时,PNP40c-1能够显著刺激巨噬细胞分泌IL-1β和IL-6(P<0.05),发挥免疫调节作用;而当细胞受到LPS刺激时,三种细胞因子的含量极显著增加(P<0.01),TNF-α、IL-1β和IL-6分别增加4.24、3.61和5.56倍;过量炎症因子的产生会引发炎症反应。而PNP40c-1能够显著抑制LPS诱导的炎症因子的过量分泌(P<0.01),且呈现出剂量依赖性;这就说明PNP40c-1可以通过调节炎症因子的分泌而有效抑制LPS诱导RAW264.7细胞的炎症反应。
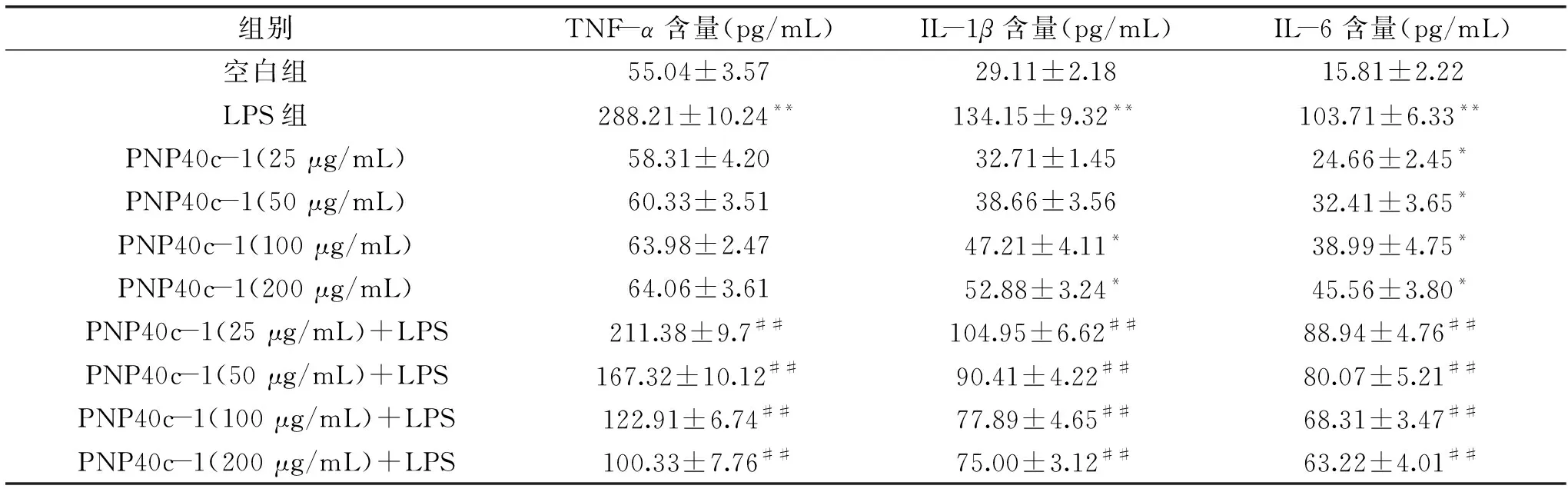
表2 PNPc-1和PNP40c-1+LPS对RAW264.7细胞分泌细胞因子的影响Table 2 Effects of PNP40c-1 and PNP40c-1+LPS on the secretion of cytokines in RAW264.7 cells
2.4.2 PNP40c-1对细胞因子TNF-α、IL-1β和IL-6 mRNA表达的影响 PNP40c-1对细胞因子TNF-α、IL-1β和IL-6 mRNA表达的影响如图6~图8所示。由图可见,在正常情况下,PNP40c-1对TNF-α和IL-1β的mRNA表达并无显著影响(P>0.05),但可以显著提高IL-6的mRNA水平(P<0.05);IL-6水平的提高可以增强细胞的免疫及防御能力。RAW264.7细胞在LPS诱导下,三种炎症因子的mRNA表达均极显著提高(P<0.01);而与LPS组相比,PNP40c-1可以呈现剂量依赖性地有效抑制TNF-α、IL-1β和IL-6 mRNA的表达。因此,PNP40c-1能够通过调节细胞因子mRNA的表达情况,抑制LPS诱导下炎症因子的过度分泌,从而起到抗炎作用。

图6 PNP40c-1和PNP40c-1+LPS对RAW264.7细胞中TNF-α mRNA表达的影响Fig.6 Effects of PNP40c-1 and PNP40c-1+LPSon mRNA expression of TNF-α in RAW264.7 cells

图7 PNP40c-1和PNP40c-1+LPS对RAW264.7细胞中IL-1β mRNA表达的影响Fig.7 Effects of PNP40c-1 and PNP40c-1+LPSon mRNA expression of IL-1β in RAW264.7 cells

图8 PNP40c-1和PNP40c-1+LPS对RAW264.7细胞中IL-6 mRNA表达的影响Fig.8 Effects of PNP40c-1 and PNP40c-1+LPSon mRNA expression of IL-6 in RAW264.7 cells
2.5 PNP40c-1对Nrf2/HO-1信号通路的影响
Nrf2/HO-1信号通路是经典的抗氧化通路之一,但近年来研究发现该通路在抗炎作用中也具有重要作用。Nrf2/HO-1信号通路可以通过负调控炎症因子和相关酶类的产生,抑制炎症因子过量表达所引起的恶性循环,从而起到抗炎作用[23]。同时,HO-1作为诱导型异构体限速酶也可以催化促炎因子血红素降解为胆红素、一氧化碳和游离铁离子;生成的胆红素不仅有助于保护HO-1,还可以抑制NO和iNOS的过量表达[24]。此外,Nrf2通过调控mRNA和蛋白的表达促进产生HO-1,也会抑制NF-κB信号途径,缓解炎症反应[25]。
通过上述实验结果可以发现PNP40c-1在抑制LPS诱导的RAW264.7细胞炎症反应中呈现剂量依赖性,且200 μg/mL浓度下PNP40c-1的作用效果最佳。因此,为了探究PNP40c-1抑制LPS诱导RAW264.7细胞炎症反应的机制是否与Nrf2/HO-1信号通路有关,本研究中对高剂量PNP40c-1(200 μg/mL)对LPS诱导的RAW264.7细胞中Nrf2和HO-1的mRNA和蛋白表达的变化情况进行了分析。如图9(a),200 μg/mL PNP40c-1极显著提高了LPS诱导下RAW264.7细胞中Nrf2和HO-1的 mRNA的表达(P<0.01);图9(b)也表明PNP40c-1预处理可显著上调RAW264.7细胞中Nrf2和HO-1的蛋白表达。该结果分别从基因水平和蛋白水平阐明PNP40c-1抑制LPS诱导RAW264.7细胞的炎症反应的分子机制与调节Nrf2/HO-1信号通路存在密切联系。虽然PNP40c-1在抑制LPS诱导的RAW264.7细胞分泌NO方面并未低于空白组,但对Nrf2/HO-1信号通路的影响却较为明显;出现这种现象的原因可能是RAW264.7细胞在LPS作用下,大量产生的活性氧族(ROS)和活性氮族(RNS)加剧了炎症的发展。一方面,不断产生的ROS会消耗Nrf2/HO-1通过抗氧化途径所生成的抗氧化酶等抗氧化物质,继而加速了Nrf2/HO-1的抗氧化途径,在一定程度上削弱了其抗炎作用;另一方面,持续产生的RNS也会促进RAW264.7细胞中NO的合成和分泌。此外,在Nrf2/HO-1抗炎机制中,对NO等炎症因子分泌的抑制作用也可能部分源于Nrf2对NF-κB和MAPK信号通路的负调控作用[22-23]。

图9 PNP40c-1对LPS诱导RAW264.7细胞中Nrf2和HO-1 mRNA和蛋白表达的影响Fig.9 Effects of PNP40c-1 on mRNA and protein expressionof Nrf2 and HO-1 in RAW264.7 cells induced by LPS
3 结论
本研究阐明了红松松仁多糖PNP40c-1对LPS诱导RAW264.7细胞炎症反应的抑制作用:在LPS诱发炎症的条件下,PNP40c-1以剂量依赖性显著提高巨噬细胞的吞噬能力(P<0.05),抑制LPS诱导后NO和iNOS的过量表达。此外,PNP40c-1还可通过Nrf2/HO-1信号通路调节炎症因子TNF-α,IL-1β和IL-6的分泌,缓解炎症反应。综上所述,红松松仁多糖PNP40c-1对LPS诱导的炎症反应具有一定的抑制作用,其作用机制与调控Nrf2/HO-1信号通路有关。因此,红松松仁多糖PNP40c-1可作为一种天然抗炎物质应用于食品及保健品等领域。同时,该项研究也为进一步开发松仁中生物活性成分提供了理论基础和参考依据。
