腈水合酶的稳定性改造研究进展
2020-06-17沈瑞华郭军玲周哲敏
沈瑞华,郭军玲,周哲敏
(1.江苏昌九农科化工有限公司,江苏 南通 226413;2.江南大学 生物工程学院,江苏 无锡 214122)
腈水合酶(nitrile hydratase,NHase,EC 4.2.1.84)是一种由α亚基和β亚基组成的金属酶[1],根据其活性中心螯合的金属离子不同,可将NHase分为铁型NHase(Fe-NHase)[2]和钴型NHase(Co-NHase)[3]。NHase主要来源于红球菌属(Rhodococcus)、假单胞菌属(Pseudomonas)、诺卡氏菌属(Nocardia)等原核生物,在植物病原菌和放线菌中也有发现[4],真核生物邻鞭毛虫(Monosigabrevicollis)中也有NHase的发现[5]。随着测序技术、生物信息学的发展,更多来源的NHase将被挖掘并深入研究,研究各种来源NHase的基因类型也对NHase的改造具有重要意义。
腈是带有—C≡N作为官能团的有机分子,通常对活生物体有毒。NHase作用于腈类物质的碳氮三键,催化腈类物质水合生成相应的酰胺类物质(图1)。晶体结构显示,不论是Fe-NHase还是Co-Nhase,金属离子作为构成催化中心的必要成分位于α亚基的活性中心内,且活性中心位于α和β亚基的交界面,活性位点含有高度保守的氨基酸序列(Cys-X-X-Cys-Ser-Cys),形成“爪状”结构,结合金属离子形成活性中心,其中2个半胱氨酸(在Ser两侧)的巯基被氧化成次磺酸和亚磺酸,形成Cys—SOH和Cys—SOOH[6-7]。随着生物信息学的发展,基于计算机辅助的酶分子改造已经取得了长足进步,不依赖于晶体结构的蛋白同源建模、分子对接及分子动力学模拟等技术极大地促进了对蛋白质结构的认识,Cheng等[8]基于量子力学/分子动力学(QM/MM)算法,完成了NHase活性中心爪状金属配位结构的计算模拟(图2(a)),建立了NHase活性中心的力场参数文件,并基于此构建了可信度极高的NHase模拟结构(图2(b))。值得注意的是,正确的金属配位结构和半胱氨酸氧化对NHase活性至关重要,相关位点的突变会影响NHase的酶活和稳定性,甚至导致其失活,因此对NHase进行改造时要尽量避免影响NHase的活性中心。
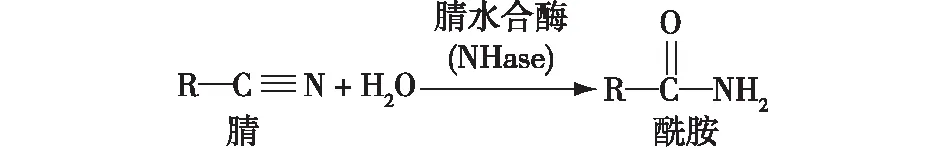
图1 NHase催化的水合反应Fig.1 Catalysis reaction of NHase
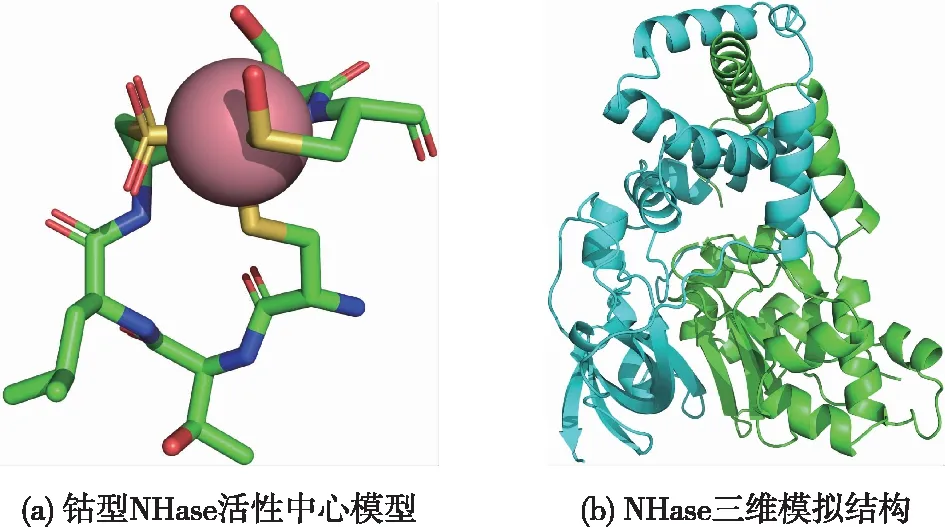
图2 NHase的同源建模Fig.2 Homology modeling structure of NHase
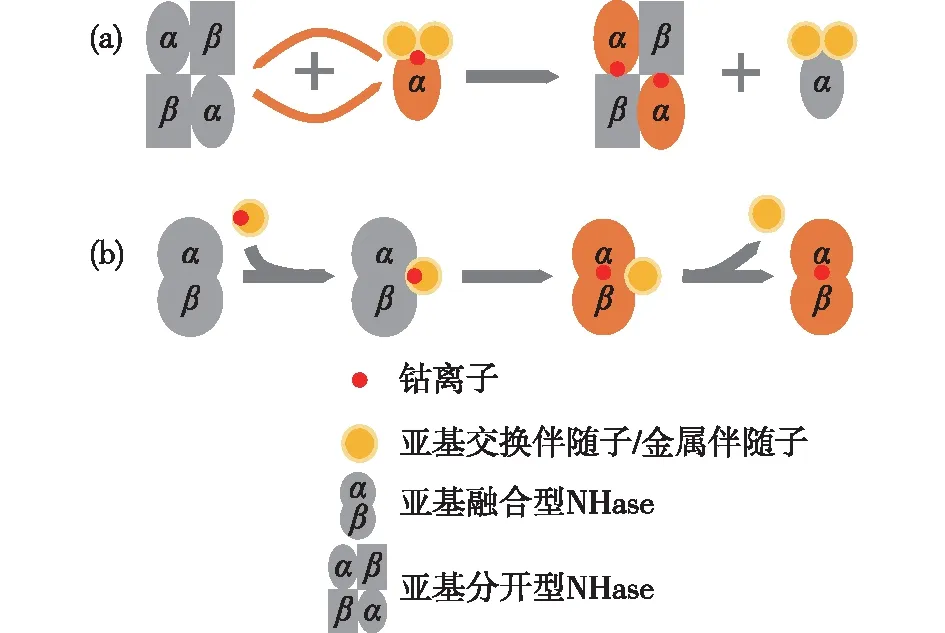
图3 NHase的翻译后成熟机制Fig.3 Post-translational maturation mechanisms of NHase
在原核来源的NHase中,α亚基和β亚基的结构基因下游通常具有一个开放阅读框(ORF),其编码的蛋白产物被称为调控蛋白,协助NHase获取金属离子,完成翻译后修饰,对于NHase的成熟十分重要[9]。Fe-NHase和Co-NHase的调控蛋白在分子量大小及序列相似性上有着明显差异[10-11]。目前认为Fe-NHase的调控蛋白作为金属伴随子,主要参与铁离子的运输,其分子量大约为4.7×104,并且具有一段保守基因序列CXCC,可能构成金属离子结合位点,对于该基序中3个保守的半胱氨酸残基进行突变,将影响Fe-NHase的正常表达[10]。而Co-NHase的调控蛋白大约为1.4×104,目前没有发现保守的金属结合基因序列[12],这种调控蛋白在NHase成熟过程中不仅能作为亚基交换伴随子参与金属传递,而且在亚基融合型NHase里也可直接发挥金属伴随子的功能来激活NHase(图3)。Zhou等[13]对来源于RhodococcusrhodochrousJ1的Co-NHase研究时发现,这种NHase的成熟,遵循一种“亚基自身交换”机制,调控蛋白作为亚基交换伴随子协助NHase的α亚基获取钴离子并激活NHase(图3(a))。Xia等[14]在对来源于Psedomonasputida的Co-NHase进行研究时发现,亚基融合后的NHase不能发生亚基自身交换,但调控蛋白仍可作为金属伴随子激活NHase(图3(b))。此外,也有报道来源于ComamonastestosteroniNi1的Fe-NHase和来源于真核生物M.brevicollis的Co-NHase的成熟则不需要调控蛋白,其成熟机制有待进一步研究[15]。
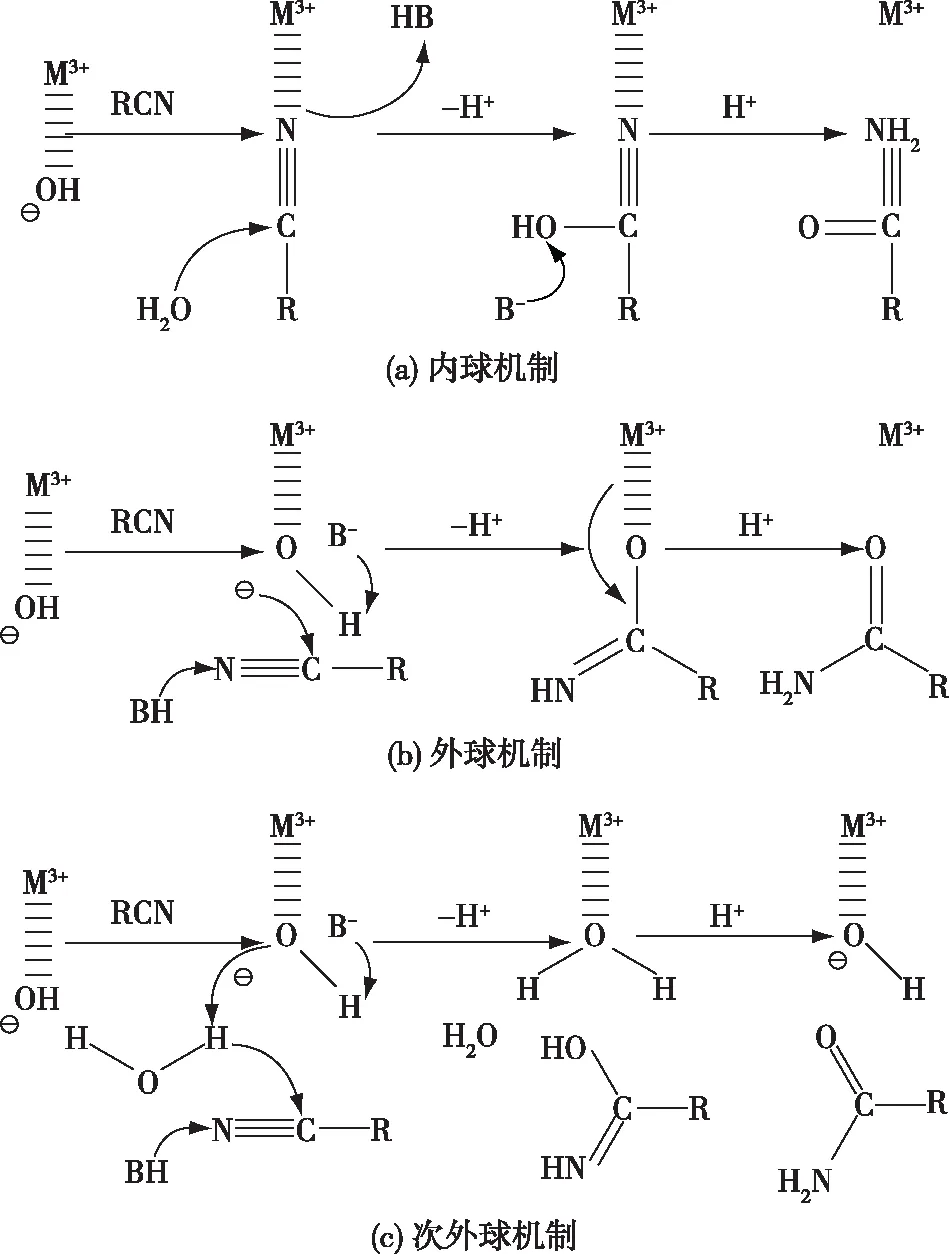
图4 提出的腈水合酶催化机制Fig.4 Proposed catalytic mechanisms of NHase
尽管越来越多的腈水合酶晶体结构得到解析,并对其催化机制进行了实验和计算研究,但其催化机制至今仍存在争议。Hopmann团队参与NHase催化机制研究多年,目前已提出且被人们接受的催化机制有3种:第一种称为内球机制(inner-sphere mechanism),腈类底物与活性中心的金属离子直接配位,底物的氰基碳原子受到周围的1个水分子的亲核攻击[16],产生了一种与金属成键的过渡中间态,然后释放酰胺产物,X线晶体学为实验数据提供了支撑[17](图4(a))。第二种称为外球机制(outer-sphere mechanism),活性中心的水分子结合到金属离子,然后进行去质子化(形成OH-),并与活性中心的金属离子配位,从而对附近的腈分子进行亲核攻击[18],氢原子与金属成键形成过渡态后重排,最终形成酰胺类产物(图4(b));第三种为次外球机制(second-outer sphere mechanism),与金属离子结合的OH-引起另一水分子的去质子化,新生成的氢氧根催化底物腈的水解,最终生成酰胺类产物[19](图4(c))。近年来,使用先进的计算方法和实验方法研究了腈水合酶催化腈水合的催化机制。例如,Vahe-Bandarian研究团队的Nelp等[7]用同位素示踪法证明产物酰胺中的氧原子来源于腈水合酶的氨基酸中的氧原子; MacDonald等[20]使用量子力学/分子力学模型研究NHase催化机制,探索了腈水合酶的完整催化机制,涉及半胱氨酸-亚磺酸作为亲核试剂,激活水分子以攻击腈底物,中间体经历互变异构以形成酰胺产物。这些工作并非主要用于确定哪种机制最可行,而是确定腈水合是否存在多种催化机制,为将来全面揭示NHase的催化机制提供理论依据。
1 腈水合酶的应用及存在缺点
腈水合酶的生物催化已迅速发展,在工业应用领域处于前沿,不仅在传统酰胺类物质的生产中,而且广泛应用在农药降解[21]、环境保护[22]等领域。在工业生产中,NHase主要应用于高纯度烟酰胺和丙烯酰胺的生产。
烟酰胺,也叫尼克酰胺,属于B族维生素,在医药领域中用来预防糙皮病,也用来作为食品和饲料添加剂,近年来亦作为护肤品原料广泛应用在美容行业。丙烯酰胺是一种重要的基础化工原料,在造纸(增强剂)、污水处理(凝素剂)、装潢(原料)以及石油开采(降阻剂)等方面发挥着重要作用。丙烯酰胺的酶法生产是绿色生物催化法代替化学合成法的典型案例,具有诸多优势如:工艺简单、反应条件温和、能耗低、“三废”少等。然而,大多数具有高活性的NHase在工业应用中稳定性较差,需严格控制反应温度,例如,来源于PseudomonaschlororaphilsB23、RhodococcusrhodochrousJ1、Rhodococcussp.N-774的NHase仅在20 ℃以下稳定[23-25]。
对于大多数工业酶,反应速度将随着催化温度增加而显著提高,但是酶在较高温度下会因构象变化而破坏蛋白结构,影响酶活甚至导致失活[26]。NHase在工业应用过程中普遍存在热稳定性差的问题,而腈类的水合过程属于放热反应,所以在工业催化过程中,需要用冷凝水来降低反应温度,从而造成能源浪费;另外,腈水合酶的不稳定还体现在对底物(腈类有机物)和产物(酰胺类有机物)的耐受性差,容易使腈水合酶失活,产物丙烯酰胺只能维持较低的水平,给后续的丙烯酰胺浓缩工艺带来影响。随着市场的不断拓展,酰胺类化合物的需求也日益剧增[27],因此,如何提高腈水合酶的热稳定性及产物耐受性已成为研究重点。
2 提高腈水合酶稳定性的分子改造策略
通常来说,获得高稳定性NHase的方法主要有筛选自然界中天然存在的高稳定性NHase和改造现有的NHase。挖掘新酶具有重要意义,不仅有可能筛选出耐高温耐有机溶剂的新型NHase,还能为研究者们改造现有酶提供新的方向。挖掘嗜热微生物来源的NHase以及对于腈水合酶进行体外定向进化同样能够筛选稳定性提升的突变体,有望未来能够实现工业菌株的更新换代。
近年来,多种分子改造策略已被用于提高NHase的稳定性,例如增设盐桥[28]、降低自由能[29]、同源片段交换[30]、基因融合[31]等。此外,在酶结构改造中,基于B因子的定点突变及半理性设计同样是提升热稳定的有效策略,利用B因子开发所谓的B-FIT定向进化方法以提高酶在有机化学和生物制造中的热稳定性[32],可以将该技术应用于提高NHase的稳定性。如在提高NHase稳定性的基础上再利用自动诱导分批补料策略[33]、细胞固定化[34-35]等策略可进一步拓展其工业应用价值。本文中,笔者总结了提高NHase稳定性的分子改造策略,为工业用酶的应用研究提供理论依据。
2.1 增设盐桥相互作用
嗜热微生物由于能在高温温泉及火山口附近的高热环境下生长而引起人们的极大关注,嗜热微生物来源的酶普遍具有较高的稳定性,通常能在高温下保持较高的催化活性。为了调查影响蛋白质稳定性的因素,Yokot等[36]比较分析了47对嗜热蛋白和嗜温蛋白,结果发现,嗜热蛋白比嗜温蛋白含有更多极性氨基酸残基并形成盐桥。例如,超嗜热古细菌Pseudomonasfuriosus中的谷氨酸脱氢酶中,每10个氨基酸残基有1.1个盐桥,而嗜温细菌Clostridiumsymbisun中的谷氨酸脱氢酶每10个氨基酸残基只有0.6个盐桥[37]。而且,随着总盐桥的增加及盐桥网络的比例提升,蛋白的耐热性明显增强,表明盐桥是影响蛋白质稳定性的直接因素之一[38]。因此,将盐桥相互作用引入目标酶是一种提高稳定性的有效策略。
Liu等[39]分析了来源于Pesudonocardiathermophila中的NHase和Bacillusthermophilic中的NHase晶体结构,发现盐桥在增强NHase稳定性中有重要作用,他们研究了在热力学作用下形成盐桥的氨基酸侧链区域结构的柔性,涉及天冬氨酸、精氨酸和谷氨酸等氨基酸残基,结果发现,亚基间的盐桥作用减少了整个蛋白质的波动,有利于酶稳定性的提高。Chen等[28]在来源于RhodococcusruberTH的NHase中确定了增加盐桥的合适区域和类型,通过计算来源于P.thermophila的NHase和B.thermophilic的NHase的均方根涨落(RMSF)值,确定了3个易于变形的热敏感区域(A1、A2和A3),将稳定的盐桥相互作用引入R.ruberTH中的NHase的相应区域,构建了3个突变体:NHase-TH-A1、NHase-TH-A2和 NHase-TH-A3。其中,突变体NHase-TH-A3的热稳定性提高了160%,产物耐受性提高了7%,对超声破碎的抵抗力提高了75%,同时酶活也有一定的提升。分子动力学(MD)模拟显示,具有中等均方根偏差(RMSD)值的NHase-TH-A3在亚基内部和亚基界面中均增加了10个新的盐桥(表1),从而证实了增设盐桥是增强酶稳定性的有效策略。由此可见,增设盐桥是增强酶的活性和稳定性的有效的蛋白质工程策略。
2.2 基于降低自由能构建突变体库
近年来,许多成功的例子已经证明定向进化是一个非常有效的改造方法,并且这种策略的设计并不高度依赖蛋白-功能的相互关系[40-41],无需了解酶的空间结构和催化机制,通过模拟自然进化、易错PCR或者化学及物理诱变等方法在体外改造酶的基因,进而改造酶学性质(包括热稳定性,底物范围和对映选择性等)。然而定向进化会出现大量的突变体,最终目标酶的筛选耗时耗力,因此,此方法的成功依赖高通量筛选方法的建立[42-43]。
与定向进化相比,基于结构解析的定点突变策略对提高酶的性能更加高效。随着酶学研究的进展,蛋白质结构与功能关系逐渐被阐明,基于对酶结构与功能相互关系的分析,人们开始通过计算生物学手段预测可能降低酶分子自由能位点,缩小了突变库,极大地减少了工作量,提高了酶稳定性的改造效率。通常来说,通过使用计算机模拟软件对目标蛋白进行同源建模,基于模拟结构解析,分析影响酶自由能的结构,再通过定点突变、迭代突变等手段改造酶的结构,可有效提高酶热的稳定性。Xia等[29]借助Rosetta计算折叠自由能ΔΔG(图5),得到了234个单点突变候选对象,并结合RMSF结果,最终构建了一个小的突变体库(17个突变体),筛选到稳定性和催化性能都提高的突变体。其中,3个突变体β-M150C、β-T173Y和β-S189E在50 ℃下,半衰期分别增加了32%、7%和107%,熔融温度(Tm)从原始酶的54.5 ℃分别提高到56.2、55.0和57.6 ℃,NHase的热稳定性显著增强。此外,3个突变体的kcat/Km值比原始酶分别提高1.1倍、1.5倍和2.2倍。这项研究说明,基于对结构的解析通过降低自由能来提高酶的稳定性更加高效和理性。
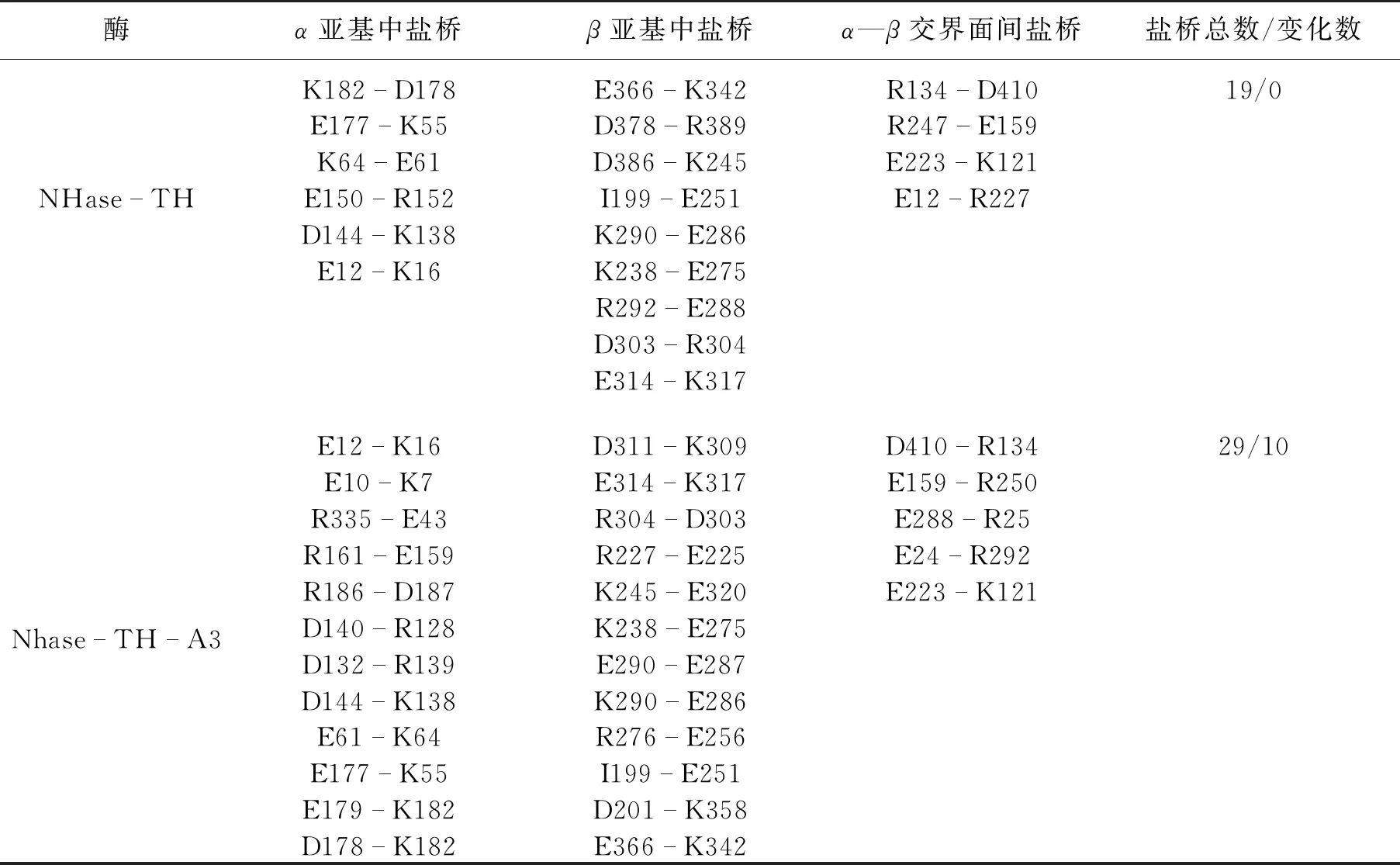
表1 突变体中的盐桥变化
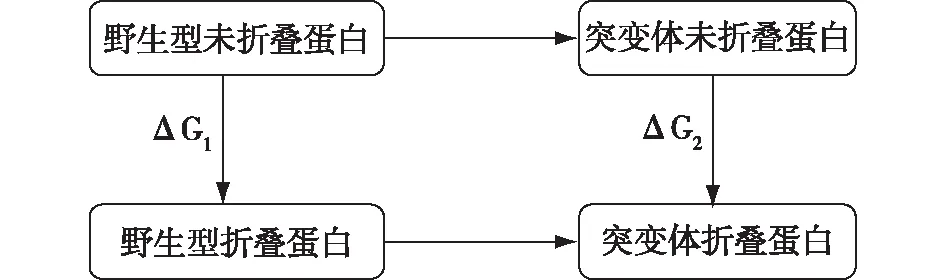
突变体和野生型蛋白质之间的ΔΔG=ΔG2-ΔG1图5 蛋白质的热力循环Fig.5 Thermodynamic cycle of protein
2.3 同源片段交换
近年来,诸多蛋白质工程方法被用来提高蛋白质的稳定性,其中同源重组方法是基于蛋白质结构进化信息,将不同来源的同源蛋白质片段整合到一个蛋白体,设计出高度变异但仍是天然折叠的嵌合蛋白[44]。通过构建杂合蛋白突变体库,可筛选得到稳定性高的酶。
Cui等[30]通过计算机模拟进行半理性设计,选择来源于P.thermophilaJCM3095和Comamonastestosterone的NHase的相关片段,以P.putidaNRRL-18668的NHase的β亚基片段作为模板,通过同源片段交换提高了NHase的稳定性,采用靶向氨基酸重组软件(STAR)设计杂合NHase,并进行分子动力学模拟以确定片段重组的交叉位点,最终构建了7种杂合酶(图6),构建的杂合NHase的热稳定性比原始酶提高了1.4至3.5倍,并显示整个C端结构域与NHase稳定性有关。
通过交换NHase的相应C端结构域也可有效提高NHase的稳定性,Sun等[45]将来自P.thermophila的热敏性NHase(BpNHase)的C端替换为来源于P.thermophila的相对热稳定NHase(PtNHase)的C端,构建了杂合NHase(SBpNHase),与原始BpNHase的熔融温度(Tm)为50 ℃相比,SBpNHase的Tm提高到55 ℃。此外,将Aurantimonasmanganoxydans来源NHase的β-6螺旋与来自P.thermophilaJCM3095的嗜热NHase片段交换,变异体的热稳定性显著提高,在40 ℃时的半衰期是野生型的2.4倍,并表明β亚基表面有一个额外的α-螺旋影响了该酶的稳定性[46]。这些结果表明同源蛋白片段交换是一种提高酶稳定性的有效方法。
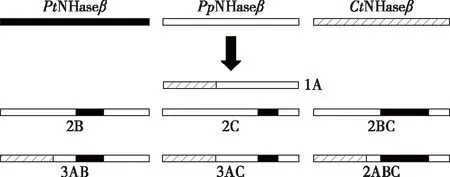
图6 杂合NHase的构建Fig.6 Construction of the chimeric NHases
2.4 基因融合
在生物体内,蛋白质一般以多个亚基集聚体形式存在,集聚体形式对于生物活性的发挥有着重大意义。但亚基聚集是通过氨基酸之间的次级键作用形成,由于次级键的作用力较弱,蛋白质容易受到环境的影响而出现解聚,进而影响蛋白质的性能。为了避免由于解聚而产生的影响,基因融合策略(技术处理两个或多个基因融合成一个开放阅读框)被应用于解决酶稳定性问题。
亚基融合可以增强蛋白质稳定性[47],融合策略倾向于通过简化蛋白质复杂的拓扑结构来优化组装[48]。NHase的亚基融合现象是在真核生物领鞭毛虫Monosigabrevicollis的NHase中发现的,通过17个组氨酸连接将其α亚基和β亚基天然融合成一个单一肽链[5]。受这种NHase基因类型的启发,Xia等[31]利用一段短肽将P.putida来源NHase的β亚基和α亚基进行融合,构建了单一肽的融合型NHase(图7),结果显示该融合型NHase的酶活和稳定性都得到了提高。
另外,自组装肽是一类由于侧链基团的相互作用而相互交联的特殊多肽,将自组装肽融合在蛋白质末端,可强化多肽之间的聚集,进而提高蛋白质的稳定性。Liu等[49]将P.putida来源的NHase与两个自组装肽(EAK16和ELK16)融合,结果显著提高了NHase的稳定性和产物耐受性。在50 ℃热处理30 min后,与野生型NHase完全失活相比,β-亚基N末端融合EAK16的NHase和β-亚基C末端融合ELK16的NHase分别保留了45%和50%的活性;在10%丙烯酰胺的缓冲液中处理后,野生型NHase保留30%活性,而β-亚基N末端融合EAK16的NHase和β-亚基C末端融合ELK16 的NHase分别保留了52%和55%的活性。Chen等[50]在尿素诱导和热激作用下对Rhodococcusruber进行转录组分析发现,伴侣分子GroEL2,具有很高的热稳定性,并且可以稳定其他蛋白质。融合型NHase-GroEL2活性提高了63.6%,稳定性评估表明,热处理和丙烯酰胺(AM)浸泡后的残留活性分别提高了2.9倍和1.1倍。这些稳定性和产品耐受性显著提高的融合性NHase有助于NHase的进一步工业化应用。
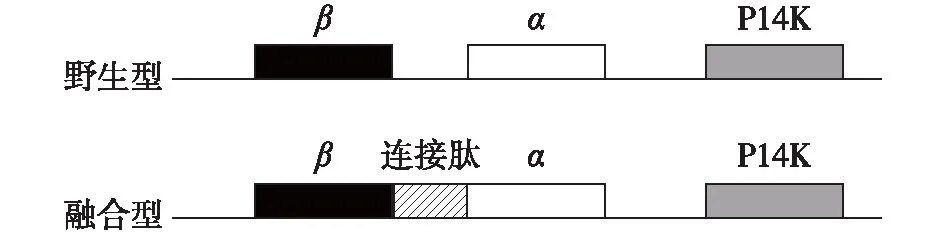
图7 融合型NHase的基因结构Fig.7 Gene structure of the fusion NHase
3 总结与展望
NHase的广泛应用吸引了大批研究者在相关领域开展研究,如:腈水合酶的生物催化、微生物法高效绿色生产酰胺类物质、生物代谢环境中腈从而保护环境,对改善人类生存环境和生活质量有重要意义。在NHase的应用中,主要是其低稳定性和低耐受性限制NHase的工业应用。本文中,笔者总结了近年来通过分子改造和蛋白质工程等提高NHase稳定性的方法,经改造后的NHase具有更高的稳定性。在过去的几十年中,原核腈水合酶主要用于工业酰胺生产和腈的生物修复,将来有必要进一步研究真核来源的腈水合酶并挖掘新的腈水合酶。随着宏基因组学、蛋白质工程、合成生物学和生物信息学等领域的飞速发展,更多来源NHase的发现、筛选和表征,NHase的生物合成机制、翻译后合成机制及催化机制方面将取得更大的进展。如果在不久的将来能够克服NHase低耐受性和低稳定性的局限性,则对该酶的研究有望进一步发展,这种绿色催化剂的应用也将更加广泛。
