基于树状大分子的纳米抗癌药物研究进展
2020-06-17朱静怡杨军星武明豪
朱静怡,杨军星,武明豪,黄 和
(1. 南京工业大学 药学院,江苏 南京 211800; 2. 天津医科大学肿瘤医院 国家肿瘤临床医学研究中心,天津 300060)
近些年来,癌症的发病率与死亡率不断攀升,使其成为继心脑血管等突发疾病之后的又一大人类健康杀手[1]。传统治疗癌症的药物具有一定的缺陷,基于癌细胞与体细胞的相似性,传统抗癌药物在杀死癌细胞的同时不可避免地对体细胞也具有杀伤作用,常伴随的副作用如肾毒性、心脏毒性、肝毒性、骨髓抑制等[2]。因此,如何使药物更高效地富集在肿瘤组织,如何更精确地定位到癌细胞且降低对正常细胞的伤害,成为了抗癌药物研发的首要难题。而纳米技术的兴起,一类名为树状大分子(dendrimer)的新型纳米级合成高分子进入了研究者的视野,有望解决这一难题。
树状大分子,顾名思义是指结构呈现树状,且高度支化的合成高分子,其结构如图1所示[3]。树状大分子由三部分组成,即:小分子内核、多分枝形成的内部空腔、外围功能基团。独特的树状分枝结构使其外围可进一步发生聚合反应以构建代数更高的树状大分子或修饰新颖功能分子赋予其新的特性[4]。除此之外,形成的内部空腔可包裹各类分子药物或纳米颗粒。基于其良好的结构优势,可作为纳米载体构建不同类型的纳米抗癌药物,并结合各抗癌治疗策略的特点实现肿瘤高效精准治疗[5-12]。
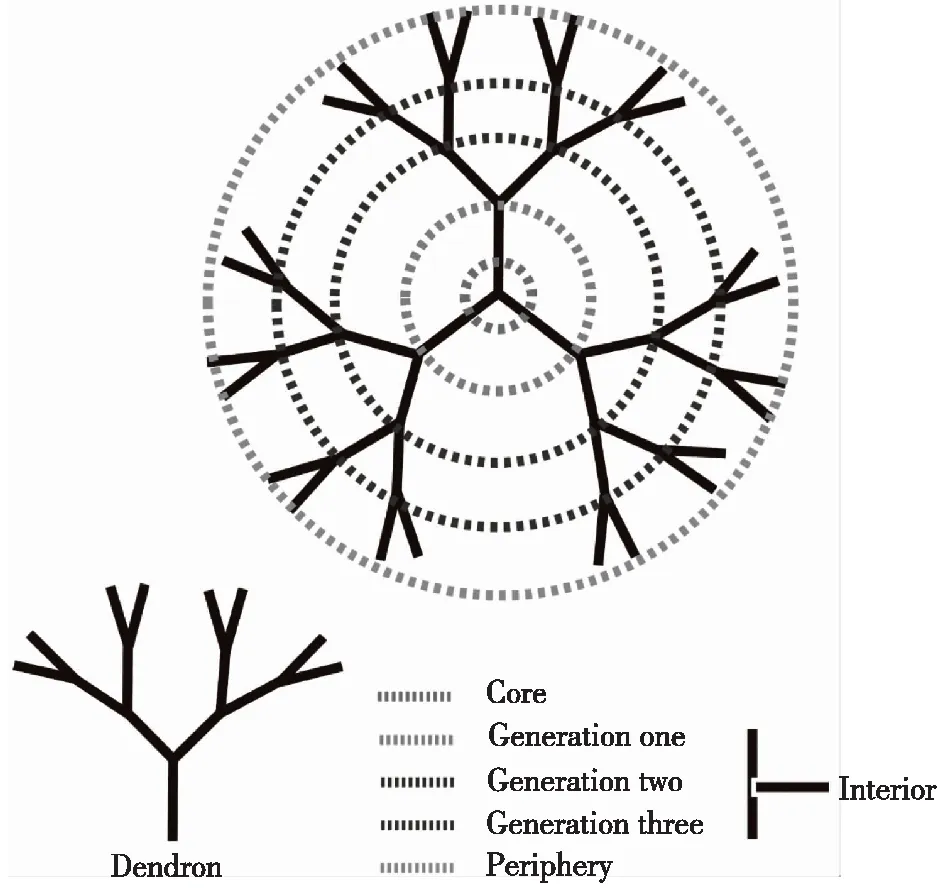
图1 树状大分子的剖面图[3]Fig.1 Anatomy of a dendrimer[3]
目前常见的癌症治疗方法包括:化学治疗、基因治疗、放射性治疗、光热治疗及光动力学治疗[13-17]。而这些治疗类癌症的抗癌药物普遍存在缺陷,如:无组织特异性、肿瘤部位低富集量、对正常组织脏器毒副作用大等[2]。因此,为弥补典型的抗肿瘤药物的缺陷,目前已有多种以树状大分子作为纳米载体的纳米抗癌药物被开发出,并证实可明显地提升其抗癌效应。基于树状大分子的纳米抗癌药物类型涵盖化学抗癌药物、基因抗癌药物、放射性抗癌药物、光热治疗药物及光动力学治疗药物,它们分别具有不同的抗癌特性。因此,本文中,笔者对近年来基于树状大分子的各类纳米抗癌药物的构建及其抗癌应用进行归纳,总结它们的特性和应用的优缺点,以期为构建新型抗肿瘤药物提供参考。
1 基于树状大分子的化学抗癌药物
基于树状大分子的结构优势,多分枝结构形成了内部空腔,终端官能团可进行多功能化修饰[18]。因此在肿瘤的化学治疗方面,树状大分子常与小分子化学抗癌药物结合,构建基于树状大分子的化学抗癌药物,其结合方式包括物理包裹[19]和化学键合[20]。
1.1 树状大分子物理包裹药物
树状大分子由于其疏水性空腔可用于物理包裹多种疏水性化学抗癌药物以实现药物的持续性缓释[21-22]。除此之外,亲水性的化学抗癌药物可与树状大分子表面官能团经氢键、范德华力及静电吸引相互作用形成络合物[18],以实现药物的有效负载。
Wang等[19]利用聚酰胺胺树状大分子作为纳米平台包裹抗癌药物,实现癌症的靶向治疗。首先将荧光示踪剂异硫氰酸荧光素(FI)和靶向试剂叶酸(FA)修饰在氨基终端的第5代(G5)聚酰胺胺树状大分子(PAMAM)表面,其次通过乙酰化反应来中和树状大分子表面剩余氨基,得到多功能化树状大分子(G5.NHAc-FI-FA)纳米平台,最后将抗癌药物2-甲氧基雌二醇(2-ME)包裹进G5.NHAc-FI-FA中,基于FA的修饰,形成的G5.NHAc-FI-FA/2-ME络合物可将化学抗癌药物2-ME定向递送至高叶酸受体表达(FAR)的癌细胞。每个树状大分子能包裹约3.7个2-ME,且表现出良好的水溶性和稳定性。形成的G5.NHAc-FI-FA/2-ME络合物能实现抗癌药物2-ME的持续缓释。构建的纳米抗癌药物能特异性地靶向高FAR癌细胞且能实现靶向癌细胞特异性治疗。这类多功能树状大分子可以用作一般药物载体包封各种抗癌药物,用于不同类型癌症的靶向治疗。
在这基础上,Zhu等[23]将修饰有螯合剂2,2′,2″-(10-(2-(2,5-二氧代吡咯烷-1-氧基)-2-氧乙基)-1,4,7,10-四氮杂环十二烷-1,4,7-三)三乙酸(DOTA)并螯合钆(Gd)离子的功能化聚酰胺胺树状大分子包裹阿霉素(DOX)用于癌细胞的靶向治疗。在该方法中,首先将螯合剂/钆(Gd)离子和聚乙二醇化的叶酸(PEG-FA)修饰到树状大分子表面,形成负载有钆离子的纳米平台,之后利用树状大分子特有的空腔结构将DOX载入其中,构建出G5.NHAc-DOTA(Gd)-PEG-FA/DOX络合物,实现DOX的有效缓释(图2)。经叶酸修饰的纳米抗癌药物会定向递送DOX至高叶酸受体表达的癌细胞中,并与之特异性结合。结合钆离子(Gd3+)的MR成像功能,该纳米抗癌药物既具有体外抗癌活性又可靶向癌细胞呈现MR显像特性。体外良好的MR成像及治疗效果为后期体内生物医学成像及抗肿瘤治疗奠定基础,也为实现临床应用提供可能。
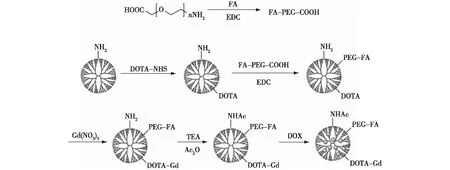
图2 G5.NHAc-DOTA(Gd)-PEG-FA/DOX络合物的合成路线[23]Fig.2 Schematic illustration of the synthesis of G5.NHAc-DOTA(Gd)-PEG-FA/DOX complexes[23]
目前构建的基于树状大分子物理包裹的化学抗癌药物能实现小分子药物的有效缓释,在体内血液循环过程中能保留较多DOX以避免对正常组织脏器的损伤,且提高了小分子药物的水溶性及稳定性。但存在载入的疏水性化学药物剂量有限的缺点,因为过量载入的疏水性药物易从载药体系中析出。
除此之外,物理包裹纳米载药体系由于树状大分子载体与小分子药物的相互作用力较弱,易在复杂的体内环境中提前释放出,从而对正常组织脏器具有毒副作用。因此,构建基于树状大分子的物理包裹抗癌药物在药物包封量及体内稳定性方面仍待改进,这也为构建新型树状大分子包裹抗癌药物提供了思路。
1.2 树状大分子化学键合药物
树状大分子的外围基团具有可修饰性,因此可利用共价键合法负载化学抗癌药物。与树状大分子物理包裹药物相比,树状大分子化学键合的药物在体内的化学稳定性较强,能特异性地结合肿瘤部位,以此可构建具有刺激响应性的功能化树状大分子化学键合药物[4,18]。
为解决小分子抗癌药物喜树碱(CPT)治疗癌症效果不佳的难题,Fox等[24]发现CPT共价键合的聚合物可提高CPT的溶解度、增加血液循环时间、增强肿瘤吸收且可显著提升药物疗效,因此其团队将CPT与天冬氨酸修饰的PEG化的聚赖氨酸(PLL)树状大分子共价键合。构建的药物共价键合纳米材料分子量为4.0×104,且每个树状大分子可载入质量分数4%~6%的CPT。CPT共价键合的功能化树状大分子具有长达(30.9±8.8) h的血液循环半衰期和组织注射量(4.2±2.3)%的肿瘤摄取量。而纯的CPT在血液循环30 min后,血液中的存留量就低于1%,CPT在肿瘤的富集量也只有组织注射量的(0.29±0.04)%。在对小鼠接种人类结肠癌(HT-29)肿瘤模型治疗效果方面,PEG化的PLL-CPT与未经药物处理及经临床治疗结肠癌常用药物伊立替康处理相比,PEG化的PLL-CPT纳米药物具有更高的治疗效率。除此之外,PEG化的PLL-CPT纳米药物能显著延长荷瘤鼠的存活率。
Zhu等[26]基于功能化树状大分子构建了新型纳米诊疗药物,首先,将FI、PEG-FA修饰的树状大分子作为载体,再次,以PEG为介质,将α-维生素E琥珀酸酯(α-TOS)通过PEG共价键合至功能化树状大分子载体平台表面,最后,包裹金纳米粒构建新型集CT成像及化学治疗为一体的纳米抗癌药物,且其在体内及体外具有比纯α-TOS更高的治疗效率。之后,Zhu等[25]又研究其抗癌机制,发现构建的α-TOS共价键合的功能化树状大分子包裹金纳米颗粒可诱导癌细胞产生出比纯α-TOS更高的活性氧(ROS)含量,活性氧的产生可有效促进癌细胞死亡。
目前基于树状大分子的化学键合药物被研究得较多,因其具有良好的体内稳定性,能够实现药物的良好递送,同时这类药物能根据肿瘤区域独特的生理特性进行刺激响应,释放提升肿瘤部位的药物富集,因而被广泛研究。但这类药物仍存在不足之处:树状大分子的化学键合的药物水溶性会受小分子抗癌药物的影响,在较大程度上提升药物负载量的同时会降低药物整体的水溶性及稳定性,长时间放置的化学纳米药物易沉淀。因此,构建新型的化学键合药物,在提升药物负载量的同时提升其水溶性及稳定性是以后发展的方向,有待研究完善。
2 基于树状大分子的基因抗癌药物
基因治疗是从基因根源入手定向地纠正、补偿缺陷基因进而恢复细胞正常功能的有效手段[27]。癌症的发生、发展涉及较多的是基因,因此如何高效修正癌症关联基因,诱导癌细胞的凋亡是癌症基因治疗亟待解决的问题。目前涉及基因治疗的方法主要有DNA治疗[28]、小干扰RNA(siRNA)治疗[29-30]及反义寡核苷酸治疗[31]。近年来基于树状大分子的基因递送体系已开发出不少案例,树状大分子能被作为良好的载体较多地用于基因递送体系,究其原因在于:①氨基终端的树状大分子属于阳离子型聚合物,附带正电荷,能与带负电的核酸(DNA/RNA)分子通过静电作用结合,有利于其被癌细胞吞噬;②树状大分子负载核酸分子后能将核酸分子有效压缩,使其粒径极大减小,有利于其进入细胞。除此之外,核酸被包裹在树状大分子空腔内,可保护核酸分子免受核酸酶的降解[6]。
Hou等[32]为了研发出既具有良好生物相容性又有高基因转染效率的携带质粒DNA(pDNA)/小干扰RNA(siRNA)的递送载体,将树状大分子包裹金纳米颗粒(Au DENPs)并部分修饰聚乙二醇单甲醚(mPEG),将其作为非病毒pDNA/siRNA递送载体(图3)。在该方法中,pDNA能编码荧光素酶(Luc)或增强绿色荧光蛋白(EGFP),选用的Bcl-2 siRNA能使Bcl-2蛋白表达沉默,最主要的原因是pDNA和Bcl-2 siRNA能成功地包载入部分PEG化的Au DENPs中,并高效递送至宫颈癌HeLa细胞中。通过系统地改变树状大分子表面修饰的mPEG链长及包裹的AuNPs的组成,来探讨它们对基因递送体系的结构、细胞毒性和pDNA或siRNA递送效率的影响。结果表明,mPEG的修饰及金纳米粒的包裹能极大提高荧光素酶和绿色荧光蛋白的编码,或使Bcl-2蛋白表达沉默。其中,分子量为2 000的mPEG修饰的树状大分子包裹的金纳米粒({(Au0)50-G5.NH2-mPEG2K} DENPs)在所有设计的部分PEG化的Au DENPs中具有最高的DNA或siRNA递送效率,其荧光素酶转染效率在N/P摩尔比为5∶ 1的情况下,是纯G5.NH2树状大分子的292倍;且Bcl-2蛋白能被该体系沉默至15%,以纯G5.NH2树状大分子转染的表达水平为100%为对照。该体系能提高pDNA/siRNA转染效率,且其毒性较低,这种PEG化的AuDENPs在pDNA及siRNA的递送应用中具有较好的应用前景。
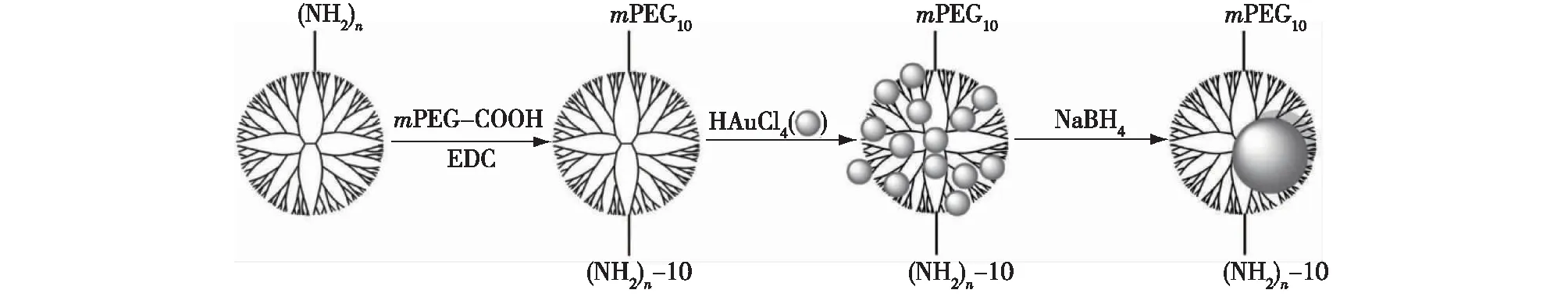
图3 部分PEG化的树状大分子包裹金纳米粒的合成示意图[32]Fig.3 Schematic illustration of the preparation of partially PEGylated Au DENPs[32]
由于树状大分子具有良好的平台作用,将功能化的树状大分子作为基因传递载体极大地提高了基因传递效率。但基于树状大分子的基因抗癌药物仍存在缺点。因为目前常用的基于树状大分子的基因抗癌药物运用的多数为阳离子型树状大分子,虽然它们能提高基因的有效负载,但也会产生一定的细胞毒性及体内免疫反应,因此这类树状大分子的基因抗癌药物只是在一定应用浓度范围内具有良好的生物相容性。如果将阳离子型树状大分子表面进行部分功能化修饰以提高其生物相容性,虽然能降低内源性阴离子物质的非特异结合作用,但这样做则会降低基因递送系统的细胞摄取效率,从而使基因转染效率降低。因此,开发出新型的功能化树状大分子基因递送系统,在提升其体内生物相容性的同时提高基因转染效率仍然是研究热点,需进一步深入研究。
3 基于树状大分子的放射性抗癌药物
癌症的核医学治疗通过放射性核素在衰变过程中发射出的射线来有效地杀死癌细胞[33]。常见的放射性核素包括锝-99m(99mTc)、铟-111(111In)、镓-67(67Ga)、铊-201(201Tl)及碘-131(131I)等自然界中存在的元素同位素。虽然这些放射性元素具有较高的灵敏度及治疗效率,能进行有效的肿瘤放射治疗,但是由于放射性核素属于小分子物质,无法在体内实现长时间循环,大大降低了肿瘤治疗效果,而且这些放射性元素在体内无组织特异性,易对正常组织脏器产生辐射危害[34]。因此,将小分子放射性核素与树状大分子结合,构建基于树状大分子的放射性抗癌药物是目前研究热点,已有相关研究者研发出相应的抗癌药物。
Zhu等[15]以第五代聚酰胺胺树状大分子为载体,将3-(4-羟基苯基)丙酸N-羟基琥珀酰亚胺酯(HPAO)和聚乙二醇化的叶酸(PEG-FA)修饰在其表面,其中以HPAO作为桥梁进行131I的标记,构建的功能化树状大分子标记载体(G5.NHAc-HPAO-PEG-FA),平均每个树状大分子上负载有9.4个HPAO,具有良好的生物相容性,且能与FAR表达的癌细胞特异性结合。基于HPAO的苯酚结构,放射性131I能够有效地标记于修饰有HPAO的功能化树状大分子表面,具有较高的放射性稳定性和放射性化学纯度,其具有良好的靶向FAR肿瘤核医学成像及放射性治疗的功效。相同时间段内,经131I-G5.NHAc-HPAO-PEG-FA放射性药物处理后的荷瘤鼠肿瘤生长速率低于其他药物。这种将树状大分子纳米技术与放射性核素结合的策略为新型放射性抗癌药物的构建指明了方向。
在Zhu等研究结果的基础上,Zhao等[35]进一步将氯毒素(CTX)修饰在功能化树状大分子表面,其以马来酰亚胺和琥珀酰亚胺封端的聚乙二醇(MAL-PEG-SVA)作为中介,将CTX-SH通过巯基与MAL-PEG-SVA的马来酰亚胺共价键合实现CTX的桥连。CTX的修饰能使功能化树状大分子与基质金属蛋白酶-2(MMP-2)过表达的癌细胞靶向结合,可实现对神经胶质瘤的靶向特异性成像和放射性治疗。
目前基于树状大分子的放射性抗癌药物发展趋势良好,通过靶向试剂的修饰,构建的功能化树状大分子能够有效提高放射性标记物在肿瘤处的富集。相较于传统的放射性治疗,功能化的放射性抗癌药物提高了放射性核素在体内血液循环的时间,对正常组织脏器的辐射作用有了很大幅度的减少,但由于纳米材料的特定粒径分布(0.1~100 nm),导致它们较易被网状内皮系统(reticulo-endothelial system,RES)所摄取,且其抗蛋白吸附能力较弱。因此,如何降低网状内皮系统对功能化的放射性抗癌药物的摄取量,提高其抗蛋白吸附能力仍然是目前亟待解决的问题,有待优化改善。
4 基于树状大分子的光热治疗药物
光热治疗作为一种新兴的肿瘤治疗方法,是将具有高光热转换效率的材料注入体内,在近红外光辐照下将光能转换为热能,在光热材料富集处产生局部高温,使肿瘤部位升温至41~45 ℃,对细胞核内部DNA、RNA和蛋白质造成不可逆的损伤[36-37]。再结合靶向识别技术提高材料在肿瘤部位富集量,可进一步提高光热治疗效率,以达到肿瘤定向治疗的目的。基于常见的纳米光热材料存在靶向特异性较差的缺陷,目前研究者将树状大分子与光热材料有机结合,通过树状大分子纳米技术改善纳米光热材料性能。
Zhou等[38]以功能化树状大分子作为模板构建光热治疗试剂,基于树状大分子内部空腔结构可用于包裹金属纳米颗粒,根据这一特性构建树状大分子包裹金属纳米光热材料,包括:硫化铜(CuS)、铂(Pt)和钯(Pd)金属纳米颗粒,其具有小于5 nm的尺寸且显示了良好的光热转化效果。他们以构建的树状大分子包裹铂纳米光热材料作为优化的光热试剂,进一步分别修饰反式激活转录激活子(TAT)和环状精氨酸-甘氨酸-天冬氨酸(RGD)肽,可实现较高的癌细胞摄取及靶向肿瘤递送效果。通过修饰荧光探针Cy5.5来进行纳米光热材料在体内的实时成像并追踪纳米颗粒的分布。体内研究结果表明,RGD修饰的树状大分子包裹铂纳米光热材料在近红外光辐照下有效地延缓了肿瘤的生长。TAT肽和RGD肽的修饰表明,通过靶向分子的介导,他们均可实现癌细胞的高量摄取。基于Cy5.5的荧光示踪,靶向试剂修饰的树状大分子包裹铂纳米光热材料在肿瘤处具有较高的荧光信号。与非靶向试剂修饰的树状大分子包裹铂纳米光热材料相比,靶向试剂修饰的树状大分子包裹铂纳米光热材料在肝脏和脾脏中的荧光强度明显减弱,证明其能够减少在肝脏及脾脏中的分布。
Wei等[39]将RGD修饰在第三代聚酰胺胺树状大分子的端位,并以其为平台稳定纳米金星(Au NSs)络合siRNA用于肿瘤靶向CT成像、光热/基因治疗,结果表明:RGD-Au DSNSs能特异性地递送siRNA至αvβ3过表达的肿瘤细胞,且构建的纳米复合体系根据其稳定的纳米金星可进行高效光热治疗,在近红外光辐照下,经过RGD-Au DSNS/siRNA络合物处理后的细胞活性为20.2%,明显低于只经光热治疗及基因治疗的癌细胞活性,并且在体内实验中其仍能实现肿瘤部位的高效光热/基因治疗。
Chung等[40]合成卟啉类树状大分子并用于包裹金纳米壳实现肿瘤的光热及光动力联合治疗。构建的卟啉类树状大分子包裹金纳米壳可有效诱导癌细胞产生活性氧,从而提升其光热/光动力治疗效率。形成的带有负电的卟啉类树状大分子显示出了高的光动力效率,树状大分子的楔形结构不仅能有效分离光功能性卟啉而且还能在较高浓度下抑制卟啉分子淬灭。
目前构建的基于树状大分子的纳米光热材料虽然能够有效地提高光热材料在肿瘤处的富集及光热治疗效率,但由于在近红外光区(800~2 500 nm)形成的具有光吸收的材料均具有较大粒径,在长期放置的过程中较易沉淀。因此构建新型基于树状大分子的光热材料,使其在具有较高光热转换效率的同时通过功能化修饰赋予其良好的水溶性及稳定性,仍然是基于树状大分子的光热治疗药物亟待解决的问题,有待进一步研究。
5 基于树状大分子的光动力学治疗药物
肿瘤的光动力学疗法是将光敏剂注入体内,使其随血液循环传播至身体各处,再以特定波长光照射肿瘤病变部位,光选择性地激活肿瘤处的光敏剂从而通过一系列的反应产生具有强细胞毒性的氧自由基、单线态氧、过氧化物等[41-42],从而杀死癌细胞,达到肿瘤治疗的目的。由于此方法具有无创伤性、无毒性等特性,目前已成为临床上肿瘤治疗不可替代的方法。但由于光敏剂自身缺乏组织特异性,因此无法在肿瘤处实现较大量的富集,限制了其肿瘤光动力学治疗效率。基于树状大分子良好的理化性质及结构,目前已有相关研究工作将光敏剂与树状大分子结合,基于树状大分子纳米技术实现较高光动力学治疗效率。
Battah等[43]将光敏剂5-氨基乙酰丙酸(5-ALA)并入到功能化树状大分子中,将18个5-ALA通过酯键连接到芳香内核中,树状大分子能实现5-ALA在细胞内的递送及释放。当达到优化浓度(0.1 mmol/L)时,与5-ALA用于卟啉合成相比,树状大分子的递送实现了更高的卟啉合成效率。细胞内的卟啉荧光水平与光照下的细胞光毒性呈现良好关联,随着浓度的增长,细胞存活率逐渐降低,且其具有最低限度的暗毒性。功能化的树状大分子通过巨胞饮途径实现内吞。构建的这种树状大分子衍生物能够有效地递送5-ALA至细胞实现持续性的卟啉合成。
Zhang等[44]合成了新型的具有32个伯胺基的第三代芳醚卟啉类树状大分子([NH2CH2CH2-NHCO]32DPZn),其中聚离子复合物胶束由卟啉类树状大分子和PEG化的聚天冬氨酸组成。构建的这类纳米复合物作为新型光敏剂可用于肺癌细胞的光动力学治疗。静电自组装导致了卟啉核的索瑞特峰红移且荧光强度提升。与普通卟啉类树状大分子相比,并入聚离子复合物胶束的卟啉类树状大分子具有相对较低的细胞摄取量,然而显示出了增强的光动力学效率。运用聚离子复合物胶束作为递送系统可降低阳离子型卟啉类树状大分子的暗毒性,也是基于胶束中PEG外壳提升了纳米复合物的生物相容性。
目前基于树状大分子的肿瘤光动力学治疗药物虽能将光敏剂有效地递送至肿瘤部位,且能提高光敏剂的生物相容性,但其仍然存在一定的缺陷,如构建的基于树状大分子的纳米光敏剂排泄缓慢、易发生光毒反应、受特定波长光照的作用,因此在光源穿透组织深度上有一定的限制,根深于组织较深处的肿瘤受到的光辐照作用小,导致其具有的光动力学治疗效率较低。因此,目前开发出新型稳定、生物相容性更好且光吸收系数较高的光敏剂是该领域的热点,为以后临床肿瘤光动力学治疗明确了研究方向。
6 总结与展望
基于树状大分子多种抗癌药物的构建以及其抗癌应用,涵盖化学抗癌药物、基因抗癌药物、放射性抗癌药物、光热治疗药物和光动力学治疗药物。通过综述现今的相关研究工作可知,树状大分子对于药物,无论是化学、基因、放射性、光热治疗还是光动力学药物,都可以作为良好的载体来构建不同类型的肿瘤治疗药物,这也是基于树状大分子优良的结构特点和理化性质所决定的。与这些在体内生物医学应用中存在困难或缺点的药物完美结合,通过树状大分子的功能化修饰提高其药物治疗的精确性、体内稳定性、生物相容性、病灶部位的药物浓度,进而提升治疗效果。
根据树状大分子性质温和、尺寸可控的特点,可在纳米尺度上实现肿瘤的有效治疗,这也是树状大分子在生物医学领域得以发展的基础。但目前基于树状大分子的纳米抗癌药物仍存在一定的缺陷,抗癌药物种类繁多、性质各异,树状大分子自身具有的双亲性质仅能改善药物的水溶性及稳定性,在较大量药物负载的情况下,药物仍然易于从树状大分子包载范围内逃逸出,且对整个纳米药物体系的水溶性及稳定性有所影响。因此,亟待设计开发出具有良好功能特点的功能化树状大分子改善其药物负载后材料水溶性及稳定性,根据不同药物的特点,构建更为符合对应治疗需求的纳米抗癌药物,并将其作为模板,进一步推广应用至更多的疾病治疗中去。
